Трансплантация фекальной микробиоты плюс иммунотерапия анти-PD-1 при распространенной меланоме: исследование фазы I
КОММЕНТАРИИ К СТАТЬЕ - Раздел, посвященный взрослым
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и диетологии, Больница Сент-Антуан (Saint-Antoine Hospital), Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Комментарии к статье Routy et al., Nature Medicine 2023 [1]
Трансплантация фекальной микробиоты (ТФМ) потенциально может устранить резистентность к ингибиторам контрольных точек иммунного ответа у пациентов с рефрактерной меланомой; однако роль ТФМ в условиях терапии первой линии еще не оценивалась. Авторы провели многоцентровое исследование фазы I, где изучили применение комбинации ТФМ от здорового донора плюс ингибитор PD-1 ниволумаб или пембролизумаб у 20 пациентов с распространенной меланомой, ранее не получавших лечения. Первичной конечной точкой была безопасность. О явлениях 3 степени тяжести, связанных с ТФМ, не сообщалось. У пяти пациентов (25%) после комбинированной терапии наблюдались иммуноопосредованные нежелательные явления 3 степени. Основными вторичными конечными точками были частота объективного ответа, изменения в составе кишечного микробиома и системные показатели иммунной системы и метаболомики. Частота объективного ответа составила 65% (13 из 20), включая четыре (20%) полных ответа. Результаты продольного профилирования микробиома показали приживление донорских штаммов у всех пациентов. У пациентов, ответивших на лечение, приобретенная схожесть между донорскими и собственными микробиомами со временем увеличивалась. После ТФМ в микробиоте пациентов, ответивших на лечение, содержалось больше иммуногенных и меньше вредных бактерий. Результаты показали, что ТФМ здоровых доноров безопасна в условиях терапии первой линии и требует дальнейшего изучения при использовании в комбинации с ингибиторами контрольных
точек иммунного ответа.
Что нам уже известно по этой теме?
Почти у половины пациентов с распространенной меланомой, получающих монотерапию анти-PD-1, развивается первичная резистентность, что подчеркивает необходимость разработки новых стратегий лечения для улучшения ответа на ингибиторы контрольных точек иммунного ответа (ИКТ). Хотя комбинация анти-PD-1 и анти-CTLA4 (антиген-4, ассоциированный с цитотоксическими Т-лимфоцитами) увеличивает частоту ответа, возможности этой терапии ограничены большим количеством иммуноопосредованных нежелательных явлений(иоНЯ). Кишечный микробиом, как оказалось, является важным регулятором местных и системных иммунных реакций. Результаты нескольких исследований у онкологических пациентов, получавших ИКТ, показали связь между определенными кишечными бактериями и иммунным ответом, а также побочными эффектами [1]. Если точнее, присутствие некоторых комменсальных родов, таких как Ruminococcus, Faecalibacterium и Eubacterium, было связано с положительными результатами у пациентов с меланомой [2]. Терапевтический потенциал кишечного микробиома был впервые показан на мышиных моделях, где комбинация ИКТ + ТФМ с использованием фекалий пациентов, не ответивших на лечение (NR), ассоциировалась с резистентностью к ИКТ [1]. Два исследования показали, что ТФМ у пациентов с долгосрочным ответом на терапию ИКТ позволяла преодолеть резистентность к анти-PD-1 почти у 30% пациентов с меланомой, резистентной к ИКТ [3, 4]. В этих исследованиях микробиота пациентов изменилась после ТФМ, при этом у пациентов с ответом (R) наблюдалось увеличение содержания Ruminococcaceae и Bifidobacteriaceae, наряду с перепрограммированием микроокружения опухоли в виде увеличения инфильтрации CD8+ Т-клетками и активации сигнального пути интерферона-γ. Эти данные доказывают потенциальную эффективность вмешательств на уровне микробиома для преодоления резистентности к ИКТ при меланоме.
Каковы основные выводы этого исследования?
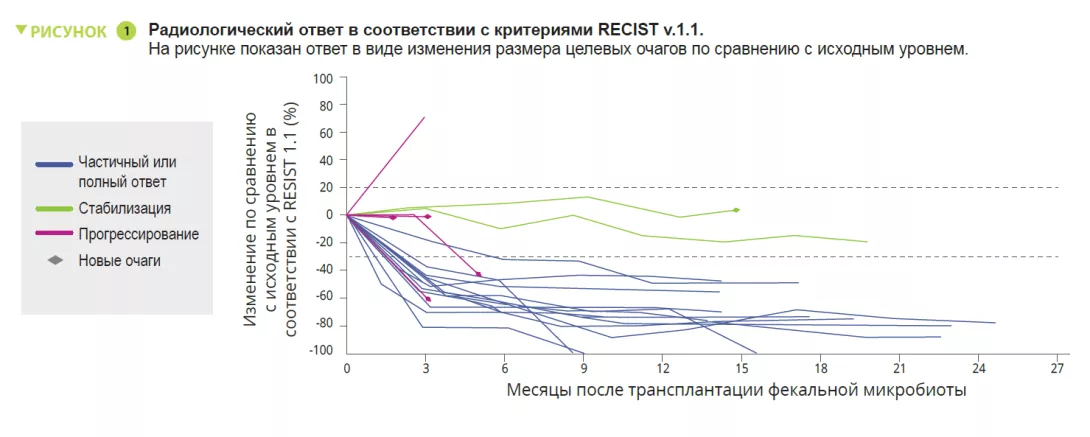
В этой статье авторы сообщили о клинических и трансляционных результатах исследования фазы I (NCT03772899), в котором применяли комбинацию ТФМ здорового донора + ингибитор PD-1 ниволумаб или пембролизумаб у пациентов с распространенной меланомой, ранее не получавших лечения (рисунок 1). Наблюдаемые токсические эффекты (85% иоНЯ, из которых 25% — явления 3 степени и 0 явлений 4 или 5 степени) не отличались от наблюдаемых в исследованиях анти-PD-1 III фазы. Наблюдаемая клиническая эффективность (объективный ответ 65%) была выше, чем в монотерапии ниволумабом и пембролизумабом в исследованиях III фазы (объективный ответ 42-45%) и, согласно данным реальной практики (объективный ответ 17,2-51,6%). Однако, отсутствие контрольной группы и небольшой объем выборки затрудняли интерпретацию результатов.
В отличие от предыдущих исследований [3, 4], в данном исследовании участвовали пациенты, получающие терапию первой линии, ТФМ проводилась однократно с помощью пероральных капсул, доноры были здоровыми добровольцами (а не пациентами, ответившими на терапию ИКТ) и, наконец, для приготовления препарата использовался только ПЭГ (без антибиотиков). Изучая микробиоту доноров и реципиентов, авторы отметили, что микробиота ответивших на лечение содержала больше Ruminococcus SGB15234 и SGB15229, Alistipes communis, Eubacterium ramuleus и Faecalibacterium SGB15346, и меньше — Enterocloster aldensis и Enterocloster clostridioformis. В предыдущих исследованиях увеличение численности Faecalibacterium также ассоциировалось с ответом на ИКТ [3, 4].
Затем авторы провели эксперимент с введением мышам микробиоты человека, результаты которого показали сходную эффективность ТФМ с использованием фекалий здоровых добровольцев в контексте увеличения инфильтрации CD8+ T лимфоцитами памяти в микроокружении опухоли.
Практические результаты
Несмотря на ограничения, это исследование показало, что модуляция микробиоты с помощью ТФМ может повысить эффективность ИКТ в условиях первой линии терапии метастатической меланомы. Хотя широкое использование ТФМ в современной практике все еще затруднительно, модулирование микробиоты, в частности, с помощью пробиотиков нового поколения, в сочетании с ИКТ может стать стандартным лечением.
- Кишечная микробиота влияет на результаты лечения ИКТ
- ТФМ здоровых доноров возможна и безопасна у пациентов с метастатической меланомой, получающих ИКТ в условиях первой линии терапии
- Несмотря на ограничения, связанные с отсутствием контрольной группы и небольшим размером выборки, клиническая эффективность у пациентов, получающих ТФМ в сочетании с ИКТ, была выше, чем при монотерапии ИКТ в клинических исследованиях III фазы и в реальной практике
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что ТФМ здоровых доноров возможна и безопасна у пациентов с метастатической меланомой, получающих ИКТ в условиях первой линии терапии. Модулирование микробиоты с помощью ТФМ или других методов может повысить эффективность ИКТ, хотя для подтверждения полученных данных необходимы более крупные контролируемые исследования.
1. Routy B, Lenehan JG, Miller WH Jr, et al. Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase I trial. Nat Med 2023; 29: 2121-32.
2. Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97–103.
3. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602–9.
4. Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science 2021 ; 371 : 595–602.


