Trasplante de microbiota fecal combinado con inmunoterapia anti-PD-1 en el marco de un melanoma avanzado: ensayo de fase I
ARTÍCULO COMENTADO - Adulto
Por el Prof. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Comentario del artículo Routy et al., Nature Medicine 2023 [1]
El trasplante de microbiota fecal (TMF) es una posible estrategia para superar la resistencia a los inhibidores del punto de control inmunitario en pacientes con melanoma refractario; sin embargo, no se ha evaluado la función del TMF en el contexto de un tratamiento de primera línea. Los autores realizaron un ensayo multicéntrico de fase I que combinaba el TMF de donantes sanos con los inhibidores de PD-1 nivolumab o pembrolizumab en 20 pacientes con melanoma avanzado que no habían recibido tratamiento previo. El criterio de evaluación principal fue la seguridad. No se notificó ningún acontecimiento adverso de grado 3 durante el TMF. Cinco pacientes (el 25 %) presentaron reacciones adversas de grado 3 relacionadas con el sistema inmunitario tras la terapia combinada. Los principales criterios de evaluación secundarios fueron la tasa de respuesta objetiva, los cambios en la composición del microbioma intestinal y los análisis inmunitarios y metabolómicos sistémicos. La tasa de respuesta objetiva fue del 65 % (13 de 20), incluidas cuatro (20 %) respuestas completas. El perfil longitudinal del microbioma reveló que todos los pacientes estaban colonizados por cepas de sus respectivos donantes. Sin embargo, la similitud adquirida entre los microbiomas de donantes y pacientes solo aumentó con el paso del tiempo en los pacientes que respondieron al tratamiento. En estos últimos se observó un enriquecimiento de bacterias inmunogénicas y una pérdida de bacterias nocivas tras el TMF. Estos resultados demuestran que el TMF a partir de donantes sanos es seguro como tratamiento de primera línea y que merece ser estudiado más a fondo en combinación con inhibidores del punto de control inmunitario.
¿Qué se sabe ya sobre este tema?
Casi la mitad de los pacientes con melanoma avanzado que reciben monoterapia de anti-PD-1 presentan resistencia primaria, lo que pone de relieve la necesidad de desarrollar nuevas estrategias terapéuticas para mejorar la respuesta a los inhibidores del punto de control inmunitario (IPC). Aunque la combinación de anti-PD-1 y de anti-CTLA4 (cytotoxic T lymphocyte-associated antigen-4) aumenta la tasa de respuesta, este tratamiento está limitado por una alta tasa de reacciones adversas relacionadas la inmunidad (RA-Ri). El microbioma intestinal se ha revelado como un regulador fundamental de las respuestas inmunitarias locales y sistémicas. Varios estudios en pacientes con cáncer tratados con IPC han demostrado que hay bacterias intestinales específicas asociadas a la vez a la respuesta y a las reacciones adversas relacionadas con el sistema inmunitario [1]. Más concretamente, la presencia de ciertos géneros comensales como Ruminococcus, Faecalibacterium y Eubacterium, se ha asociado a resultados favorables en pacientes con melanoma [2]. El potencial terapéutico del microbioma intestinal se ha demostrado por primera vez en modelos de ratones mediante una combinación de IPC con TMF, utilizando materia fecal procedente de pacientes que no respondieron (NR) al tratamiento y que se asociaron a la resistencia a los IPC [1]. Dos estudios han demostrado que el TMF de pacientes que respondieron a largo plazo a un tratamiento con IPC elude la resistencia al anti-PD-1 en hasta el 30 % de los pacientes con melanoma refractario al IPC [3, 4]. En estos estudios, la microbiota de los pacientes cambió tras el TMF, y en los pacientes que respondieron bien (R) al tratamiento se observó un aumento de Ruminococcaceae y de Bifidobacteriaceae, además de la reprogramación del microentorno tumoral con un aumento de la infiltración de los linfocitos T CD8+ y de la señalización del interferón γ. Estos resultados clínicos confirman el potencial de las intervenciones basadas en los microbiomas para superar la resistencia a los IPC en el melanoma.
¿Cuáles son los principales resultados aportados por este estudio?
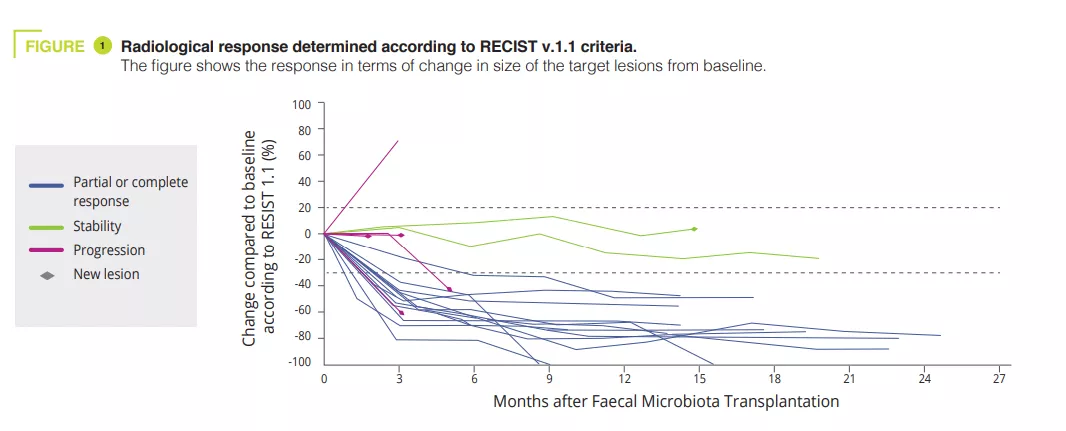
• Los autores presentan aquí los resultados clínicos y traslacionales de un ensayo de fase I (NCT03772899) que combina el TMF con materia fecal de donantes sanos y anti-PD-1 en pacientes con melanoma avanzado y que no habían recibido tratamiento previo (figura 1).La toxicidad observada (un 85 % de RA-Ri, incluido un 25 % de toxicidad de grado 3 y ninguna toxicidad de grado 4 o 5) fue similar a la observada en los ensayos de fase III con anti-PD-1. La eficacia clínica observada (con una respuesta objetiva del 65 %) fue superior a la de la monoterapia con nivolumab o pembrolizumab en los ensayos de fase III (con una respuesta objetiva del 42-45 %) y en los datos de la vida real (con una respuesta objetiva del 17,2-51,6 %). Sin embargo, la ausencia de un grupo de control y el reducido tamaño del estudio limitan la interpretación de estos resultados.
Contrariamente a los estudios anteriores [3, 4], los pacientes estaban recibiendo la primera línea de tratamiento; se realizó un único TMF por cápsula oral, los donantes eran personas sanas (en lugar de pacientes que habían respondido al tratamiento por ICI) y, por último, la preparación se realizó únicamente mediante GEP (sin antibióticos). Durante el análisis de la microbiota de donantes y receptores, los autores observaron que la de los pacientes que respondieron al tratamiento presentaba abundancia de Ruminococcus SGB15234 y SGB15229, Alistipes communis, Eubacterium ramuleus y Faecalibacterium SGB15346, mientras que la abundancia de Enterocloster aldensis y Enterocloster clostridioformis se reducía. El aumento de Faecalibacterium también se asociaba a la respuesta al IPC en los estudios anteriores [3, 4].
A continuación, los autores hicieron experimentos en ratones colonizados con microbiota humana y reprodujeron la eficacia del trasplante fecal de personas sanas en este contexto, con un efecto asociado a un aumento de la infiltración de linfocitos T CD8+ de memoria en el microentorno tumoral.
¿Cuáles son las consecuencias en la práctica?
A pesar de sus limitaciones, este estudio sugiere que la modulación de la microbiota mediante el TMF podría aumentar la eficacia de los IPC si se administra como tratamiento de primera línea para el melanoma metastásico. Aunque el uso a gran escala del TMF parece difícil de plantear en la práctica actual, la modulación de la microbiota, en concreto mediante probióticos de nueva generación, podría convertirse en un futuro en un tratamiento estándar en combinación con los IPC.
- La microbiota intestinal influye en la respuesta a los IPC
- El TMF procedente de donantes sanos es factible y seguro en pacientes tratados con IPC como tratamiento de primera línea para el melanoma metastásico
- A pesar de las limitaciones debidas a la falta de un grupo de control y al reducido tamaño del estudio, la eficacia clínica observada en los pacientes que recibieron un TMF en combinación con un IPC, fue superior a la de los IPC en monoterapia en los ensayos de fase III y en los datos de la vida real
CONCLUSIÓN
Este estudio demuestra que el TMF procedente de donantes sanos es factible y seguro en pacientes tratados con IPC como tratamiento de primera línea para el melanoma metastásico. Es posible que la modulación de la microbiota con el TMF o con otros métodos aumente la eficacia de los IPC, y se necesitan estudios específicos de mayor tamaño y controlados.
1. Routy B, Lenehan JG, Miller WH Jr, et al. Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase I trial. Nat Med 2023; 29: 2121-32.
2. Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97–103.
3. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602–9.
4. Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science 2021 ; 371 : 595–602.


