ОСЬ КИШЕЧНИК-ЛЕГКИЕ ПРИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЯХ
МИКРОБИОТА И COVID-19
Доктор Франсуа Троттен
Центр изучения инфекционных заболеваний и иммунитета в Лилле, Университет Лилля, Больница Лилля, Пастеровский институт в Лилле, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Новая инфекция (COVID-19), вызываемая коронавирусом (SARS-CoV-2) 19, напоминает нам о том, что взаимодействия между кишечной микробиотой и иммунной системой имеют важное значение при респираторных вирусных инфекциях. Респираторные вирусы могут вызывать симптомы со стороны желудочно-кишечного тракта, что подчеркивает роль системы легкиекишечник в заболевании. Клинические исследования и экспериментальные модели показывают, что острые респираторные вирусные инфекции изменяют состав и функции кишечной микробиоты, которая вносит важный вклад в поддержание здоровья человека. Мы рассмотрим эти основные изменения и обсудим возможные причины развития дисбиоза кишечника. Мы также рассмотрим влияние дисбиоза кишечника, развивающегося во время инфекции, на исходы заболевания. В конце мы обсудим интервенционные стратегии, которые можно использовать для воздействия на микробиоту кишечника, чтобы уменьшить тяжесть респираторного вирусного заболевания.
ЭПИДЕМИОЛОГИЯ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ
Респираторные вирусные инфекции попрежнему вызывают серьезную озабоченность во всем мире, поскольку являются серьезной социально-экономической и медицинской проблемой. Несмотря на кампании по вакцинации и арсенал противовирусных препаратов, грипп продолжает оставаться наиболее опасным с точки зрения числа инфицирований (5- 10% мирового населения) и смертей (>600 000 в год). Наряду с ежегодными эпидемиями, каждые 10-20 лет грипп также вызывает пандемии, самой известной из которых является «испанка» 1918-1919 гг (50 миллионов смертей), а самой последней – пандемия гриппа H1N1 в 2009 г (400 000 дополнительных смертей) [1]. Как мы видим на примере COVID-19, пандемии не ограничиваются гриппом [2]. Что больше всего настораживает – это учащение пандемий за последние несколько десятилетий. Это частично можно объяснить изменениями климата и деятельностью человека в целом.
КИШЕЧНАЯ МИКРОБИОТА В НОРМЕ И ПРИ ПАТОЛОГИИ
Микробиота кишечника играет важную роль в поддержании здоровья человека и имеет решающее значение в борьбе с (респираторными) инфекциями [3, 4]. Различные факторы могут изменить разнообразие и состав микробиоты кишечника, что ведет к дисбиозу. Среди них заболевания, такие как инфекции, хронические воспалительные процессы или нарушения обмена веществ могут вызвать глубокое изменение состава и функции кишечной микробиоты. Изменения кишечных бактериальных сообществ могут влиять на исход заболеваний даже в отдаленных органах (включая легкие) [3, 4], что подтверждено в экспериментах по переносу дисбиотической микробиоты. Ниже мы суммируем влияние острых респираторных вирусных инфекций на микробиоту кишечника
РЕСПИРАТОРНЫЕ ВИРУСНЫЕ ИНФЕКЦИИ, ПРИВОДЯЩИЕ К ДИСБИОЗУ КИШЕЧНИКА
Данные клинических наблюдений указывают на развитие дисбиоза кишечной микробиоты при гриппе. При этом у больных гриппом H1N1 уменьшается содержание обычно многочисленных Actinobacteria, Erysipelotrichea, Clostridia и полезных продуцентов бутирата (Lachnospiraceae и Ruminococcaceae). С другой стороны, повышается содержание условно-патогенных микроорганизмов, таких как Escherichia-Shigella и Prevotella [5]. В экспериментальных (мышиных) моделях преходящий дисбиоз кишечника также обычно развивается через 5-7 дней после заражения [6-9]. Изменения происходят на таксономическом уровне без изменения альфа-разнообразия. Инфекция подавляет рост полезных бактерий, таких как Lactobacilli, Bifidobacteria и сегментированные нитчатые бактерии. Также поражаются многие виды, способные ферментировать пищевые волокна в короткоцепочечные жирные кислоты (КЦЖК). Соответственно, при гриппе резко снижается продукция КЦЖК [9]. Подавление роста полезных комменсалов сочетается с чрезмерным ростом вредных бактерий, включая Gammaproteobacteria (Escherichia coli) и бактерии, разрушающие слизь, такие как Verrucomicrobia (Akkermansia) и Ruminococcus. Инфекция SARS-CoV-2 также вызывает изменения микробиоты кишечника у пациентов, в том числе уменьшение количества продуцентов бутирата, таких как Ruminococcaceae и Lachnospiraceae (Roseburia) [5, 10]. С другой стороны, у них отмечается увеличение относительной численности условно-патогенных бактерий, включая Streptococcus (класс Bacilli), Rothia и Actinomyces, и грибков (Aspergillus и Candida) [11]. В совокупности респираторные вирусные инфекции приводят к обеднению микробиоты полезными комменсалами и обогащению условно-патогенными микробами. Предполагают, что изменения в структуре, составе и функциональной активности кишечной микробиоты могут служить биомаркерами тяжести заболевания.
МЕХАНИЗМЫ РАЗВИТИЯ ДИСБИОЗА КИШЕЧНИКА
Вероятно, существует несколько причин развития дисбиоза кишечника при респираторных вирусных инфекциях, которые могут включать высвобождение воспалительных цитокинов и снижение потребления пищи (рис. 1). Заболевание вызывает значительную потерю массы тела из-за утраты аппетита. Эксперименты с парным кормлением мышей показывают, что быстрое снижение потребления пищи вызывает изменения микробиоты кишечника, почти идентичные наблюдаемым при гриппе [8]. Недавно установлена роль, которую играет TNFа при дисбиозе, связанном с отсутствием аппетита при вирусной инфекции [12]. Интерфероны I и II, необходимые для противовирусного ответа организма, также играют роль в развитии дисбиоза кишечника [5,6].
Гипоксия (один из симптомов острой респираторной вирусной инфекции), нарушение работы нервной системы кишечника и местного иммунитета также могут участвовать в развитии дисбиоза кишечника [13] (рис. 1). В случае COVID-19, наряду с этими механизмами, местная репликация вируса также, вероятно, играет роль в дисбактериозе кишечника. Ангиотензинпревращающий фермент II (АПФ2), являющийся рецептором SARSCoV-2, играет важную роль в поддержании микробной экологии кишечника. Можно ожидать, что отсутствие доступного АПФ2 во время инфекции SARS-CoV-2 способно повлиять на состав и функции микробиоты кишечника [13].
ВЛИЯНИЕ ДИСБИОЗА КИШЕЧНИКА НА ИСХОДЫ ЗАБОЛЕВАНИЯ
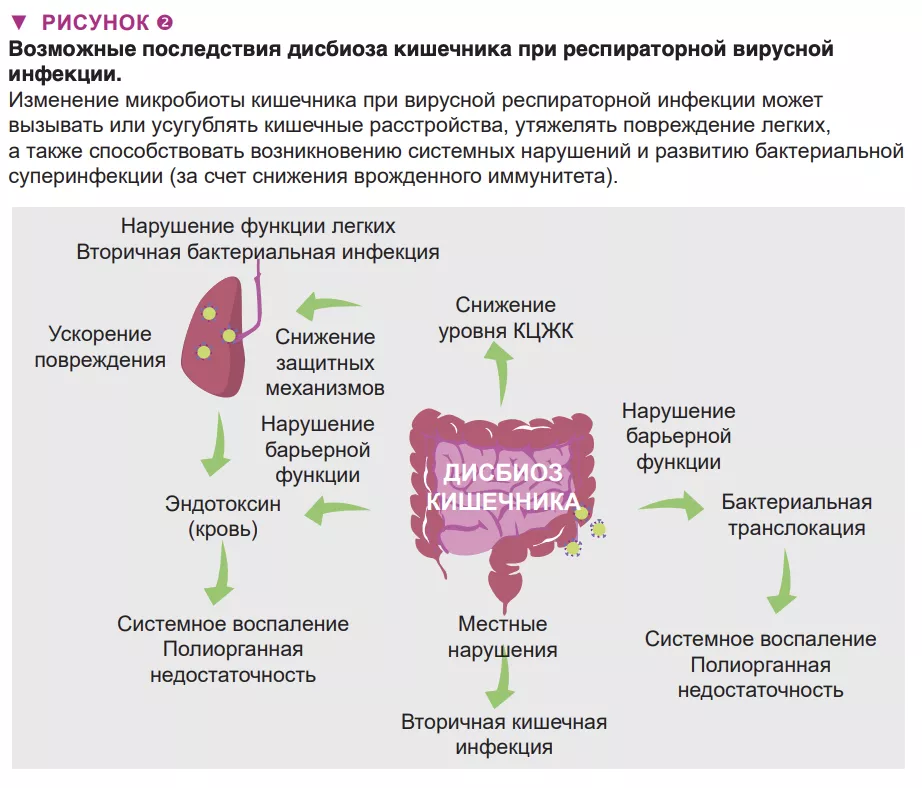
Дисбиоз кишечника при респираторной вирусной инфекции может иметь местные и отдаленные последствия, а также повлиять на тяжесть заболевания и способствовать летальному исходу (рис. 2). У пациентов с респираторной вирусной инфекцией могут развиться симптомы как при гастроэнтерите, такие как боль в животе, тошнота, рвота и диарея. Эти нарушения можно объяснить изменениями микробиоты кишечника. Также нельзя исключить, что эти изменения, включая появление патобионтов и бактерий, разрушающих слизь, играет роль в развитии воспаления в кишечнике и нарушении целостности кишечного барьера [6]. В свою очередь, последний фактор ведет к увеличению концентрации эндотоксинов в крови, что в конечном итоге вызывает воспаление, перепроизводство цитокинов и дисфункцию легких [14]. Острые вирусные респираторные инфекции могут привести к вторичным кишечным инфекциям и сепсису. Важную роль в этом играют дисбиоз кишечника (и снижение продукции КЦЖК). Действительно, КЦЖК играют ключевую роль в поддержании гомеостаза кишечника, целостности кишечной стенки и контроле кишечных патогенов [15]. Согласно последним данным, наряду с местными нарушениями дисбиоз кишечника может отдаленно влиять на защитные иммунные реакции в легких [9] (рис. 2). Микробиота кишечника здорового человека дистанционно защищает легкие от бактериальной инфекции, частично за счет усиления бактерицидной активности легочных макрофагов [16].
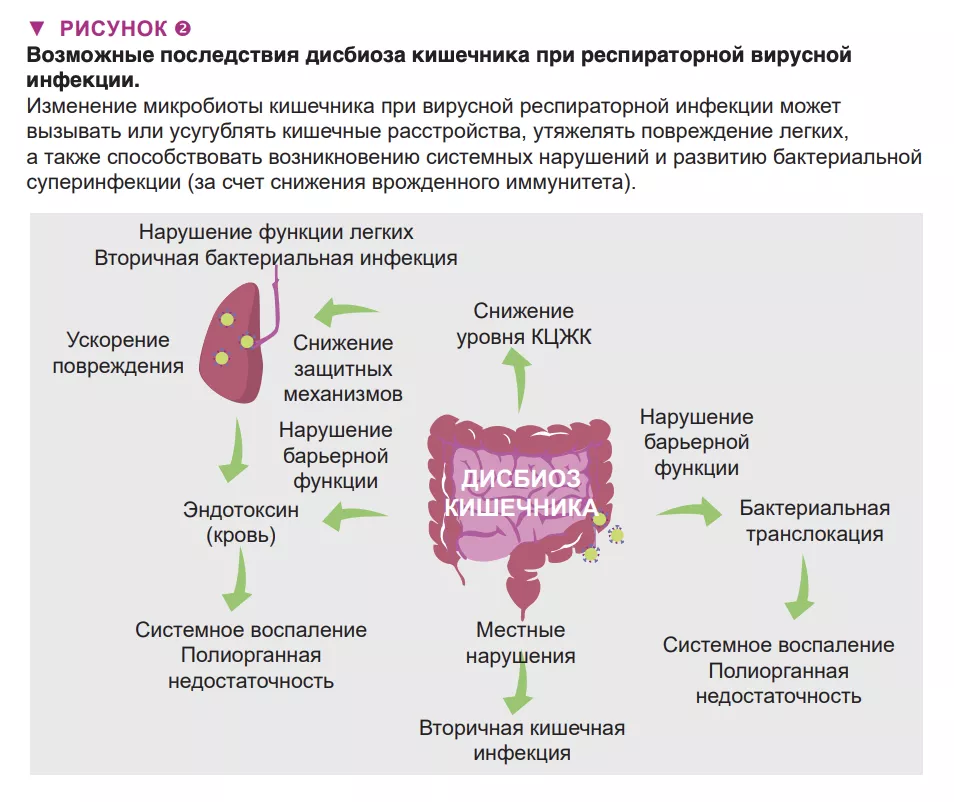
При гриппе функционирование этой оси нарушается и условно-патогенные бактерии проникают в легкие, вызывая бактериальную суперинфекцию, которая является основной причиной смерти во время эпидемий и пандемий гриппа [1]. Нам удалось показать, что снижение продукции ацетата (основы КЦЖК) кишечной микробиотой частично отвечает за этот эффект [9]. В целом дисбактериоз может влиять на желудочно-кишечные и легочные симптомы, а также общую смертность при вирусных респираторных инфекциях. Можем ли мы использовать ось «кишечник-легкие» в качестве основы для более эффективного контроля над тяжестью симптомов и смертностью от вирусных респираторных инфекций?
ВОЗМОЖНОСТИ ВМЕШАТЕЛЬСТВА
Микробиота кишечника жизненно важна для защиты легких от респираторных инфекций, поэтому разработка вмешательств, нацеленных на кишечных комменсалов, которые бы позволили заранее защитить легкие от вирусных патогенов, а микробиоту – от нарушений, связанных с вирусными инфекциями, представляет большой интерес (рис. 3). Это особенно важно для людей с общими нарушениями микробиоты кишечника, особенно пожилых и страдающих сопутствующей патологией, которые, как известно, более восприимчивы к инфекциям.
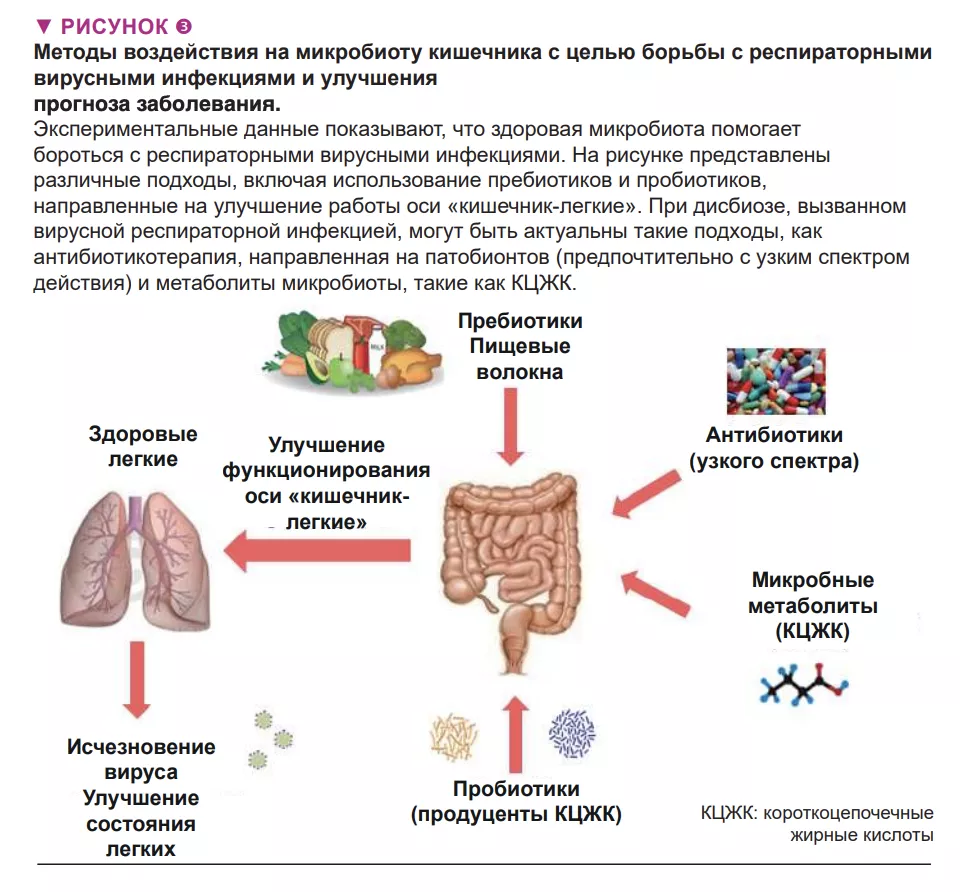
Представляют интерес такие подходы, как использование (i) компонентов диеты, предназначенных для питания наших полезных микроорганизмов (например, пребиотических волокон) и (ii) эндемичных бактерий (известных как пробиотики), восполняющих микрофлору нашего кишечника недостающими полезными представителями и, соответственно, их метаболическими функциями. Эти стратегии, особенно персонализированные (т.е. основанные на анализе микробиоты кишечника в группе риска), могут улучшить клинические исходы и ускорить выздоровление пациентов с острыми респираторными вирусными инфекциями. Пробиотики, в том числе Bifidobacteria и Lactobacillus spp, могут снизить степень тяжести гриппа с помощью еще не выясненных механизмов [17]. Согласно недавно полученным данным, пероральная бактериотерапия в дополнение к стандартной лекарственной терапии COVID-19 дала многообещающие результаты [18]
ВЫВОДЫ И ПЕРСПЕКТИВЫ
Функционирование оси «кишечник-легкие» имеет большое значение при респираторных вирусных инфекциях. Изменения кишечной микробиоты влияют на исходы заболевания. Воздействуя на кишечную микробиоту можно улучшить течение заболевания. Этого можно достичь с помощью компонентов диеты (например, пребиотических волокон) и пробиотиков.







