El eje intestino-pulmón en el marco de infecciones respiratorias de origen viral
Síntesis
Por el Dr François Trottein
Centro de Infección y de Inmunidad de Lille, Instituto Nacional de Salud e Investigación Médica (Inserm) U1019, CNRS UMR 9017, Universidad de Lille, Hospital Universitario de Lille, Instituto Pasteur de Lille, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
La nueva enfermedad del coronavirus 19 (SARS-CoV-2) (COVID-19) nos recuerda que las interacciones entre la microbiota intestinal y el sistema inmunitario son fundamentales durante las infecciones respiratorias víricas. Los virus respiratorios pueden desencadenar síntomas gastrointestinales, lo que pone de relieve la importancia del eje pulmón-intestino en la enfermedad. Estudios clínicos y modelos experimentales indican que las infecciones respiratorias víricas agudas alteran la composición y las funciones de la microbiota intestinal, un componente fundamental de la salud humana. En este artículo repasaremos estos importantes cambios y comentaremos las posibles causas de la disbiosis intestinal. Además, presentaremos las consecuencias de una disbiosis intestinal producida durante una infección sobre las consecuencias secundarias de la enfermedad. Por último, propondremos estrategias intervencionistas que podrían utilizarse para tratar la microbiota intestinal y reducir así la gravedad de la enfermedad respiratoria vírica.
La amenaza continue de las infecciones respiratorias víricas
viral siguen siendo una gran preocupación a escala mundial, dado que llevan aparejadas considerables consecuencias socioeconómicas y sanitarias. A pesar de las campañas de vacunación y de los medicamentos antivíricos, la gripe sigue siendo la más impactante, en términos de contagios (5-10 % de la población mundial) y muertes (> 600 000 al año). Además de las epidemias anuales, la gripe es la causante de pandemias cada 10-20 años, de las cuales la más famosa es la conocida como «gripe española», de 1918 a 1919 (con 50 millones de defunciones) y la más reciente, la pandemia de gripe H1N1 en 2009 (con una sobremortalidad de 400 000 defunciones) [1]. Las pandemias no se limitan a la gripe, como ha mostrado la COVID- 19 [2]. Es especialmente preocupante el aumento de la frecuencia de pandemias que se han producido en las últimas décadas, un fenómeno explicado en parte por los cambios climáticos y por la actividad humana, en general.
La microbiota intestinal en la salud y en las enfermedades
La microbiota intestinal desempeña una función clave en el mantenimiento de la salud humana y es decisiva para el control de las infecciones (respiratorias) [3, 4]. Existen muchos factores que pueden alterar la diversidad y la composición de la microbiota intestinal, y conducir a una disbiosis. Entre ellos, situaciones patológicas como infecciones, trastornos inflamatorios o metabólicos crónicos pueden desencadenar una alteración profunda de la composición y el funcionamiento de la microbiota intestinal. Las modificaciones en las comunidades bacterianas del intestino pueden influir en la evolución de la enfermedad, incluso en órganos alejados (por ejemplo los pulmones) [3, 4], como han demostrado los experimentos de transferencia de microbiota disbiótica. A continuación, resumimos los efectos de las infecciones respiratorias agudas de origen viral en la microbiota intestinal.
Las infecciones respiratorias víricas conducen a una disbiosis intestinal
Ciertos hallazgos clínicos parecen indicar que durante la infección por gripe se produce una disbiosis de la microbiota. La abundancia relativa de Actinobacteria, Erysipelotrichea, Clostridia y de productores benignos de butirato (familias Lachnospiraceae y Ruminococcaceae) se reduce en pacientes con H1N1. Por otro lado, se desarrollan patógenos oportunistas como Escherichia-Shigella y Prevotella [5]. En modelos experimentales (con ratones) también se produce una disbiosis intestinal transitoria, con un pico en los 5-7 días posteriores a la infección [6-9]. Los cambios se producen en los niveles taxonómicos, sin modificaciones en la diversidad alfa. La infección reduce el crecimiento de las bacterias que favorecen un buen estado de salud, como Lactobacilli, Bifidobacteria y bacterias filamentosas segmentadas. Numerosas especies capaces de transformar por fermentación fibras alimentarias en ácidos grasos de cadena corta (AGCC) se ven afectadas. Por ello, la producción de AGCC se desploma cuando hay infección por gripe [9]. Los bajos niveles de comensales benignos se asocian a la proliferación de bacterias nocivas como Gammaproteobacteria (Escherichia coli) y bacterias que dañan la mucosa como Verrucomicrobia (Akkermansia genus) y Ruminococcus. La infección por SARSCoV- 2 también produce alteraciones en la microbiota intestinal de los pacientes, por ejemplo, una menor abundancia de productores de butirato, como varios géneros bacterianos de las familias Ruminococcaceae y Lachnospiraceae (Roseburia) [5, 10]. Por otro lado, se ha observado una abundancia significativamente mayor de bacterias patógenas oportunistas como Streptococcus (clase Bacilli), Rothia y Actinomyces. Hay que señalar que, en pacientes con COVID-19, también se ha descrito una proliferación de patógenos micóticos oportunistas (géneros Aspergillus y Candida) [11]. En conjunto, las respiraciones infecciosas de origen viral conducen a una reducción de bacterias comensales benignas y al enriquecimiento de agentes patógenos nocivos oportunistas. Las posibles modificaciones en la estructura, la composición y la actividad funcional de la microbiota intestinal pueden ser biomarcadores de la gravedad de la enfermedad.
Mecanismos que conducen a una disbiosis intestinal
Es probable que existan varias causas que conduzcan a una disbiosis intestinal durante infecciones respiratorias víricas, como la liberación de citocinas inflamatorias y una reducción de la absorción de comida (Figura 1). La infección provoca una pérdida de peso sustancial debido a la falta de apetito. Experimentos consistentes en alimentar a ratones en pares indican claramente que un rápido descenso en la ingesta de alimento reproduce los cambios de la microbiota intestinal observados durante una gripe [8]. La evidencia reciente sugiere que el FNTa influye en la disbiosis asociada a la inapetencia durante una infección respiratoria vírica [12]. Los interferones de Tipo I y II, que son fundamentales para la respuesta antivírica del huésped, también desempeñan una función en la disbiosis intestinal [5,6].
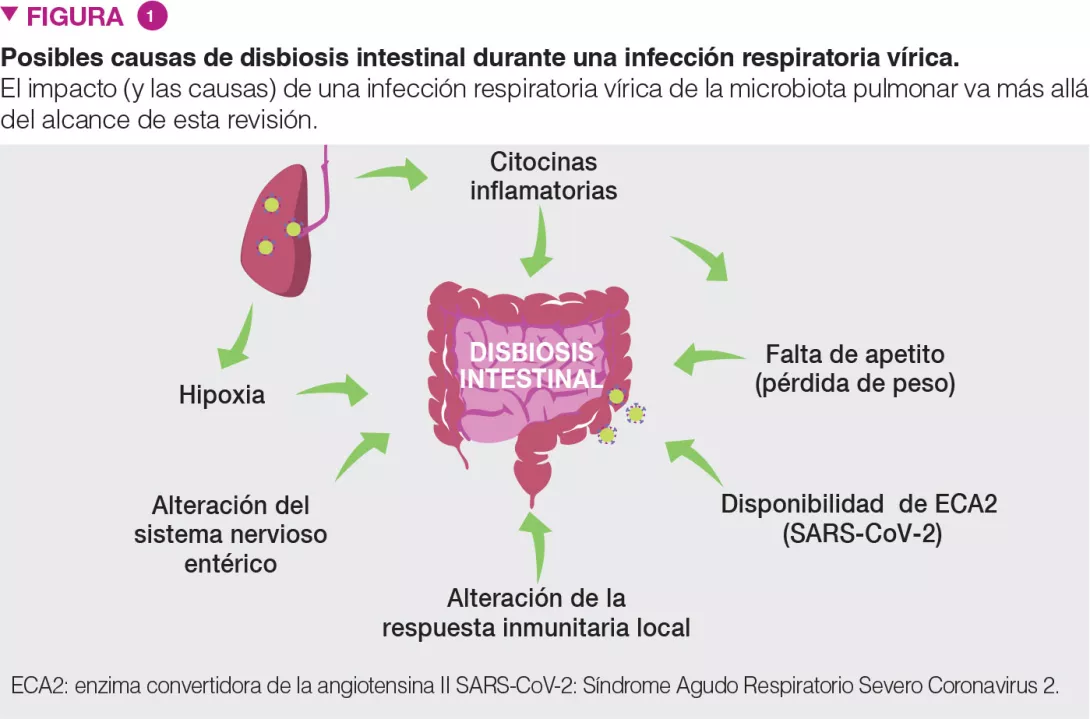
Además, es probable que, en la disbiosis intestinal, intervengan la hipoxia (un síntoma de infección respiratoria vírica aguda), las alteraciones en el sistema nervioso entérico y una respuesta inmunitaria local alterada [13] (Figura 1). En el caso de la COVID-19, además de estos mecanismos, es posible que la replicación viral local influya en la disbiosis intestinal. La enzima convertidora de angiotensina II (ECA2), el receptor del SARS-CoV-2, es determinante para mantener el ecosistema microbiano del intestino. Dada la falta de ACE2 disponible durante la infección por SARS-CoV-2, es de esperar que este factor influya en la composición y el funcionamiento de la microbiota intestinal [13].
Consecuencias de una disbiosis intestinal en complicacions secundarias
La disbiosis intestinal durante una infección respiratoria vírica tiene consecuencias locales y distales, y puede ser un factor clave que contribuya a la gravedad de la enfermedad y a una evolución mortal (Figura 2). Los pacientes con infección respiratoria de origen viral pueden presentar síntomas similares a los de la gastroenteritis, como dolor abdominal, náuseas, vómitos y diarrea. La alteración de la microbiota intestinal puede explicar estos trastornos. También es probable que la microbiota alterada, con la aparición de patobiontes y bacterias que dañan el moco intestinal, intervenga en la inflamación y la alteración de la integridad de la barrera del intestino [6]. A su vez, la permeabilidad de la barrera intestinal puede aumentar las concentraciones de endotoxinas en la sangre, provocando, en última instancia, inflamación, proliferación de citocinas y disfunciones pulmonares [14]. Las infecciones respiratorias de origen viral pueden desembocar en infecciones entéricas secundarias y septicemia. La disbiosis intestinal (y el descenso de AGCC) pueden ser importantes en este contexto. En efecto, los AGCC son decisivos en la homeostasis, la integridad de la barrera intestinal y el control de los patógenos entéricos [15]. Nuestros datos recientes muestran que, además de los trastornos locales, una disbiosis intestinal puede obstaculizar, a distancia, las defensas del huésped en los pulmones [9] (Figura 2). En buenas condiciones de salud, la microbiota intestinal defiende a los pulmones, de manera remota, contra infecciones bacterianas, en parte reforzando la actividad bactericida de los macrófagos pulmonares [16].
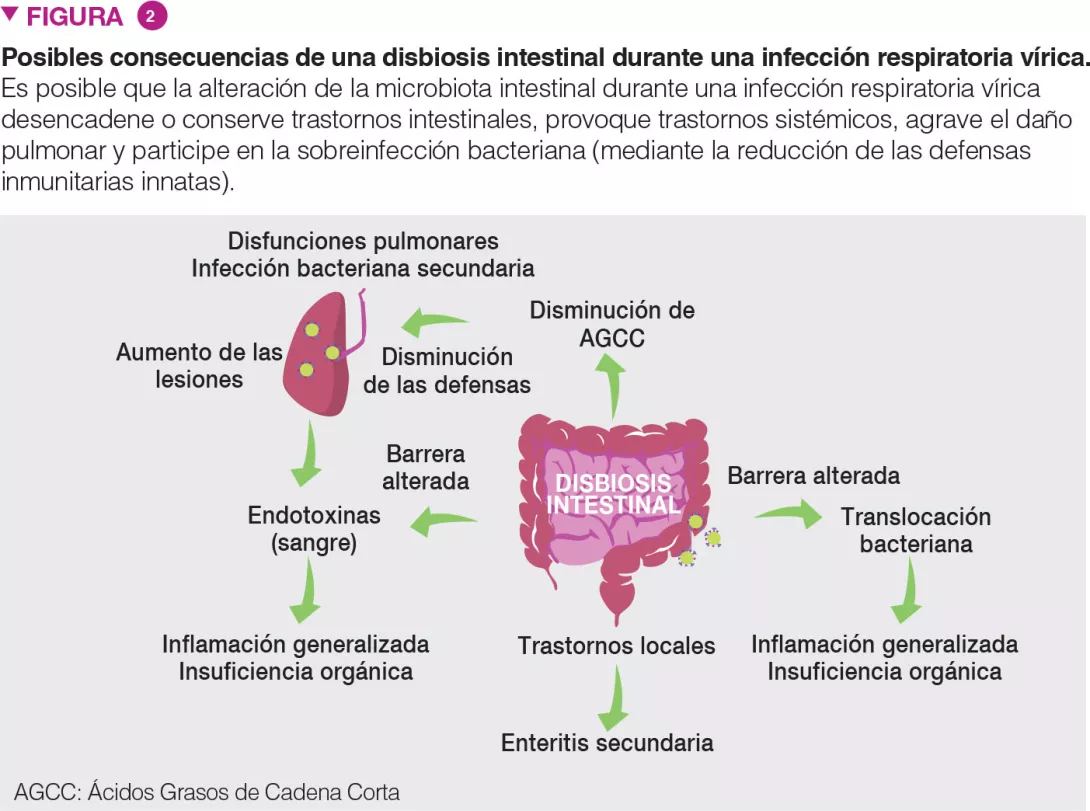
Durante una gripe, este eje se ve alterado y bacterias oportunistas invaden los pulmones, produciendo una sobreinfección bacteriana, que es una de las causas principales de muerte en las epidemias y pandemias de gripe [1]. Hemos mostrado que una menor producción de acetato (el AGCC principal) por la microbiota intestinal es parcialmente responsable de este efecto [9]. Conjuntamente, la disbiosis puede influir en las señales y síntomas gastrointestinales y pulmonares (así como en la mortalidad general) de las infecciones respiratorias víricas. ¿Podemos usar las vías intestino-pulmones como base para controlar mejor la gravedad y la tasa de mortalidad de las infecciones respiratorias víricas?
Perspectivas intervencionistas
La microbiota intestinal es vital para las defensas de los pulmones frente a la infecciones respiratorias, por lo que revisten un gran interés estrategias intervencionistas dirigidas a los comensales intestinales, para armar, de manera preventiva, a los pulmones frente a patógenos víricos y proteger a la microbiota de las perturbaciones asociadas con las infecciones víricas (Figure 3). Esto es particularmente importante en personas con un desequilibrio general de microbiota intestinal, como las personas mayores y pacientes con comorbilidades, quienes, como sabemos, están más expuestos a las infecciones.
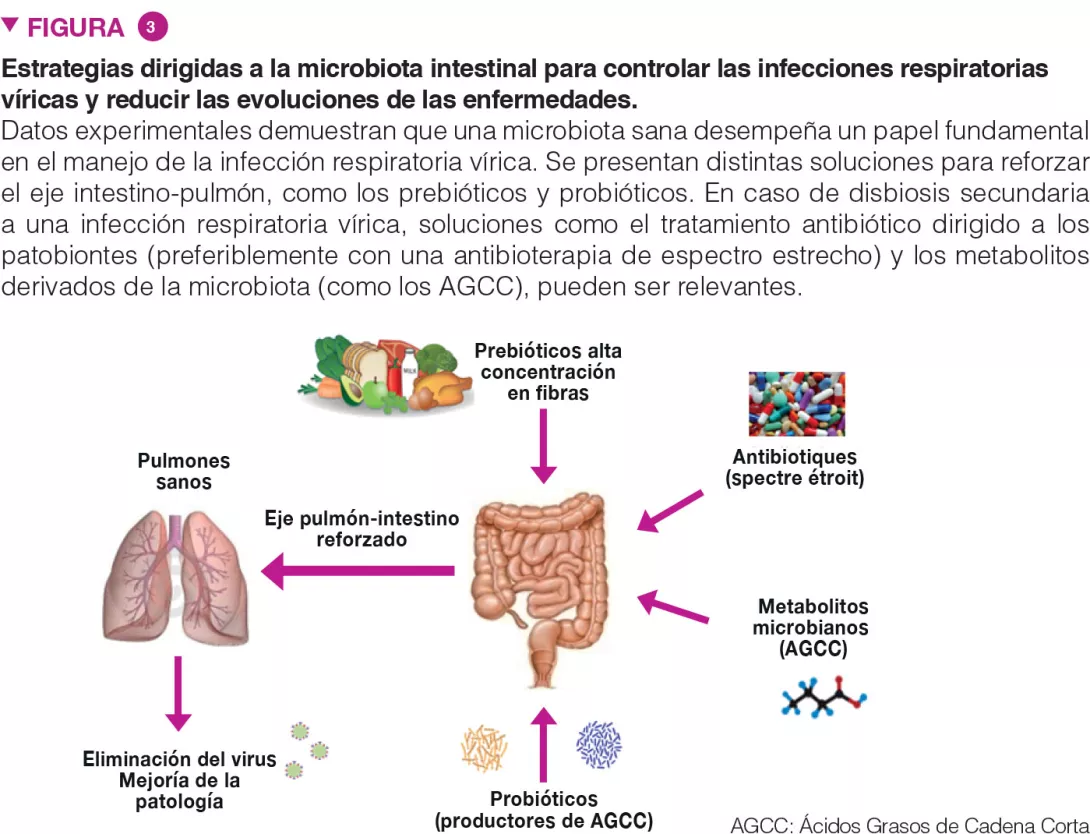
Pueden ser relevantes soluciones como (i) complementos alimenticios destinados a nutrir a nuestros microorganismos beneficiosos (como fibras prebióticas) y (ii) bacterias indígenas (conocidas como probióticos) para reponer los microorganismos benignos que le falten a nuestro intestino y optimizar sus funciones metabólicas. Estas estrategias, especialmente si se personalizan (es decir, según el análisis de la microbiota intestinal en la población «de riesgo»), pueden mejorar los parámetros clínicos y acelerar la recuperación de pacientes que padezcan infecciones respiratorias víricas agudas. Los probióticos, como algunas bifidobacterias y Lactobacillus spp, pueden reducir la gravedad de la gripe, mediante mecanismos aún desconocidos [17]. Un estudio reciente, de gran importancia en la actualidad, demostró que la bacterioterapia oral, junto con la terapia habitual con fármacos, arrojaba pistas prometedoras sobre el manejo de pacientes de COVID-19 [18].
Conclusión
El eje intestino-pulmón es importante durante las infecciones virales de las vías respiratorias. La alteración de la microbiota intestinal influye en complicaciones secundarias de esta enfermedad. Por ello, la microbiota intestinal representa un objetivo que puede limitar la gravedad de la enfermedad. Las soluciones para el abordaje de la enfermedad incluyen complementos alimenticios (como fibras prebióticas) y probióticos.