La microbiota intestinal y el metabolismo de los fármacos
Síntesis
Por la Pr. Emily P. Balskus
Departamento de Química y Biología Química, Universidad de Harvard, Cambridge, EE. UU.
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
La microbiota intestinal transforma las estructuras químicas de los compuestos ingeridos, como los fármacos de molécula pequeña administrados por vía oral. Este metabolismo, que puede variar sustancialmente entre pacientes, afecta a la eficacia del fármaco de forma positiva o negativa, y puede influir en su toxicidad. En los últimos 10 años, se ha reconocido cada vez más su posible efecto sobre la variabilidad interindividual en la respuesta a fármacos. A continuación repasaremos este tema, centrándonos en los últimos avances y en su posible impacto futuro sobre el manejo de los pacientes y el descubrimiento de medicamentos.
Los billones de microorganismos que pueblan el intestino humano poseen un número mucho mayor de genes que el genoma del propio huésped. Muchos de estos genes codifican a catalizadores de proteínas (enzimas), que permiten a la microbiota intestinal realizar un amplio abanico de reacciones químicas, ampliando la bioquímica asociada al cuerpo humano. Una característica principal del metabolismo microbiano intestinal es su variabilidad. Así, en una comunidad, tanto varía la composición de la microbiota como las capacidades metabólicas de cada individuo. Conforme identificamos nuevas asociaciones entre la microbiota intestinal y la salud, se hace más importante caracterizar las transformaciones metabólicas microbianas a nivel molecular.
Una de las actividades importantes asociadas a la microbiota intestinal es la capacidad de modificar químicamente las estructuras de los fármacos de molécula pequeña [1]. Los fármacos administrados por vía oral se topan con las bacterias intestinales antes de ser absorbidos en el intestino delgado, o bien en el intestino grueso si su biodisponibilidad por vía oral es baja. Los fármacos administrados por vía oral o inyectados, o sus metabolitos, también llegan a la microbiota si son excretados por la bilis en el intestino. Dado que la actividad farmacológica de un fármaco deriva directamente de su estructura química, el metabolismo microbiano puede tener una gran influencia en la acción del fármaco.
Efectos del metabolismo microbiano intestinal de los fármacos
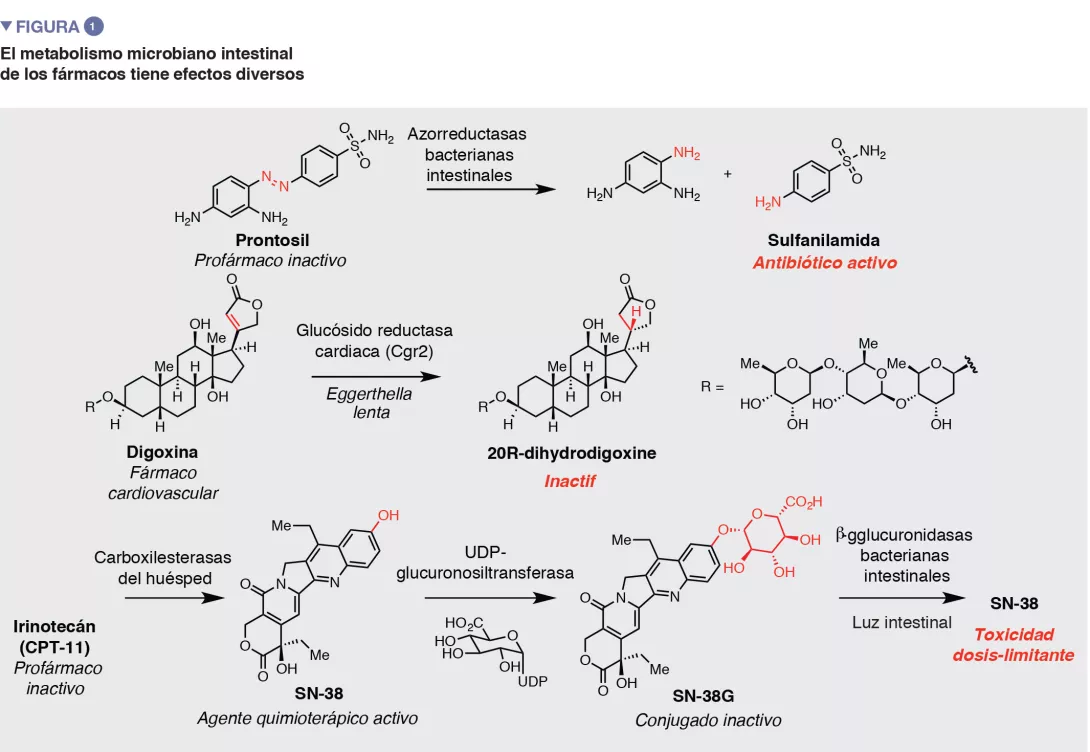
El metabolismo microbiano intestinal tiene distintas consecuencias sobre la acción y eficacia de los medicamentos (Figura 1). Como ilustran los ejemplos sobre fármacos azoicos, el metabolismo microbiano de los «profármacos» (precursores inactivos) puede ser necesario para generar el agente farmacológico activo. Este descubrimiento ha inspirado el diseño de nuevas estrategias para la liberación selectiva de fármacos en el intestino grueso, que dependen de las actividades metabólicas microbianas.
La metabolización que realiza la microbiota intestinal también puede afectar de forma negativa a la actividad de los fármacos, al alterar las interacciones con las dianas terapéuticas del huésped. Un ejemplo es la digoxina, un medicamento para tratar algunas enfermedades cardiacas, hecho a base de un producto natural. En el 5-10 % de los pacientes, la microbiota intestinal reduce el anillo de lactona a, b-insaturada de la digoxina para dar dihidrodigoxina. Esta sutil modificación, realizada por la bacteria intestinal Eggerthella lenta, reduce en gran medida la afinidad de unión con la diana de la digoxina (Na+/K+ ATPasa), lo que conlleva una pérdida de eficacia [2]. Otro buen ejemplo es el tratamiento de primera línea de Parkinson, la levodopa. La conversión de levodopa a dopamina por enzimas en el cerebro del huésped es fundamental para aliviar los síntomas. El metabolismo microbiano intestinal de la levodopa también produce dopamina [3, 4]. Dado que la dopamina generada en la periferia no puede atravesar la barrera hematoencefálica, este efecto podría reducir la cantidad de levodopa que llega al cerebro.
Por último, además de reducir la actividad, las modificaciones químicas creadas por microbios intestinales pueden producir toxicidad no deseada. Por ejemplo, el metabolismo microbiano intestinal ha sido implicado en la letalidad asociada a la administración concomitante del medicamento antivírico brivudina con antineoplásicos de fluoropirimidina. Este desenlace se atribuye a la metabolización microbiana intestinal de sorivudina a bromoviniluracilo. Este metabolito inhibe una enzima clave del huésped implicada en la inactivación del 5-fluorouracilo, lo que aumenta su concentración a niveles mortales.
Los estudios sobre el metabolismo microbiano intestinal de los fármacos comenzaron hace más de 80 años, con el descubrimiento de que uno de los primeros antibi ticos, el prontosil, un azocompuesto inactivo en cultivos bacterianos pero eficaz in vivo, sufré a una reducción por la microbiota intestinal para producir el agente activo sulfanilamida. Desde entonces,
se han descubierto otros ejemplos, a menudo al detectar una variabilidad en la eficacia o la toxicidad de un tratamiento. Sin embargo, a pesar de estos hallazgos, estas relaciones siguen sin tenerse en cuenta a la hora de desarrollar o administrar fármacos.
Una característica importante del metabolismo microbiano intestinal de los fármacos es su variabilidad entre pacientes. Este fenómeno se debe a la variabilidad de la microbiota intestinal. A pesar de que ciertas actividades metabólicas se encuentran en muchos organismos, otras están realizadas por un subconjunto pequeño y de escasa abundancia en la comunidad intestinal. El metabolismo puede variar entre cepas de la misma especie, e incluso entre bacterias estrechamente relacionadas puede haber grandes diferencias en los genomas. Por ese motivo, quizá no sea sorprendente que la composición de la comunidad intestinal suela ser un predictor pobre de su metabolismo, y que el metabolismo de algunos medicamentos sea rápido en ciertas personas e inexistente en otras. Es posible que esta variabilidad tenga consecuencias importantes, pero aún no la comprendemos totalmente en pacientes que toman varios medicamentos de molécula pequeña.
Comprender el metabolismo de los fármacos a nivel molecular
Para comprender completamente el metabolismo microbiano intestinal de los fármacos es necesario vincular las actividades individuales con los microbios, genes y enzimas. Suele ser necesario identificar a microbios específicos metabolizadores de fármacos que permitan realizar estudios farmacodinámicos posteriores. Esto puede lograrse examinando cepas disponibles de microbios intestinales, o bien aislando directamente organismos metabolizadores desde muestras de microbiota intestinal compleja. Luego, es necesario relacionar las transformaciones observadas con genes y enzimas. Esto es fundamental para estudiar el metabolismo en comunidades intestinales complejas, ya que los genes que codifican enzimas metabólicas permiten la detección y la predicción de actividades individuales en genomas microbianos y datos de secuenciación del microbioma. La vinculación del metabolismo de los medicamentos con los genes microbianos puede conseguirse de varias maneras, como el análisis racional de genomas para encontrar enzimas con las capacidades catalíticas necesarias, la secuenciación de ARN para identificar genes que aumentan específicamente en respuesta a un fármaco, y mediante la genómica comparativa, que permite asociar los genes con las capacidades metabólicas.
Identificación de nuevas actividades metabólicas
Hasta 2019, se comunicaron unos 60 ejemplos de metabolismo microbiano intestinal de fármacos. Dos estudios recientes utilizaron técnicas de cribado analítico masivo y de experimentación para realizar investigaciones a gran escala sobre el metabolismo microbiano intestinal de fármacos, lo que permitió ampliar el abanico de transformaciones conocidas. Goodman y colaboradores examinaron a 76 cepas bacterianas aisladas del intestino humano por su capacidad para metabolizar 271 medicamentos de molécula pequeña y descubrieron que dos tercios de estos fármacos habían sido modificados por al menos un organismo [8]. El grupo de Donia realizó un estudio análogo de 575 fármacos, utilizando una muestra del microbioma intestinal de un paciente ex vivo y halló 45 transformaciones nuevas [6]. Estos hallazgos sugieren que el número de fármacos susceptibles de ser metabolizados puede ser mayor de lo que se sabía hasta ahora; sin embargo, la gran mayoría de estas actividades recién descubiertas aún no se ha confirmado in vivo, por lo que sigue sin conocerse su relevancia para los pacientes.
Las reacciones químicas del metabolismo microbiano intestinal de los fármacos, que tienden a ser reductivas e hidrolíticas, suelen ser diferentes de las transformaciones del huésped, que implican una oxidación de los fármacos y una conjugación con metabolitos más polares para facilitar la excreción. El metabolismo microbiano suele tener efectos opuestos en la disponibilidad de los medicamentos, lo que prolonga su circulación en el cuerpo. Sin embargo, las transformaciones microbianas de los fármacos no tienen por qué ser diferentes para influir en la acción del fármaco. Estudios recientes sobre el fármaco antiviral brivudina sugieren que dichas actividades pueden influir en la farmacocin tica del fármaco incluso aunque sean identicas a las del metabolismo del huésped [5].
Manipulación del metabolismo microbiano intestinal de los fármacos
Una vez que se averigua que la microbiota intestinal transforma un medicamento de molécula pequeña, el siguiente paso lógico es investigar cómo se puede controlar esta actividad, tanto para evaluar las consecuencias del metabolismo sobre la acción del fármaco como para mejorar el tratamiento del paciente, si se observara que este metabolismo es perjudicial. Se han utilizado varios métodos para lograr este objetivo. Con modelos animales gnotobióticos (animales axénicos colonizados de forma controlada con una microbiota específica), se pueden comparar comunidades que contienen bien cepas intestinales metabolizadoras del fármaco o mutantes que carezcan de estas actividades específicas. En los estudios del laboratorio de Goodman sobre brivudina se ilustra muy bien la utilidad de este enfoque [5].
Sin embargo, la manipulación genética supone un desafío en comunidades microbianas complejas nativas, lo que nos conduce a evaluar enfoques alternativos. Una posible estrategia es aprovechar el conocimiento de la fisiología bacteriana del intestino para orientar la manipulación del entorno intestinal mediante intervenciones alimenticias. Por ejemplo, en el caso de la digoxina, Turnbaugh y sus colaboradores observaron que la presencia de la L-arginina disminuye el metabolismo del fármaco por E. lenta [2]. Después, demostraron que al administrar una alimentación rica en proteínas a ratones axénicos colonizados con E. lenta se reducía la inactivación del fármaco in vivo.
Otra estrategia interesante es identificar a moléculas pequeñas que inhiben la actividad de las enzimas bacterianas intestinales metabolizadoras de fármacos, como descubrió el laboratorio de Redinbo en sus estudios sobre el metabolismo del irinotecán. El irinotecán es un profármaco metabolizado por células del huésped en inhibidor activo de la topoisomerasa SN- 38. El huésped metaboliza la SN-38 por glucoronidación, y produce un conjugado inactivo (SN-38G). Este metabolito se excreta en el intestino, donde las enzimas b-glucoronidasa (GUS) bacterianas intestinales eliminan el glucurónido. Esta reactivación produce una toxicidad dosis-limitante en el tubo gastrointestinal. El grupo Redinbo utilizó el cribado analítico masivo para identificar a los inhibidores selectivos de enzimas GUS bacterianas intestinales, y descubrió que prevenían los graves efectos secundarios causados por el irinotecán en un modelo murino [9]. Trabajos posteriores revelaron que estos compuestos aumentaban la eficacia del irinotecán al limitar su toxicidad [10]. En conjunto, estos trabajos han proporcionado una prueba fascinante para abordar de forma terapéutica el metabolismo bacteriano intestinal y ha impulsado nuevas iniciativas para el descubrimiento de inhibidores.
Se calcula que el 70 % de la diversidad microbiana intestinal aún no se ha cultivado, lo que dificulta la caracterizaciòn de sus actividades. Donia y colaboradores
utilizaron metagen mica funcional, que consiste en introducir ADN aislado directamente de una microbiota compleja en un huésped heter logo, para identificar una enzima bacteriana intestinal que metaboliza la hidrocortisona [6]. Recientemente, también se han descubierto enzimas que metabolizan el colesterol en bacterias intestinales no cultivadas, correlacionando la presencia de genes microbianos en microbiomas con datos metabol micos. Ambas estrategias podrían ser útiles para investigar el metabolismo
de fármacos en microorganismos no cultivados.
Próximas fronteras
El desarrollo exitoso de inhibidores de GUS como candidatos terapéuticos demuestra que gracias a una comprensión molecular del metabolismo microbiano intestinal de los fármacos los pacientes podrían salir beneficiados. Otro ámbito que podría transformarse gracias a este conocimiento es la medicina de precisión. Si se comprende cómo los microbios intestinales metabolizan medicamentos específicos, es posible que los médicos puedan utilizar los datos de secuenciación del microbioma o pruebas diagnósticas a partir de la microbiota para decidir cuándo y cómo recetar determinados medicamentos.
Un mayor reconocimiento del valor del metabolismo microbiano intestinal de los medicamentos podría influir incluso en el propio proceso de descubrimiento de los medicamentos. Los farmacéuticos clínicos suelen evitar grupos funcionales que se sabe que son transformados por bacterias intestinales, debido a asociaciones previas con toxicidad y efectos secundarios. Cabe imaginar que se descubrirán transformaciones nuevas e imprevistas en las primeras etapas del desarrollo de un fármaco estudiando los microbios intestinales individuales o las comunidades complejas pacientes para averiguar el metabolismo ex vivo, del mismo modo en que se suele probar el metabolismo de los fármacos candidatos por las enzimas del huésped. Las diferencias en la composición y las funciones de la microbiota intestinal entre modelos animales y humanos deberían tenerse en cuenta en estudios clínicos y preclínicos. Por último, sería recomendable incorporar a los ensayos clínicos la recogida y análisis de muestras de microbioma para evaluar el metabolismo de los fármacos. Es posible que correlacionar el metabolismo con las diferencias de toxicidad y eficacia ayude a interpretar los resultados de dichos ensayos y a definir las poblaciones de pacientes destinatarios.
Conclusión
En resumen, en la última década hemos vivido grandes avances en nuestra comprensión de los mecanismos moleculares subyacentes al metabolismo microbiano intestinal de los fármacos y sus consecuencias sobre la eficacia de estos. Es necesario realizar más estudios para explorar este campo de investigación apasionante y hacer avanzar la medicina de precisión y el descubrimiento de fármacos.