МИКРОБИОТА КИШЕЧНИКА И МЕТАБОЛИЗМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
ОБЗОРНАЯ СТАТЬЯ
Профессор Эмили П. Бальскус
Кафедра химии и биохимии, Гарвардский университет, Кембридж, США
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Микробиота кишечника превращает одни химические соединения, поступающие с пищей, включая пероральные низкомолекулярные препараты, в другие. Этот метаболизм, который может существенно различаться у разных пациентов, влияет на эффективность препаратов как в положительном, так и отрицательном отношении, а также может влиять на токсичность. Последние 10 лет растет понимание того, что кишечная микробиота способна влиять на метаболизм лекарственных препаратов, в какой-то мере определяя межиндивидуальную вариабельность реакций на них. Мы рассмотрим эту тему, уделяя особое внимание недавним открытиям и их потенциальному влиянию на лечение пациентов и создание лекарств в будущем.
Триллионы микроорганизмов, населяющих кишечник человека, несут в себе набор генов, в количественном отношении значительно превосходящий геном хозяина. Многие из этих генов кодируют белковые катализаторы или ферменты, которые позволяют кишечным микробам осуществлять широкий спектр химических реакций, расширяя метаболические возможности человеческого организма. Отличительной чертой кишечного микробного метаболизма является его изменчивость. Так же, как состав микробиоты варьирует от человека к человеку, отличны и ее метаболические возможности. По мере того, как мы продолжаем открывать связи между микробиотой кишечника, состоянием здоровья и исходами болезней, становится все более важным охарактеризовать микробный метаболизм на молекулярном уровне.
Одним из важных свойств микробиоты кишечника является ее способность химически модифицировать структуру низкомолекулярных препаратов [1]. Те препараты, которые принимаются внутрь, сталкиваются с кишечными микробами либо до всасывания в тонкой кишке, либо, если имеют плохую биодоступность, в толстой кишке. Перорально или парентерально вводимые препараты или их метаболиты также достигают микробиоты при выведении с желчью в кишечник. Поскольку фармакологическая активность лекарств напрямую связана с их химической структурой, микробный метаболизм может оказывать на нее большое влияние.
ВЛИЯНИЕ КИШЕЧНЫХ МИКРООРГАНИЗМОВ НА МЕТАБОЛИЗМ ПРЕПАРАТОВ
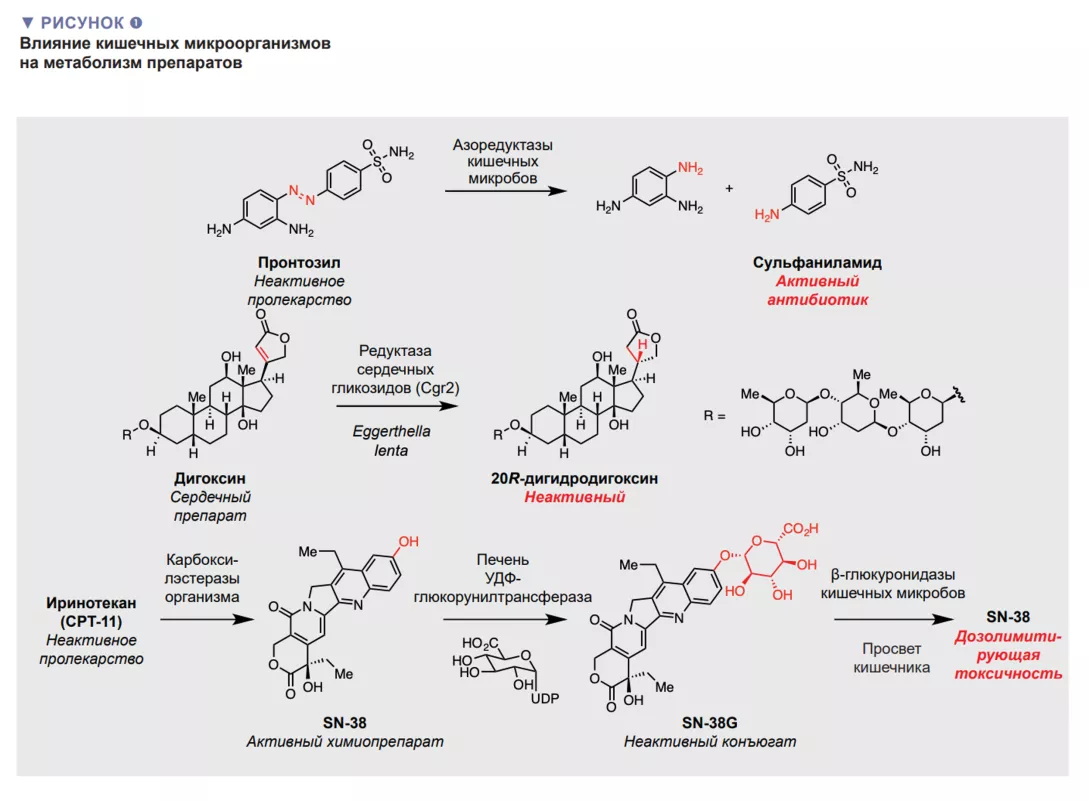
Превращения лекарственных препаратов под действием микробов кишечника могут сильно влиять на эффективность (рис. 1). Препараты содержащие азогруппу представляют собой пример, когда для получения активного фармакологического соединения может потребоваться микробный метаболизм «пролекарств» (неактивных предшественников). Эти знания позволили разработать препараты, высвобождающиеся в толстой кишке в ходе метаболической активности микроорганизмов. Метаболизм, опосредованный микробиотой кишечника, также может негативно влиять на активность лекарств, нарушая их взаимодействие с мишенями. Одним из примеров является препарат натурального происхождения дигоксин, применяемый для лечения сердечных заболеваний. У 5-10% пациентов микробиота кишечника восстанавливает а,b-ненасыщенное лактоновое кольцо дигоксина с образованием дигидродигоксина. Эта незначительная модификация, которую выполняет кишечная бактерия Eggerthella lenta, значительно снижает прочность связывания дигоксина с его мишенью — Na+/K+-АТФ-азой, что ведет к потере эффективности [2]. Другой яркий пример — терапия первой линии болезни Паркинсона с помощью L-допа. Превращение L-допа в дофамин под действием ферментов в головном мозге имеет решающее значение для облегчения симптомов. В ходе микробного метаболизма L-допа в кишечнике также образуется дофамин [3,4]. Поскольку дофамин, образующийся на периферии, не может преодолеть гематоэнцефалический барьер, эта может снизить количество L-допа, попадающее в головной мозг.
Наконец, помимо снижения активности, химические модификации препаратов под действием кишечных микробов могут вызывать нежелательную токсичность. Например, микробный метаболизм в кишечнике обуславливает летальность при совместном применении противовирусного препарата соривудина с фторпиримидиновыми химиотерапевтическими средствами. Этот результат связан с микробным метаболизмом соривудина в кишечнике с образованием бромовинилурацила. Этот метаболит ингибирует ключевой фермент организма, участвующий в детоксикации 5-фторурацила, что повышает его концентрацию до летального уровня.
Исследования метаболизма препаратов под действием микробов кишечника начались более 80 лет назад с открытия, что один из первых антибиотиков, пронтозил, представляющий собой азосоединение, неактивное по отношению к бактериальным изолятам, но проявляющее бактерицидные свойства in vivo, подвергается восстановлению микробиотой кишечника с образованием активного соединения — сульфаниламида. За последующие годы были описаны другие примеры метаболизма соединений, опосредованного кишечными микробами, часто изменяющего эффективность или токсичность для пациентов. Что важно, несмотря на эти сведения, возможность метаболизма под действием микробов кишечника, как правило, не рассматривается при разработке или введении лекарственных препаратов.
Важной характеристикой метаболизма кишечных микробов является его вариабельность у разных пациентов, что связано с изменчивостью микробиоты кишечника. Хотя некоторые виды метаболической активности обнаруживаются у многих организмов, другие осуществляются небольшой, малочисленной группой кишечного сообщества. Метаболизм может варьироваться между отдельными штаммами одного и того же вида, поскольку даже близкородственные бактерии могут иметь большие различия в геномах. Поэтому неудивительно, что состав микробного сообщества часто является плохим показателем метаболизма, а спектр метаболических превращений отдельных препаратов может быть обширным у одних и отсутствовать у других. Эти различия, вероятно, имеют важные, но не совсем понятные последствия для пациентов, получающих различные низкомолекулярные препараты.
ПОНИМАНИЕ МЕТАБОЛИЗМА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ НА МОЛЕКУЛЯРНОМ УРОВНЕ
Чтобы полностью понять метаболизм лекарственных препаратов под действием микроорганизмов в кишечнике, необходимо связать отдельные реакции с конкретными микробами, генами и ферментами. Выявление конкретных микробов, метаболизирующих лекарственные препараты, как правило, необходимо для проведения последующих исследований механизмов их действия. Этого можно достичь путем скрининга микробных изолятов кишечника или выделения метаболизирующих организмов непосредственно из сложных образцов микробиоты кишечника. Следующим важным шагом является соотнесение конкретных метаболических реакций с генами и ферментами. Это имеет решающее значение для изучения метаболизма в сложных кишечных сообществах, поскольку гены, кодирующие метаболические ферменты, позволяют обнаруживать и прогнозировать индивидуальные особенности метаболизма препаратов, изучая микробные геномы и данные секвенирования микробиома. Связывание метаболических реакций с микробными генами может быть выполнено несколькими способами, включая рациональный поиск ферментов с необходимыми каталитическими свойствами в геномах, использование секвенирования РНК для идентификации генов, которые специфически активируются при наличии в среде препарата, а также использование сравнительной геномики для связывания генов с метаболическими реакциями.
ВЫЯВЛЕНИЕ НОВЫХ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
До 2019 г. было известно около 60 примеров микробного метаболизма лекарственных препаратов в кишечнике. В двух недавних исследованиях с помощью методов высокопроизводительного скрининга и других экспериментальных техник был проведен крупномасштабный анализ метаболических реакций, осуществляемых кишечными микроорганизмами, что значительно расширило наши знания в этой сфере. Goodman и соавт. проанализировали 76 изолятов бактерий, обитающих в кишечнике человека, на способность метаболизировать 271 низкомолекулярный лекарственный препарат и обнаружили, что 2/3 препаратов метаболизирировались как минимум одним микроорганизмом [8]. Другая группа провела аналогичный анализ 575 препаратов с использованием образца микробиома кишечника пациента ex vivo и обнаружила 45 новых реакций [6]. Полученные данные позволяют предположить, что количество лекарств, метаболизирующихся таким образом, может быть еще больше. Однако подавляющее большинство этих недавно описанных реакций еще не удалось наблюдать in vivo, поэтому их реальное клиническое значение неизвестно.
Химические превращения препаратов под действием кишечных микробов часто опосредованы реакциями восстановления и гидролиза, тогда как в организме человека это окисление и конъюгация с более полярными соединениями для облегчения выведения. Микробный метаболизм часто оказывает противоположное влияние на доступность лекарств, продлевая период их циркуляции в организме. Однако превращения лекарств под действием микробов не обязательно должны отличаться от таковых в организме человека, чтобы влиять на их действие. Недавние исследования противовирусного препарата бривудина показывают, что метаболические превращения под действием микроорганизмов могут влиять на фармакокинетику препаратов, даже если они полностью соответствуют превращениям препарата в организме человека [5]
СПОСОБЫ ВОЗДЕЙСТВИЯ НА КИШЕЧНЫЕ МИКРООРГАНИЗМЫ, МЕТАБОЛИЗИРУЮЩИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
После обнаружения способности микробиоты кишечника метаболизировать низкомолекулярные лекарственные препараты, естественно, возник вопрос, как можно контролировать эту активность, что важно для оценки влияния такого метаболизма на эффективность препаратов и коррекции лечения в необходимых случаях. Для достижения этой цели используются различные методы. С помощью модели гнотобиотических животных (стерильные животные, кишечник которых колонизируется определенной микробиотой по выбору исследователя) можно сравнить сообщества, содержащие в кишечнике штаммы микроорганизмов, метаболизирующие лекарственные препараты, или их мутантные формы, не обладающие соответствующей метаболизирующей активностью. Полезность такого подхода была хорошо проиллюстрирована исследованиями бривудина в лаборатории Goodman (Goodman lab) [5].
Однако генетические манипуляции in vivo являются сложной задачей и часто требуют альтернативных подходов. Одна из возможных стратегий — использовать знания о физиологии кишечных бактерий для управления микробиотой с помощью диеты. Например, было отмечено, что присутствие L-аргинина уменьшает метаболизм дигоксина за счет деятельности E. lenta [2]. Далее авторы показали, что скармливание богатого белками рациона мышам-гнотобиотам, колонизированным E. lenta, ведет к снижению интенсивности процессов инактивации лекарственных препаратов in vivo.
Еще одна интересная стратегия — поиск низкомолекулярных соединений, подавляющих активность ферментов кишечных микробов, метаболизирующих лекарственные препараты, как это было впервые сделано в лаборатории Рединбо при изучении метаболизма иринотекана. Иринотекан — пролекарство, которое метаболизируется в клетках организма до активного ингибитора топоизомеразы SN-38. SN-38 метаболизируется в клетках организма посредством глюкуронизации, в результате чего образуется неактивный конъюгат (SN-38G), который выводится в кишечник, где глюкуроновая группа удаляется β-глюкоронидазой (GUS) кишечных бактерий. Эта реактивация оказывает дозолимитирующее токсическое действие на желудочно-кишечный тракт. Группа Redinbo использовала методы высокопроизводительного скрининга на мышиной модели для выявления селективных ингибиторов GUS кишечных бактерий и обнаружила, что они предотвращают тяжелые побочные эффекты иринотекана [9]. Последующая работа показала, что эти соединения увеличивают эффективность и ограничивают токсичность иринотекана [10]. В целом эти данные представляют собой убедительное доказательство правильности концепции терапевтического воздействия на метаболизм кишечных бактерий и открывают широкие возможности поиска новых ингибиторов.
По оценкам, 70% кишечных микробов не культивируются, поэтому их деятельность сложно охарактеризовать. Группа ученых с помощью методов функциональной метагеномики, позволяющих вводить ДНК, выделенную непосредственно из сложной микробиоты, в гетерологичный организм, выделила бактериальный фермент кишечника, метаболизирующий гидрокортизон [6]. Ферменты, метаболизирующие холестерин, были недавно обнаружены в некультивируемых кишечных бактериях путем сопоставления присутствия микробных генов в микробиомах с данными метаболомики [7]. Обе стратегии могут быть полезны при исследовании метаболизма лекарственных препаратов некультивируемыми микроорганизмами.
ПЛАНЫ НА БУДУЩЕЕ
Успехи в разработке ингибиторов GUS в качестве потенциальных лекарственных препаратов явно говорят о том, что понимание метаболизма кишечных микроорганизмов на молекулярном уровне в итоге может принести пользу пациентам. Еще одна область, которую можно изменить с помощью этих знаний, — это прецизионная медицина. Понимая, как определенные препараты метаболизируются кишечными микробами, врачи рано или поздно смогут использовать данные секвенирования микробиома или результаты диагностического анализа микробиоты для принятия решения о том, следует ли назначать пациенту определенные препараты и каким образом это делать.
Растущее понимание кишечного микробного метаболизма лекарственных препаратов также может повлиять на сам процесс создания лекарств. Зная о связи некоторых функциональных групп, которые, как известно, метаболизируются кишечными бактериями, с токсичностью и побочными эффектами, медицинские химики обычно избегают их включения в состав препаратов. Можно представить себе выявление новых, непредвиденных метаболических превращений на ранних стадиях разработки препаратов с помощью отдельных кишечных микробов или их сложных сообществ в анализах ex vivo, аналогично тому, как потенциальные препараты обычно изучают с помощью ферментов человека. Различия в составе и функциях кишечной микробиоты у животных и человека следует учитывать в доклинических и клинических исследованиях. Наконец, может быть целесообразно включить сбор образцов микробиома и анализ метаболизма лекарственных препаратов в клинические исследования. Анализ связи между особенностями метаболизма и различиями в токсичности или эффективности может помочь в интерпретации результатов таких исследований и определении целевых групп пациентов.
ЗАКЛЮЧЕНИЕ
Таким образом, за последнее десятилетие мы стали свидетелями большого прорыва в понимании молекулярных механизмов, лежащих в основе метаболизма кишечных микроорганизмов и его влияния на эффективность лекарственных препаратов. Дальнейшая работа в этой захватывающей области будет способствовать развитию прецизионной медицины и открытию новых лекарств.








