El metabolismo del colesterol por parte de bacterias intestinales humanas no cultivadas influye en el nivel de colesterol del huésped
Artículo comentado - Adulto
Por el Pr Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
Comentario del artículo original de Kenny et al. (Cell Host & Microbe 2020 [1])
El microbioma humano posee una gran capacidad metabólica, pero nuestra comprensión de los mecanismos que vinculan las bacterias intestinales con el metabolismo humano sigue siendo limitada. En el artículo, los autores se centran en la conversión por parte de la microbiota intestinal del colesterol en coprostanol, un esterol que se absorbe mal, para desarrollar un marco para la identificación de las enzimas funcionales y de las bacterias. Mediante la integración de datos aparejados de metagenómica y de metabolómica provenientes de cohortes existentes con conocimientos y experimentos bioquímicos, los autores proponen predecir y validar la existencia de un grupo de deshidrogenasas bacterianas del colesterol que contribuye a la formación del coprostanol. Estas enzimas se codifican por los genes ismA en un grupo de bacterias no cultiva das, comunes en cohortes humanas geográficamente diversas. Los individuos que albergan las bacterias intestinales que contribuyen a la formación del coprostanol tienen índices de colesterol fecal significativamente más bajos y un co lesterol total sérico inferior con efectos comparables a los que se atribuyen a las variaciones de los genes de la homeostasis lipídica. Por ello, es posible que el metabolismo del colesterol por parte de estas bacterias desempeñe una función importante en la reducción de las concentraciones intestinales y séricas de colesterol, con un impacto directo en la salud humana
¿Qué se sabe ya sobre este tema?
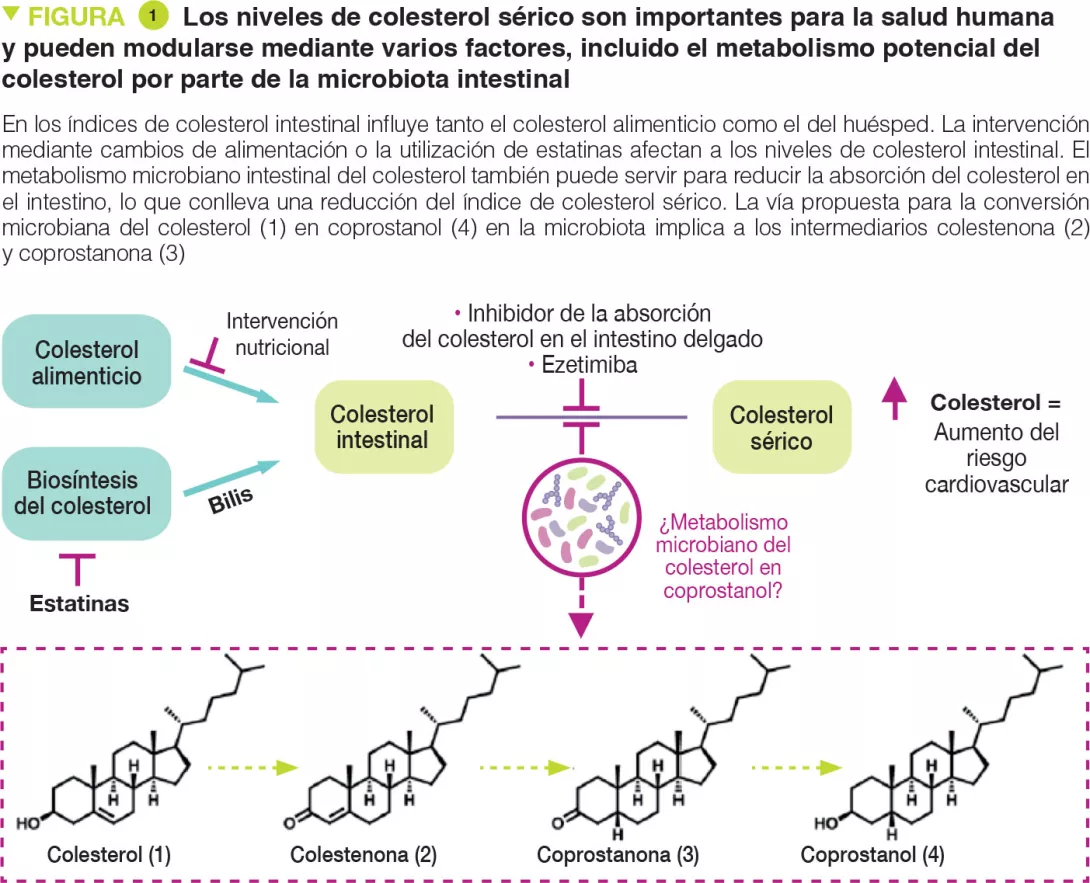
On El colesterol es una molécula biológica clave que funciona como un componente estructural de todas las membranas celulares animales y es un precursor de las hormonas esteroides, de la vitamina D y de los ácidos biliares. Dos fuentes principales de colesterol influyen en su concentración en el suero: el colesterol endógeno sintetizado en el hígado y el colesterol exógeno derivado de componentes alimenticios de origen animal (Figura 1). El colesterol sintetizado en los hepatocitos se transporta hacia la vesícula biliar y después se secreta en el intestino delgado con otras sales biliares. En el intestino, el colesterol biliar (~ 1-2 g/día) se mezcla con el colesterol alimenticio (~ 0,2-0,4 g/día en la alimentación americana media) y, finalmente, ambas son transportadas en los enterocitos para ser acondicionadas en partículas de lipoproteínas y secretadas en el plasma. La hipercolesterolemia es un factor de riesgo de las enfermedades cardiovasculares (ECV), causantes de un cuarto de todos los fallecimientos en los países industrializados.
La reducción del transporte del colesterol en el intestino es una estrategia clínicamente aprobada para reducir el índice de colesterol sérico. Una serie de bacterias intestinales metabolizan y modifican las moléculas alimenticias derivadas del huésped en el intestino delgado. Como ambas fuentes de colesterol atraviesan este entorno, es posible que la microbiota intestinal influya en los índices de colesterol sérico. De hecho, la transferencia de microbiota de donantes humanos con índices de colesterol sérico elevados es capaz de transmitir este fenotipo hipercolesterolémico a ratones [2, 3]. Otros estudios indican que la administración de especies bacterianas particulares puede tener efectos hipocolesterolemiantes [4]. Sin embargo, en la actualidad se desconocen los mecanismos precisos en que se fundamentan estas observaciones. Es posible que la microbiota intestinal ejerza efectos hipocolesterolemiantes metabolizando el colesterol intestinal en coprostanol (Figura 1), lo que reduciría la cantidad de colesterol absorbida por el intestino.
Desde principios de 1900, se sabe que esta transformación, que depende de la microbiota, se produce en los humanos. Se ha informado de la existencia de varias bacterias intestinales que generan coprostanol con características físicas y bioquímicas similares, a partir de varias fuentes, en concreto ratas, babuinos y humanos. Sin embargo, la mayoría de las cepas no está disponible actualmente y nunca se ha secuenciado. Los primeros trabajos han mostrado que la formación de coprostanol por este grupo de bacterias intestinales pasa por una vía de reducción indirecta que implica la oxidación inicial del colesterol (1) en colestenona (2), seguida de una reducción del doble enlace D4,5 para formar la coprostanona (3), y de la rerreducción posterior de la cetona para generar coprostanol (4) (Figura 1). Las enzimas bacterianas responsables de este metabolismo aún no se han identificado. Más recientemente, otros informes han implicado a otras bacterias intestinales filogenéticamente diversas en la formación del coprostanol [5]. A pesar de que los esfuerzos que han intentado elucidar cómo afecta el metabolismo microbiano intestinal del colesterol a los índices de colesterol sérico se remontan a más de 100 años, los elementos mecanísticos siguen siendo desconocidos a causa de una comprensión limitada de las bacterias intestinales, genes y enzimas responsables de la formación del coprostanol.
Puntos claves
-
Ciertas bacterias de la microbiota intestinal humana poseen enzimas, de la familia ismA, capaces de degradar el colesterol.
-
La presencia de especies ismA + en la microbiota intestinal se asocia a una disminución del colesterol fecal y sérico en el ser humano.
-
El efecto de las especies ismA + en el colesterol sérico es comparable al de la genética humana.
¿Cuáles son los principales resultados aportados por este estudio?
Los autores han utilizado una estrategia multidisciplinar para descubrir las enzimas bacterianas intestinales. Esta estrategia, basada en correlaciones entre datos de metagenómica y de metabolómica provenientes de cohortes humanas existentes, ha permitido identificar y caracterizar una extensa familia de enzimas deshidrogenasa del colesterol a partir de un grupo de bacterias intestinales no cultivadas que intervienen en el metabolismo del colesterol en coprostanol. En primer lugar, la enzima responsable de la primera etapa de degradación del colesterol, denominada ismA, se identificó en Eubacterium coprostanoligenes, una bacteria que ya se conocía por esta función. El análisis de los datos de secuenciación de cohortes humanas permitió identificar, a continuación, enzimas homólogas en un grupo de bacterias anaerobias no cultivadas.
La presencia de estos genes ismA en el microbioma estaba asociada a la presencia de coprostanol en las heces y a una reducción de los índices de colesterol fecal. Por último, para demostrar el potencial de estas bacterias de influir en la salud humana, los autores han demostrado que la presencia de genes ismA en los metagenomas humanos está asociada a una disminución de las concentraciones de colesterol total en el plasma, comparable a los efectos observados a partir de variantes de genes humanos implicados en la homeostasia lipídica.
¿Cuáles son las consecuencias en la práctica?
En conjunto, estos resultados confirman la función del metabolismo bacteriano intestinal en la modulación de los niveles de colesterol del anfitrión en el intestino, pero, lo que es más importante, también a nivel sistémico. Estos trabajos abren la vía a la utilización de la microbiota intestinal como biomarcador predictivo del riesgo de hipercolesterolemia y sientan las bases de intervenciones terapéuticas dirigidas a la microbiota.
Conclusión
Este estudio pone de relieve la función de la microbiota intestinal en la degradación del colesterol con efectos en el nivel sérico de colesterol. Es posible que en un futuro próximo la microbiota intestinal sea un objetivo de las terapias hipocolesterolemiantes.






