Le métabolisme du cholestérol par des bactéries intestinales humaines non cultivées influence le niveau de cholestérol de l’hôte
Article commenté - Rubrique Adulte
Par le Pr Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
Commentaire de l’article original de Kenny et al. (Cell Host & Microbe 2020)
Le microbiome humain possède des capacités métaboliques étendues, mais notre compréhension des mécanismes reliant les bactéries intestinales au métabolisme humain reste limitée. Dans leur article, les auteurs se sont concentrés sur la conversion par le microbiote intestinal du cholestérol en coprostanol, un stérol mal absorbé, pour l’identification d’enzymes fonctionnelles et de bactéries impliquées dans ce processus. En intégrant des données appariées de métagénomique et de métabolomique provenant de cohortes existantes avec des connaissances et des expériences biochimiques, les auteurs proposent de prédire et valider l’existence d’un groupe de cholestérol déshydrogénases bactériennes qui contribuent à la formation du coprostanol. Ces enzymes sont codées par les gènes ismA dans un groupe de bactéries non cultivées, qui sont répandues dans des cohortes humaines géographiquement diverses. Les individus hébergeant les bactéries intestinales contribuant à la formation du coprostanol ont des taux de cholestérol fécal significativement plus bas et un cholestérol total sérique inférieur avec des effets comparables à ceux attribués aux variations des gènes de l’homéostasie lipidique. Ainsi, le métabolisme du cholestérol par ces bactéries pourrait jouer un rôle important dans la réduction des concentrations intestinales et sériques de cholestérol, ayant un impact direct sur la santé humaine. [1]
Que sait-on déjà à ce sujet ?
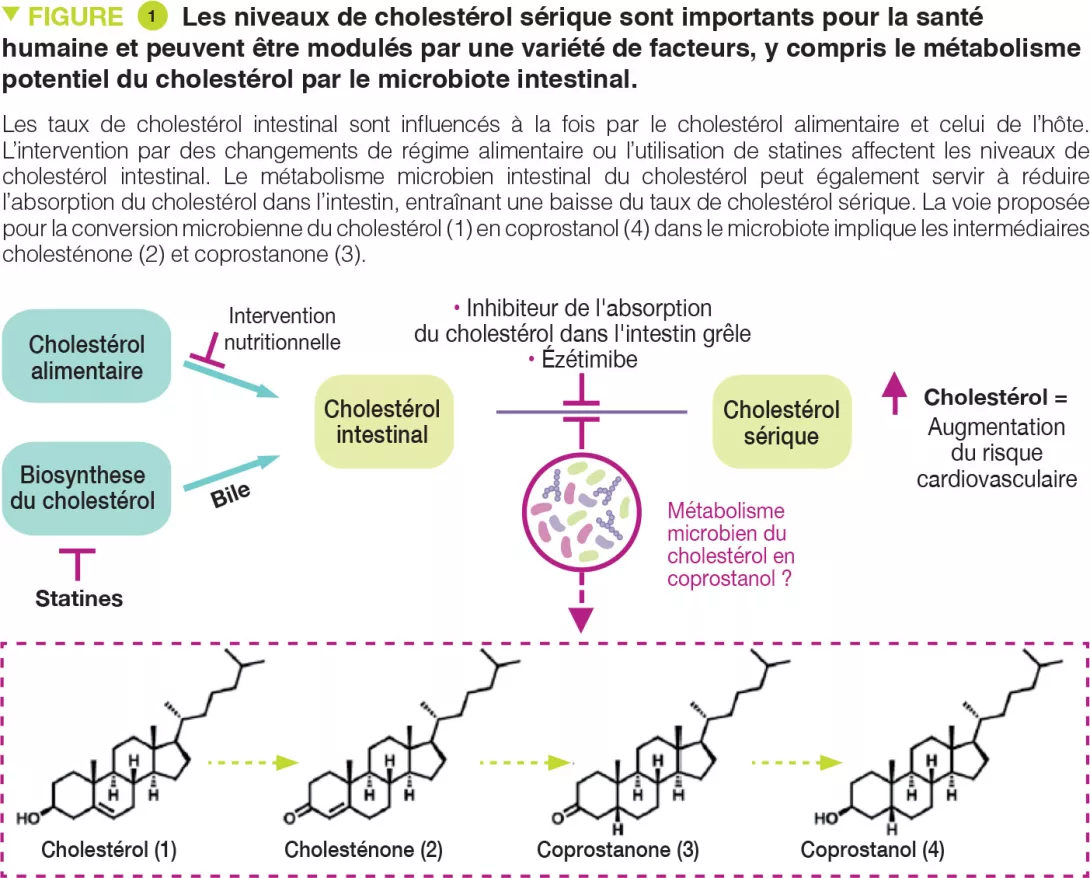
Le cholestérol est une molécule biologique clé qui fonctionne comme un composant structurel de toutes les membranes cellulaires animales et est un précurseur des hormones stéroïdes, de la vitamine D et des acides biliaires. Deux sources principales de cholestérol influencent sa concentration dans le sérum : le cholestérol endogène synthétisé dans le foie et le cholestérol exogène dérivé de composants alimentaires d’origine animale (Figure 1). Le cholestérol synthétisé dans les hépatocytes est transporté vers la vésicule biliaire et est ensuite sécrété dans l’intestin grêle avec d’autres sels biliaires. Dans l’intestin, le cholestérol biliaire (~ 1-2 g/jour) se mélange au cholestérol alimentaire (~ 0,2-0,4 g/jour dans le régime alimentaire américain moyen), et les deux sources sont finalement transportées dans les entérocytes pour être conditionnées en particules de lipoprotéines et sécrétées dans le plasma. L’hypercholestérolémie est un facteur de risque des maladies cardiovasculaires (MCV), qui sont à l’origine d’un quart de tous les décès dans les pays industrialisés.
La réduction du transport du cholestérol dans l’intestin est une stratégie cliniquement validée pour abaisser le taux de cholestérol sérique. Une gamme de bactéries intestinales métabolisent et modifient les molécules alimentaires et dérivées de l’hôte dans l’intestin grêle. Étant donné que les deux sources de cholestérol traversent cet environnement, le microbiote intestinal pourrait influencer les taux de cholestérol sérique. En effet, le transfert de microbiote de donneurs humains avec des taux sériques élevés de cholestérol peut transmettre ce phénotype hyperchlolestérolémique chez la souris [2, 3]. D’autres études ont rapporté que l’administration d’espèces bactériennes particulières peut avoir des effets hypocholestérolémiants [4]. Cependant, les mécanismes précis sous-tendant ces observations sont actuellement inconnus. Le microbiote intestinal pourrait exercer des effets hypocholestérolémiants en métabolisant le cholestérol intestinal en coprostanol (Figure 1), qui réduirait la quantité de cholestérol absorbée par l’intestin.
On sait depuis le début des années 1900 que cette transformation dépendante du microbiote se produit chez l’homme. Plusieurs bactéries intestinales générant du coprostanol avec des caractéristiques physiques et biochimiques similaires ont été signalées à partir de diverses sources, notamment des rats, des babouins et des humains. Cependant, la plupart de ces souches ne sont actuellement pas disponibles et n’ont jamais été séquencées. Les premiers travaux ont montré que la formation de coprostanol par ce groupe de bactéries intestinales passe par une voie de réduction indirecte impliquant l’oxydation initiale du cholestérol (1) en cholesténone (2), suivie de la réduction de la double liaison D4,5 pour former la coprostanone (3), et re-réduction ultérieure de la cétone pour générer du coprostanol (4) (Figure 1). Les enzymes bactériennes responsables de ce métabolisme n’ont jamais été identifiées. Plus récemment, d’autres rapports ont impliqué d’autres bactéries intestinales phylogénétiquement diverses dans la formation du coprostanol [5]. Alors que les efforts visant à élucider comment le métabolisme microbien intestinal du cholestérol affecte le taux de cholestérol sérique humain s’étendent sur plus de 100 ans, les éléments mécanistiques sont restés insaisissables en raison d’une compréhension limitée des bactéries intestinales, gènes et enzymes responsables de la formation du coprostanol.
Points clés
-
Certaines bactéries du microbiote intestinal humain possèdent des enzymes, de la famille ismA, capables de dégrader le cholestérol.
-
La présence d’espèces ismA + dans le microbiote intestinal est associée à une diminution du cholestérol fécal et sérique chez l’homme.
-
L’effet des espèces ismA + sur le cholestérol sérique est comparable à celui de la génétique humaine.
Quels sont les principaux résultats apportés par cette étude ?
Les auteurs ont utilisé une stratégie multidisciplinaire pour la découverte d’enzymes bactériennes intestinales. Cette stratégie, basée sur des corrélations entre données de métagénomique et de métabolomique provenant de cohortes humaines existantes, a permis d’identifier et de caractériser une famille étendue d’enzymes de cholestérol déshydrogénase à partir d’un groupe de bactéries intestinales non cultivées qui interviennent dans le métabolisme du cholestérol en coprostanol. Tout d’abord, l’enzyme responsable de la première étape de dégradation du cholestérol, nommé ismA, a été identifiée dans Eubacterium coprostanoligenes, une bactérie déjà connue pour cette fonction. L’analyse des données de séquençages sur cohortes humaines a ensuite permis d’identifier des enzymes homologues dans un groupe de bactéries anaérobies non cultivées. La présence de ces gènes ismA dans le microbiome était associée à la présence de coprostanol dans les selles et à une réduction fécale des taux de cholestérol. Enfin, pour démontrer le potentiel de ces bactéries à influencer la santé humaine, les auteurs montrent que la présence de gènes ismA dans les métagénomes humains est associée à une diminution des concentrations de cholestérol total dans le sérum, comparable aux effets observés à partir de variants des gènes humains impliqués dans l’homéostasie lipidique.
Quelles conséquences en pratique ?
Ensemble, ces résultats confirment le rôle du métabolisme bactérien intestinal dans la modulation des niveaux de cholestérol de l’hôte dans l’intestin mais, plus important, aussi au niveau systémique. Ces travaux ouvrent la voie à l’utilisation du microbiote intestinal comme biomarqueur prédictif du risque d’hypercholestérolémie et jettent les bases d’interventions thérapeutiques ciblées sur le microbiote.
Conclusion
Cette étude met en lumière le rôle du microbiote intestinal dans la dégradation du cholestérol avec des effet sur le niveau sérique de cholestérol. Le microbiote intestinal pourrait prochainement être une cible pour les thérapies hypocholestérolémiantes.






