L’axe intestin-poumon dans les infections respiratoires d’origine virale
Synthèse
Par le Dr François Trottein
Centre d’Infection et d’Immunité de Lille, Inserm U1019, CNRS UMR 9017, Université de Lille, CHU Lille, Institut Pasteur de Lille, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
La nouvelle maladie à coronavirus 19 (COVID-19) nous rappelle que les interactions entre le microbiote intestinal et le système immun itaire sont essentielles lors des infections virales des voies respiratoires. Les virus respiratoires peuvent déclencher des symptômes gastro-intestinaux, mettant en évidence le rôle de l’axe poumon-intestin dans la maladie. Des études cliniques et l’exploitation de modèles expérimentaux indiquent que les infections respiratoires aiguës d’origine virale modifient la composition et les fonctions du microbiote intestinal. Dans cette revue, nous examinons ces changements majeurs et discutons des causes potentielles de la dysbiose intestinale induite lors d’infections respiratoires virales. Nous présentons également les conséquences de la dysbiose intestinale sur la maladie. Enfin, nous suggérons des stratégies interventionnelles visant à cibler le microbiote intestinal afin de r éduire la sévérité des maladies respiratoires d’origine virale.
La menace constante liée aux infections respiratoires d’origine virale
Les infections des voies respiratoires d’origine virale constituent une préoccupation majeure à l’échelle planétaire. En effet, elles entraînent des problèmes considérables sur les plans socio-économique et sanitaire. Malgré des campagnes vaccinales et les traitements antiviraux, l’infection par le virus grippal (influenza) reste la plus impactante quant au nombre d’individus infectés (5 à 10 % de la population mondiale) et de décès (> 600 000 par an). Parallèlement aux épidémies annuelles, la grippe est également responsable de pandémies tous les 10 à 20 ans. La plus connue est la grippe espagnole de 1918- 1919 (50 millions de décès), la plus récente est la grippe pandémique de 2009 à H1N1 (surmortalité de 400 000 décès) [1]. Les pandémies ne se limitent pas à la grippe, comme en témoigne l’exemple de la COVID-19 [2]. La fréquence accrue des pandémies survenues au cours des dernières décennies est particulièrement préoccupante. Ce phénomène s’explique en partie par les changements climatiques et les pratiques humaines.
Rôle du microbiote intestinal dans la santé et les maladies
Le microbiote intestinal joue un rôle crucial en santé humaine et il est déterminant dans le contrôle des infections, dont les infections respiratoires [3, 4]. De nombreux facteurs peuvent modifier la diversité et la composition du microbiote intestinal, conduisant à une dysbiose. Parmi ces facteurs, des situations pathologiques telles que des infections et des troubles inflammatoires ou métaboliques chroniques peuvent entraîner une profonde modification de la composition du microbiote intestinal et de sa fonction. La dysbiose intestinale influence l’évolution des maladies, même celles affectant d’autres organes comme le poumon [3, 4]. Nous récapitulons ci-dessous les effets des infections respiratoires aiguës d’origine virale sur le microbiote intestinal.
Les infections virales des voies respiratoires entraînent une dysbiose intestinale
Des études chez l’homme ont montré la présence d’une dysbiose intestinale lors de l’infection grippale. L’abondance relative d’Actinobacteria, Erysipelotrichea, Clostridia et des producteurs de butyrate (familles des Lachnospiraceae et Ruminococcaceae) diminuent chez les patients H1N1. En revanche, les agents pathogènes opportunistes tels que Escherichia-Shigella et Prevotella se développent [5]. Dans des modèles expérimentaux (souris), une dysbiose intestinale transitoire survient également, avec un pic à 5 à 7 jours après l’infection [6-9]. On observe des changements aux niveaux taxonomiques sans modification de la diversité alpha. L’infection réduit la croissance de bactéries bénéfiques pour la santé telles que Lactobacilli ou Bifidobacteria, et des bactéries filamenteuses segmentées. De nombreuses espèces capables de transformer par fermentation les fibres alimentaires en acides gras à chaîne courte (AGCC) sont affectées. La production des AGCC chute drastiquement pendant l’infection grippale [9]. La diminution de la fréquence relative des bactéries commensales bénéfiques s’accompagne d’une prolifération des bactéries délétères, notamment Gammaproteobacteria (Escherichia coli) et Verrucomicrobia (du genre Akkermansia) et Ruminococcus, ces dernières étant capables de dégrader le mucus intestinal. Des travaux récents montrent que l’infection par le SARS-CoV-2 (l’agent de la COVID-19) déclenche également des modifications du microbiote intestinal chez l’homme avec notamment une réduction de la fréquence des producteurs de butyrate tels que plusieurs genres bactériens appartenant aux familles Ruminococcaceae et Lachnospiraceae (Roseburia) [5, 10]. En revanche, une proportion relative significativement plus élevée de bactéries pathogènes opportunistes comprenant Streptococcus (de la classe Bacilli), Rothia et Actinomyces a été observée. Il convient de noter qu’une prolifération de pathogènes opportunistes fongiques (Aspergillus et Candida spp.) a également été décrite chez les patients atteints de COVID-19 [11]. De manière générale, les infections respiratoires d’origine virale entraînent un appauvrissement des bactéries commensales bénéfiques et une augmentation des bactéries opportunistes délétères. Les changements putatifs de la structure du microbiote intestinal, de sa composition et de son activité fonctionnelle pourraient constituer des biomarqueurs de la sévérité de la maladie.
Mécanismes entraînant une dysbiose intestinale
Les causes de la dysbiose intestinale survenant lors des infections respiratoires d’origine virale sont probablement multiples. Elles peuvent comprendre la libération de cytokines inflammatoires et la réduction de la prise alimentaire (Figure 1). L’infection induit une perte de poids importante due à une perte de l’appétit. Des expériences de transfert de flore fécale indiquent clairement qu’une baisse rapide de l’absorption de nourriture reproduit les modifications du microbiote intestinal observées lors de la grippe [8]. Des preuves récentes suggèrent un rôle du TNFa dans la dysbiose associée à l’inappétence lors d’infections respiratoires d’origine virale [12]. Les interférons de type I et de type II, essentiels pour assurer la réponse antivirale de l’hôte, jouent également un rôle dans la dysbiose intestinale [5,6].
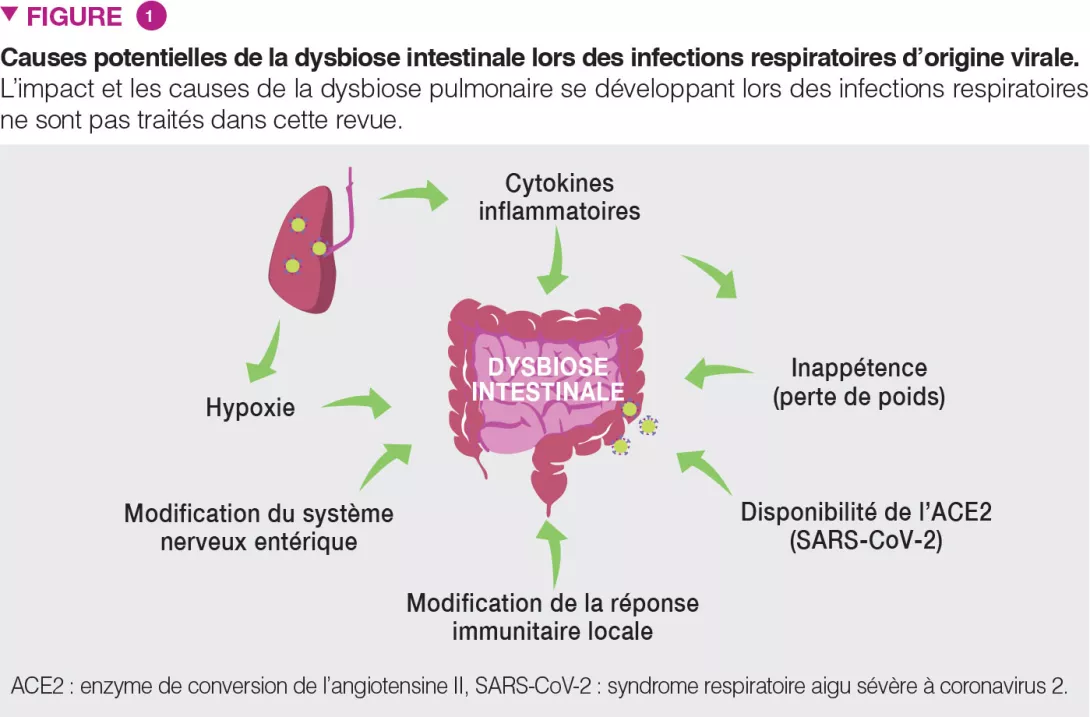
L’hypoxie (une caractéristique de l’infection respiratoire aiguë d’origine virale), les modifications au niveau du système nerveux entérique et la dérégulation de la réponse immunitaire locale pourraient aussi participer à la dysbiose intestinale [13] (Figure 1). Dans le cas de la COVID-19, parallèlement à ces mécanismes, la réplication virale locale est susceptible de jouer un rôle dans la dysbiose intestinale. L’enzyme de conversion de l’angiotensine II (ACE2), le récepteur du SARS-CoV-2, est essentielle pour maintenir l’écologie microbienne de l’intestin. Il a été montré que l’infection par le SARS-CoV-2 altère l’expression d’ACE2, ce qui pourrait perturber la composition et les fonctions du microbiote intestinal [13].
Conséquences d’une dysbiose intestinale sur les évolutions secondaires
La dysbiose intestinale observée lors des infections respiratoires d’origine virale a des conséquences locales et distales. Elle pourrait contribuer de façon importante à la sévérité de la maladie et à une évolution fatale (Figure 2). Les patients présentant une infection respiratoire d’origine virale peuvent développer des symptômes de type gastro-entérite tels que des douleurs abdominales, des nausées, des vomissements et des diarrhées. Les modifications du microbiote intestinal peuvent expliquer ces troubles. Il est également probable que la modification du microbiote intestinal joue un rôle dans l’inflammation locale et dans la rupture de l’intégrité de la barrière intestinale [6]. Cette rupture de barrière pourrait augmenter les concentrations d’endotoxines dans le sang, déclenchant une inflammation, une surproduction de cytokines et des dysfonctionnements pulmonaires [14]. Les infections respiratoires aiguës d’origine virale peuvent entraîner des infections entériques secondaires et une septicémie. La dysbiose intestinale et la diminution des AGCC pourraient être importantes dans ce contexte. En effet, les AGCC jouent un rôle essentiel dans l’homéostasie, l’intégrité de la barrière intestinale et le contrôle des agents pathogènes entériques [15]. Parallèlement aux troubles locaux, nos données récentes montrent que la dysbiose intestinale peut entraver à distance les défenses de l’hôte au niveau pulmonaire [9] (Figure 2). À l’homéostasie, le microbiote intestinal arme les poumons contre les infections bactériennes, en partie en renforçant l’activité bactéricide des macrophages alvéolaires [16].
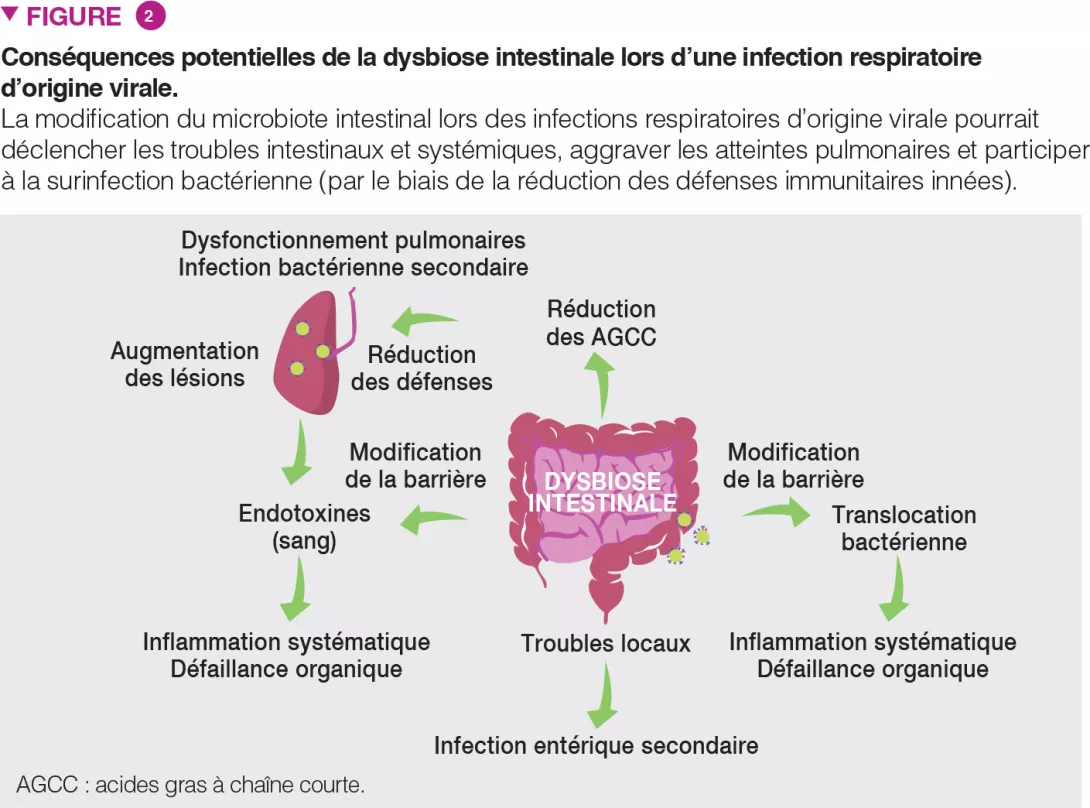
Pendant une grippe, cet axe est modifié et des bactéries opportunistes envahissent les poumons. Cela entraîne une surinfection bactérienne, une cause majeure de décès lors des épidémies et pandémies grippales [1]. Nous avons montré que la réduction de la production d’acétate (un AGCC majeur) par le microbiote intestinal est en partie responsable de cet effet [9]. Pour conclure, la dysbiose provoquée par l’infection respiratoire virale pourrait participer aux symptômes gastro-intestinaux et à la sévérité de la maladie, dont les surinfections bactériennes. Pouvons-nous exploiter l’axe intestin-poumon pour mieux contrôler la sévérité des infections respiratoires virales et réduire le taux de mortalité ?
Perspectives interventionnelles
Le microbiote intestinal est essentiel dans les défenses pulmonaires contre les infections respiratoires. Des stratégies interventionnelles ciblant les bactéries commensales de l’intestin pourraient donc être développées pour armer de façon préventive les poumons contre les agents pathogènes. Cette approche permettrait de protéger le microbiote des perturbations associées aux infections virales (Figure 3). Cela est particulièrement vrai chez les individus qui présentent un déséquilibre général du microbiote intestinal, tels que les personnes âgées et les individus présentant des comorbidités, plus sensibles aux infections.
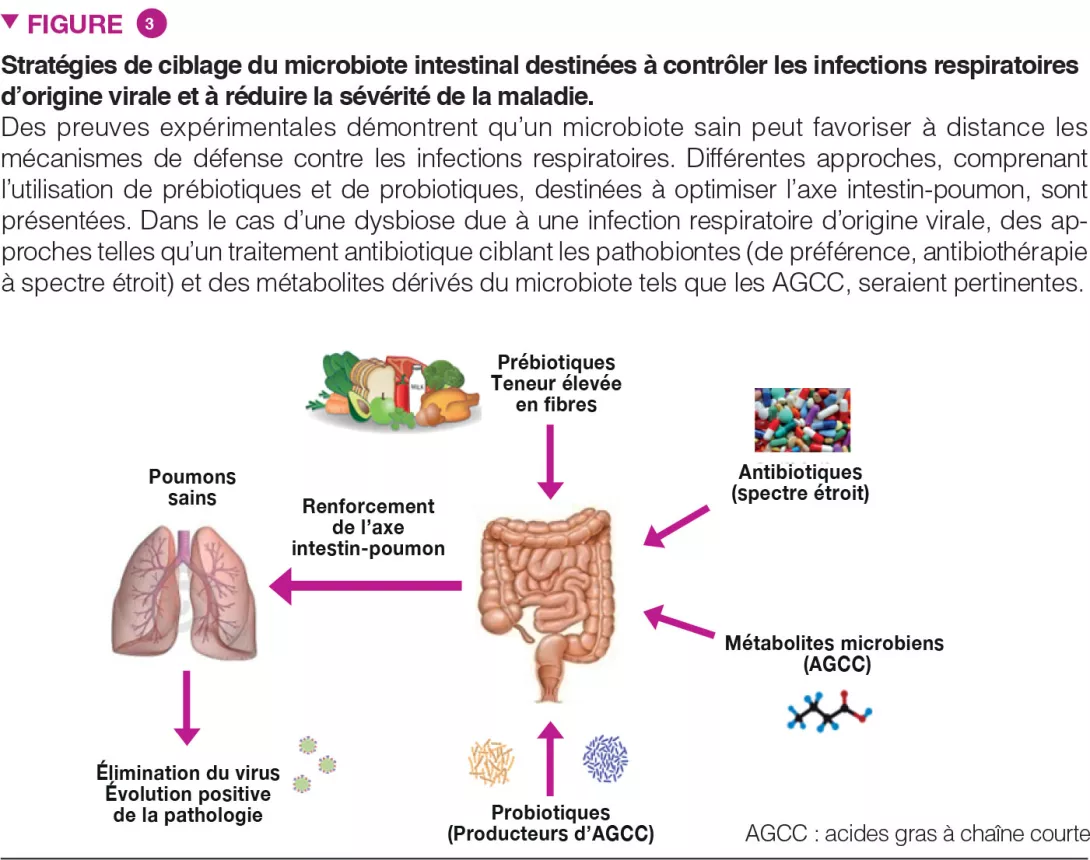
Des approches telles que (i) des compléments alimentaires enrichis en fibres végétales destinés à nourrir nos micro-organismes bénéfiques et (ii) la supplémentation en probiotiques pourraient être pertinentes. Ces stratégies, en particulier lorsqu’elles sont personnalisées (c’està- dire basées sur l’analyse du microbiote intestinal dans la population « à risque ») pourraient améliorer les paramètres cliniques et accélérer la récupération des patients souffrant d’infections virales. Les probiotiques tels que certaines bifidobactéries et Lactobacillus spp. peuvent réduire la gravité de la grippe bien que les mécanismes soient encore peu compris [17]. Sujet d’actualité, une étude récente a montré qu’une bactériothérapie orale, en combinaison avec le traitement médicamenteux classique, pourrait améliorer le devenir des patients atteints de la COVID-19 [18].
Conclusion
L’axe intestin-poumon est important dans les mécanismes de défense contre les infections respiratoires. Ces dernières peuvent modifier la composition et la fonction du microbiote intestinal et ainsi contribuer à la sévérité de la maladie. Le microbiote intestinal représente donc une cible de choix pour prévenir et limiter la gravité des infections respiratoires. Les moyens d’intervention comprennent l’apport raisonné de fibres végétales et de probiotiques.





