ОСЬ КИШЕЧНИК — ГОЛОВНОЙ МОЗГ
Проф. Саркис К. Мазманян, Джон В. Бостик, Надя Сурьявината (Sarkis K. Mazmanian, John W. Bostick, Nadia Suryawinata)
Кафедра биологии и биоинженерии, Калифорнийский технологический институт, Пасадена, Калифорния, США
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Комментарии к статье Gabanyi и соавт. Science 2022 [1]
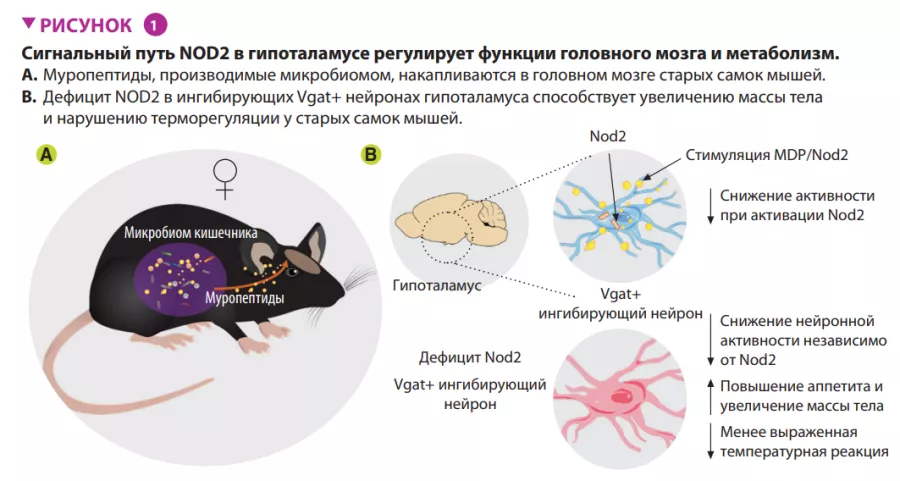
Микробиота влияет на метаболизм, и недавно было показано влияние кишечных бактерий на пищевое поведение мышей. Задача в этой области — определить сигнальные пути между кишечником и мозгом, которые связывают микробные соединения с нейронными процессами, влияющими на аппетит. Gabanyi и его коллеги определили функциональную роль Nod2, паттерн-распознающего рецептора бактериальных муропептидов и компонентов бактериальной клеточной стенки, в регуляции аппетита и терморегуляции у старых самок мышей. Обнаружено, что в головном мозге старых мышей накапливаются муропептиды, которые регулируют активность ингибирующих нейронов дугообразного ядра гипоталамуса. Индуцированный дефицит Nod2 в этих нейронах вызывает увеличение аппетита, повышение массы и снижение температуры тела зависимым от микробиоты образом. Это означает, что регулирование активности нейронов с помощью передачи сигналов Nod2 в мозге может влиять на сложные виды поведения у мышей, что требует дальнейших исследований.
ЧТО МЫ УЖЕ ЗНАЕМ?
Питание необходимо для выживания животных, а неправильное пищевое поведение ведет к серьезным метаболическим и психическим нарушениям, таким как ожирение и анорексия. Питание включает в себя сложные процессы, начиная от переработки и всасывания питательных веществ в кишечнике, заканчивая процессами в центральной нервной системе, которые регулируют аппетит и пищевое поведение. Внимание в области биологии аппетита сосредоточено на изучении нейронных цепей, участвующих в формировании пищевого поведения, например, нейронов, экспрессирующих агути-подобныйпептид (AgRP) в дугообразном ядре гипоталамуса, которые необходимы для поддержания пищевого гомеостаза [3]. Совсем недавно было показано, что кишечник и его резидентная микрофлора способны регулировать метаболизм [4] и различные аспекты пищевого поведения [5]. Однако вопрос о том, влияют ли соединения, продуцируемые микробами, на аппетит, остается открытым. Короткоцепочечные жирные кислоты, как побочный продукт микробной ферментации, уменьшают потребление пищи у мышей [6].
Однако, ранее не было известно о существовании сигнального пути «кишечник — головной мозг», который связывает микробные соединения с нейронными процессами, регулирующими аппетит и пищевое поведение. Предполагается участие рецептора распознавания микробных паттернов Nod2 в формировании пищевого поведения, поскольку у мышей, нокаутных по Nod2, отмечается ускоренный набор массы тела при кормлении пищей с высоким содержанием жиров [7]. Кроме того, один из компонентов сигнального пути Nod2, ядерный фактор kB (NFkB), экспрессируется в нейронах гипоталамуса, выступая в качестве регулятора энергетического баланса [8]. Можно предположить, что гипоталамус представляет собой уникальный «процессор», интегрирующий сигналы, поступающие от микробиома, и пищевые сигналы.
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
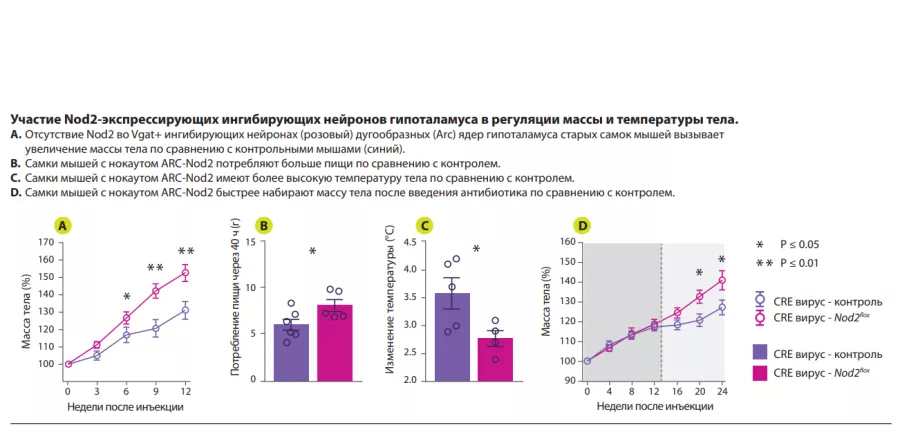
Авторы показали, что активация сигнального пути Nod2 в гипоталамусе влияет на пищевое поведение и терморегуляцию у мышей (рисунок 1). Nod2 экспрессируется в нейронах различных областей мозга мыши, включая полосатое тело, таламус и гипоталамус. Затем авторы изучили проникновение радиоактивно меченных муропептидов в головной мозг в зависимости от их способа поступления в организм: непосредственно с пищей или из радиоактивно меченных бактерий. В обоих случаях происходило накопление муропептидов в головном мозге. Результаты изучения функций Nod2 в нейронах на стандартной модели нокаутных (по Nod2) мышей, показали, что у старых самок мышей с отсутствием Nod2 в ингибирующих нейронах, экспрессирующих везикулярный транспортер ГАМК (Vgat/ Slc32a1), наблюдалось увеличение массы тела и нарушение терморегуляции. Измерения экспрессии Fos в головном мозге старых самок мышей показали более высокую активность нейронов дугообразных и дорсомедиальных ядер гипоталамуса. Вводя Cre-экспрессирующие аденоассоциированные вирусы (AAV) мышам с флоксированным геном Nod2, чтобы локально подавить экспрессию Nod2 в ингибирующих нейронах дугообразного ядра гипоталамуса, авторы показали, что дефицита Nod2 в гипоталамических нейронах достаточно, чтобы вызвать изменения массы тела и нарушения терморегуляции (рисунок 2).
Наконец, чтобы изучить роль микробиоты в Nod2-зависимых механизмах регуляции аппетита и температуры тела, мышам с избирательным отсутствием Nod2 в нейронах гипоталамуса вводили антибиотики широкого спектра действия. На фоне получения антибиотика мыши с дефицитом Nod2 в гипоталамусе демонстрировали нормальные аппетит и профиль набора массы тела. После прекращения введения антибиотика у этих же мышей отмечались повышенный аппетит и ускоренный набор массы тела по сравнению с контрольными животными с нормальным содержанием Nod2. Эти данные указывают на способность микробных продуктов модулировать аппетит у самок мышей посредством Nod2- зависимого механизма.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Nod2 экспрессируется в нейронах различных областей мозга мыши, включая полосатое тело, таламус и гипоталамус
- Лиганды Nod2, такие как муропептиды, накапливаются в мозге стареющих мышей
- Активность гипоталамических ингибирующих нейронов регулируется экспрессией Nod2
- У старых самок мышей с дефицитом Nod2 нарушается регуляция аппетита и температуры тела
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Gabanyi и соавт. определили функциональную роль экспрессии Nod2 в нейронах гипоталамуса в регулировании аппетита и температуры тела у стареющих самок мышей, но не у самцов. Клеточные и молекулярные механизмы, определяющие эти эффекты, еще предстоит выяснить. Половые различия в составе микробиома могут играть роль в различиях в ответ на дефицит Nod2 в нейронах; однако авторы не исследовали состав микроорганизмов. Кроме того, помимо муропептидов, другие микробные продукты и эндогенные стимулы, которые не рассматривались в этом исследовании, могут регулировать экспрессию или активацию Nod2 [9]. Необходимы дополнительные данные, чтобы отличить активность и вклад этих альтернативных стимулов от таковых муропептидов. Другие возможные факторы, вызывающие эффекты, описанные в статье, могут включать увеличение проницаемости кишечного и гематоэнцефалического барьеров, которое нарастает с возрастом, позволяя большему количеству микробных молекул поступать из кишечника в кровоток и накапливаться в головном мозге. Необходимы дальнейшие исследования для установления влияния пола и возраста на наблюдаемые процессы.
ЗАКЛЮЧЕНИЕ
В этом исследовании сообщается, что дефицита Nod2 в гипоталамических нейронах достаточно, чтобы вызвать изменения аппетита и регуляции температуры у старых самок мышей. Полученные результаты требуют подтверждения в дальнейших исследованиях на мышах и с участием человека.
1. Gabanyi I, Lepousez G, Wheeler R, et al. Bacterial sensing via neuronal Nod2 regulates appetite and body temperature. Science 2022; 376: eabj3986.
2. Gautron L, Elmquist JK, Williams KW. Neural control of energy balance: translating circuits to therapies. Cell 2015; 161: 133-45.
3. Chen Y, Lin YC, Kuo TW, Knight ZA. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell 2015; 160: 829-41.
4. Zarrinpar A, Chaix A, Xu ZZ, et al. Antibiotic-induced microbiome depletion alters metabolic homeostasis by affecting gut signaling and colonic metabolism. Nat Commun 2018; 9: 2872.
5. Yu KB, Hsiao EY. Roles for the gut microbiota in regulating neuronal feeding circuits. J Clin Invest 2021; 131: 143772.
6. Frost G, Sleeth ML, Sahuri-Arisoylu M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun 2014; 5: 3611.
7. Rodriguez-Nunez I, Caluag T, Kirby K, Rudick CN, Dziarski R, Gupta D. Nod2 and Nod2-regulated microbiota protect BALB/c mice from diet-induced obesity and metabolic dysfunction. Sci Rep 2017; 7: 548.
8. Zhang X, Zhang G, Zhang H, Karin M, Bai H, Cai D. Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity. Cell 2008; 135: 61-73.
9. Kuss-Duerkop SK, Keestra-Gounder AM. NOD1 and NOD2 Activation by Diverse Stimuli: a Possible Role for Sensing Pathogen-Induced Endoplasmic Reticulum Stress. Infect Immun 2020; 88: e00898-19.
10. Mossad O, Batut B, Yilmaz B, et al. Gut microbiota drives age-related oxidative stress and mitochondrial damage in microglia via the metabolite N6-carboxymethyllysine. Nat Neurosci 2022; 25: 295-305.