МИКРОБНАЯ КОЛОНИЗАЦИЯ КАК ОПРЕДЕЛЯЮЩИЙ ФАКТОР СОСТОЯНИЯ ЗДОРОВЬЯ В ПЕРВЫЕ 1000 ДНЕЙ ЖИЗНИ
Проф. Мари-Клэр Арриета (Marie-Claire Arrieta)
Кафедры физиологии, фармакологии и педиатрии, медицинский факультет Камминга, университет Калгари, исследовательский инновационный центр здравоохранения, Калгари, Альберта, Канада
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Эпидемиологические и механистические исследования за последние 20 лет продемонстрировали влияние характеристик микробиома в раннем периоде жизни на патогенез ряда неинфекционных заболеваний. Это триллионы микроорганизмов, обитающих в основном в кишечнике, которые вовлечены в постоянный «диалог» с клетками нашего тела. Именно благодаря этой связи микробные метаболиты и структуры на ранних этапах жизни способствуют программированию иммунных, неврологических, метаболических и эндокринных механизмов, обусловливающих правильное развитие. Связь сохраняется в течение всей жизни, но существует особый период в раннем развитии, известный как «окно возможностей», в течение которого взаимное общение между микробами и организмом способствует формированию стабильного или нарушенного гомеостаза. Именно этот период, длящийся около 1000 дней и включающий время роста плода и первые два года жизни человека, привлекает все больше внимания ученых.
СОСТАВ И ФУНКЦИИ МИКРОБИОМА В РАННЕМ ПЕРИОДЕ ЖИЗНИ
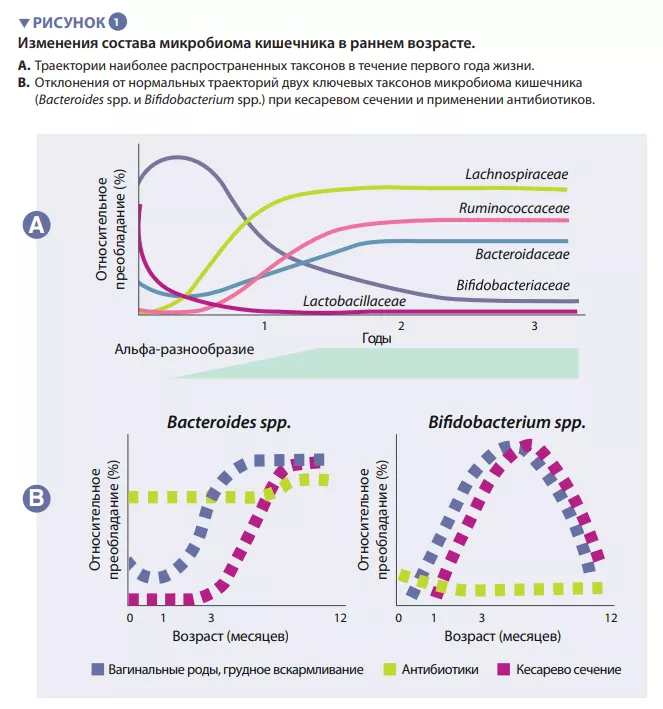
Кишечный микробиом человека начинает развиваться с момента рождения. Вначале это очень простая экосистема, которая через 2-3 года приобретает видовое разнообразие (вставка 1). Этот процесс происходит в несколько этапов, подчиняясь общим закономерностям, с некоторыми популяционными вариациями (рисунок 1). Первые виды, начинающие колонизацию, в основном происходят из родовых путей и фекалий или кожи матери, в зависимости от того, рождается ли ребенок естественным вагинальным путем или с помощью кесарева сечения. В первом случае доминируют Lactobacillus, Prevotella и Sneathia, у рожденных же с помощью кесарева сечения первые колонизаторы — это Staphylococcus, Propionibacterium и Corynebacterium . В организме младенцев на грудном вскармливании содержится больше Bifidobacterium sp. и Lactobacillus sp., а у получающих смесь — Bacteroides, Enterobacteriaceae и Clostridiaceae. По мере введения твердой пищи микробиом кишечника становится все более разнообразным, в нем начинают доминировать Bacteroidaceae, Lachnospiraceae и Ruminococcaceae, что сохраняется и во взрослом возрасте (рисунок 1) [1].
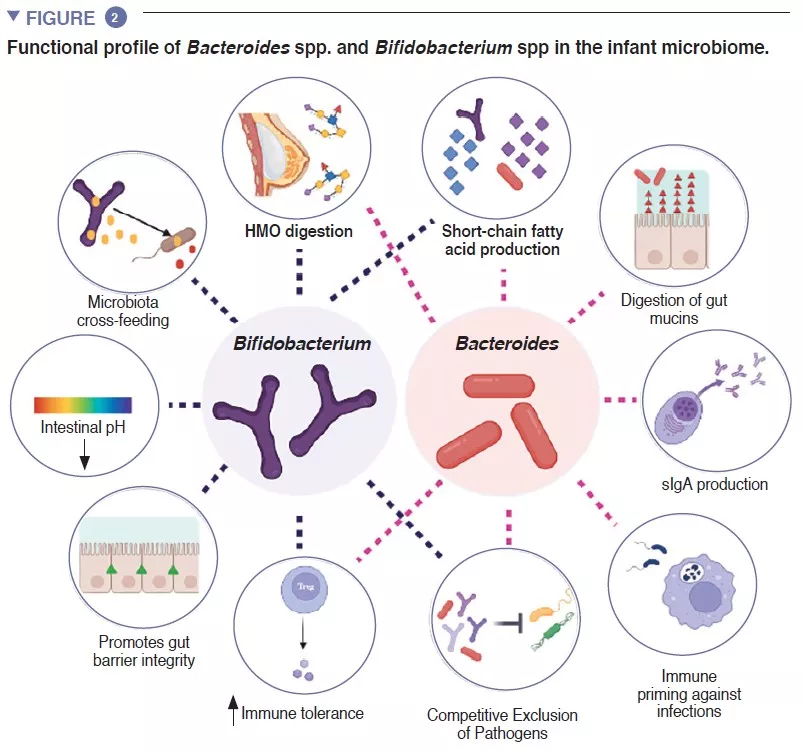
В кишечнике младенца происходят важные метаболические процессы, связанные сищеварением, энергетическим обменом и формированием иммунитета. Перерабатывая компоненты грудного молока, виды Bifidobacterium снижают рН в кишечнике за счет производства молочной (лактат) и уксусной (ацетат) кислот, значительно облегчая всасывание питательных веществ в кишечнике. Ацетат необходим для образования большинства короткоцепочечных жирных кислот (КЦЖК) в кишечнике ребенка и защиты от энтеропатогеных микроорганизмов [2]. Бифидобактерии также участвуют в процессе перекрестного кормления, в котором производимые ацетат и лактат служат субстратами для роста других видов, таких как Roseburia, Eubacterium, Faecalibacterium и Anaeroestipes , способствуя поддержанию разнообразия микробиома. Виды Bacteroides могут ферментировать грудное молоко, это важные продуценты КЦЖК пропионата. Они обладают уникальной способностью метаболизировать олигосахариды, полученные из муцина [3]. Метаболическая пластичность улучшает способность переносить изменения кишечной среды между приемами пищи, а также после прекращения грудного вскармливания и введения в рацион твердой пищи. Виды Bacteroides необходимы для созревания иммунной системы, являясь важным источником микробного липополисахарида, они стимулируют процессы развития иммунной толерантности в кишечнике [4]. Учитывая их особую приспособляемость к среде кишечника младенца, передачу от матери к ребенку, доминирование в кишечнике младенца, важность для других компонентов микробной экосистемы и пользу для организма, представители Bacteroides spp. и Bifidobacterium spp. представляют собой ключевые составляющие детского микробиома (рисунок 2).
ФАКТОРЫ, ПОДДЕРЖИВАЮЩИЕ МИКРОБИОМ В РАННЕМ ПЕРИОДЕ ЖИЗНИ
Первые виды-колонизаторы могут влиять в долгосрочной перспективе на траектории развития микробиома кишечника у детей. Этот экологический процесс определяет фундаментальную роль в формировании сообщества раннего контакта с новой экосистемой. Он объясняет влияние способа рождения на исходный состав микробиома ребенка. Большие когортные исследования в ыявили различия в микробиоме, связанные с кесаревым сечением, которые сохранялись в течение нескольких месяцев после рождения, вероятно, влияя на этот критический период развития организма [5]. К ним относятся меньшее содержание Bacteroides и Bifidobacterium spp., а также большее количество условно-патогенных видов.
Помимо способа рождения, характеристики микробиома в раннем возрасте определяют доступность и обилие питательных субстратов. Грудное молоко содержит более 10 г/л олигосахаридов человеческого молока (ОЧМ), из которых наиболее представлены 2’фукозиллактоза (2’FL) и трифукозиллактоN-гексаоза (TF-LNH) [6]. Большинство ОЧМ превращаются в КЦЖК благодаря бифидобактериям и Bacteroides spp. Бифидобактерии содержат большой набор генов для переваривания ОЧМ. В кишечнике младенца содержится несколько подвидов B. longum , из которых B. longum subsp. infantis (B. infantis), B. longum subsp. longum (B. longum) и B. longum subsp. breve (B. breve) обычно выделяют у здоровых детей на грудном вскармливании, а B. adolescentis — у получающих молочную смесь. Из этих подвидов B. infantis имеет самый большой набор генов для переваривания всех структур ОЧМ в грудном молоке. Грудное молоко также влияет на состав детского микробиома через иммунные факторы, такие как антимикробные соединения (лактоферрин и лизоцим), иммунны эффекторы (sIgA, иммунные клетки и цитокины), которые имеют решающее значение для подавления роста патогенных микробов [1]. Примечательно, что уменьшение содержания Bifidobacterium у детей, вскармливаемых смесью, ассоциируется с более низкой концентрацией лактата, sIgA и более высоким рН в кишечнике по сравнению с детьми, получающими грудное молоко.
Помимо способа рождения и питания, на микробиом в раннем возрасте могут влиять курение матери, индекс массы тела матери, гестационный сахарный диабет, семейная бронхиальная астма и стресс [8]. Механизмы, связывающие эти факторы и микробиом ребенка, остаются неясными, но, вероятно, включают изменения материнского микробиома и их вертикальную передачу новорожденному, а также повышенный риск кесарева сечения и меньшую вероятность успешного грудного вскармливания. В целом, влияние отдельных факторов, таких как способ рождения, применение антибиотиков и грудное вскармливание, изучено относительно хорошо. Тем не менее, о сочетанном влиянии этих факторов известно мало.
Возможна ли внутриутробная колонизация?
- Микробная ДНК была обнаружена в плаценте, амниотической жидкости и меконии, что вызвало предположение о возможности внутриутробной колонизации.
- • Неспособность выделить культуру микроорганизмов из этих структур, последовательное влияние способа рождения на микробиом и возможность производства микробиологических стерильных животных из эмбрионов привели к пониманию того, что в норме микробная колонизация начинается при рождении [15].
ДИСБАКТЕРИОЗ В РАННЕМ ВОЗРАСТЕ — ПРИЧИНА НЕИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Как молодая экосистема, микробиом в раннем периоде жизни менее устойчив. Экологическая устойчивость означает способность экосистемы возвращаться к своему первоначальному состоянию после вынужденного изменения. Это повышает риск того, что микробиом младенца будет постоянно менять свою траекторию во время критических стадий развития. Пери- и постнатальное применение антибиотиков вызывает резкие изменения состава и разнообразия микробиома у младенцев, известные как дисбиоз, уменьшая преобладание бифидобактерий и общее разнообразие микробиома, а также увеличивая количество патогенных видов. Этот эффект наблюдается даже тогда, когда антибиотики получает только мать Возможна ли внутриутробная колонизация? • Микробная ДНК была обнаружена в плаценте, амниотической жидкости и меконии, что вызвало предположение о возможности внутриутробной колонизации. • Неспособность выделить культуру микроорганизмов из этих структур, последовательное влияние способа рождения на микробиом и возможность производства микробиологических стерильных животных из эмбрионов привели к пониманию того, что в норме микробная колонизация начинается при рождении [15]. во время вагинальных родов (с целью профилактики инфекций, вызванных стрептококком группы В), и усиливается дозозависимым образом, если ребенок получает антибиотики в течение первого года жизни [9]. Примечательно, что даже один курс амоксициллина, полученный ребенком, уменьшал количество бифидобактерий в течение нескольких месяцев, подчеркивая восприимчивость важной группы бактерий к широко используемому препарату [10].
Введение антибиотиков во время беременности или до отъема у грызунов может усугубить аллергические иммунные реакции (связанных с IgE, лимфоцитами Th2 и Th17), ожирение, аутоиммунные реакции и хронический колит [1]. Эти системные ответы на дисбиоз в раннем возрасте согласуются с эпидемиологическими данными, связывающими применение антибиотиков в раннем возрасте с рядом неинфекционных заболеваний. Например, систематический обзор и метаанализ 13 исследований показал связь «дозаответ» между применением антибиотиков и ожирением, когда вероятность развития заболевания варьировалась от 11% для младенцев, получивших только одну дозу, до 24% при получении более одной дозы [9]. Совсем недавно систематический обзор и метаанализ 160 исследований, охватывающих более 22 миллионов детей, выявил связь между применением антибиотиков у детей и атопическим дерматитом, пищевой аллергией , аллергическим риноконъюнктивитом, бронхиальной астмой, ювенильным артритом, псориазом и расстройствами аутистического спектра [11].
Установить направленность и причинноследственную связь из эпидемиологических исследований очень сложно. Тем не менее, результаты доклинических исследований и данные о дозозависимой связи между применением антибиотиков и возникновением бронхиальной астмы и ожирения показывают необходимость более строгого контроля использования антибиотиков. В недавнем исследовании с участием детей из Канады отмечено параллельное снижение заболеваемости бронхиальной астмой после уменьшения назначений антибиотиков в общей популяции между 2000 и 2014 гг. Важно отметить, что состав микробиома в возрасте 1 года влиял на связь между применением антибиотиков и выявлением бронхиальной астмы в возрасте 5 лет [12]. Результаты исследования убедительно доказывают существование причинно-следственной связи между применением антибиотиков и развитием бронхиальной астмы у людей, подчеркивая необходимость разумного использования антибиотиков в качестве стратегии снижения заболеваемости бронхиальной астмой.
МОЖНО ЛИ ВЫЛЕЧИТЬ ДИСБИОЗ?
Вредные последствия дисбиоза в раннем возрасте требуют не только дальнейшего изучения, но и практических действий. Такие меры, как уменьшение частоты кесарева сечения, использования смесей для кормления и назначения антибиотиков, хотя и являются достойной целью, имеют ограниченный потенциал в качестве успешных стратегий соответствия социальным потребностям. Было предложено несколько методов восстановления микробиома, показавших неоднозначные результаты. Два из них — вагинальный посев и трансплантация фекальной микробиоты (ТФМ) — изучали в условиях планового кесарева сечения. Вагинальный посев подразумевает нанесение на кожу и/или введение в полость рта новорожденного вагинального секрета матери. Результаты трех исследований этого метода показали, что он не восстанавливает микробиоту детей, родившихся путем кесарева сечения, до состояния, как после вагинальных родов [8]. Напротив, ТФМ от матери к ребенку (однократная процедура во время первого кормления) было достаточно для коррекции микробиома после кесарева сечения [13]. Хотя авторы проводили скрининг образцов для ТФМ на патогены, эта спорная практика содержит риск инфицирования для здорового новорожденного, поэтому вероятно не найдет широкое распространение.
Использование пре- и пробиотиков может обеспечить более практичный и осуществимый подход к восстановлению микробиома, особенно при поддержке информации из исследований, обобщенных выше. Недавнее исследование показало, что восстановления популяции бифидобактерий и генов метаболизма ОЧМ можно добиться, комбинируя введение штамма B. infantis и грудное вскармливание [14]. Эта стратегия позволяла ослабить провоспалительные реакции, способствующие развитию аллергии в течение 1 года жизни, показав долгосрочные полезные эффекты в отношении иммунной системы. Тем не менее, нет убедительных доказательств того, что нынешние стратегии восстановления микробиома помогут изменить тревожную ситуацию с заболеваемостью неинфекционными болезнями у детей.
ЗАКЛЮЧЕНИЕ
Микробиом в раннем возрасте — важнейшая составная часть здоровья ребенка. Наши знания о составе и функциях раннего микробиома, а также о факторах, поддерживающих или нарушающих микробиом, значительно расширились. Однако механизмы, объясняющие, как дисбактериоз способствует развитию заболеваний, изучены мало. Эффективными могут оказаться экологически обоснованные меры по восполнению ключевых видов младенческого микробиома, утраченных в результате применения антибиотиков, кесарева сечения и кормления смесью, а также использование питательных субстратов. Но нынешние стратегии восстановления микробиома все еще недостаточно эффективны, в том числе с точки зрения профилактики неинфекционных заболеваний. Все это показывает необходимость ускорить изменения в медицинской политике и практике.
1. Laforest-Lapointe I, Arrieta MC. Patterns of Early-Life Gut Microbial Colonization during Human Immune Development: An Ecological Perspective. Front Immunol 2017; 8: 788.
2. Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 2011; 469: 543-7.
3. Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 2005; 307: 1955-9.
4. Telesford KM, Yan W, Ochoa-Reparaz J, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes 2015; 6: 234-42.
5. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118: 511-21.
6. Thurl S, Munzert M, Boehm G, et al. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev 2017; 75: 920-33.
7. Underwood MA, German JB, Lebrilla CB, et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res 2015; 77: 229-35.
8. Korpela K, de Vos WM. Infant gut microbiota restoration: state of the art. Gut Microbes 2022; 14: 2118811.
9. Mc- Donnell L, Gilkes A, Ashworth M, et al. Association between antibiotics and gut microbiome dysbiosis in children: systematic review and meta-analysis. Gut Microbes 2021; 13: 1-18.
10. Korpela K, Salonen A, Saxen H, et al. Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatr Res 2020; 88: 438-43.
11. Duong QA, Pittet LF, Curtis N, et al. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. J Infect 2022; 85: 213-300.
12. Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med 2020; 8: 1094-105.
13. Korpela K, Helve O, Kolho KL, et al. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell 2020; 183: 324-34.e5.
14. Henrick BM, Rodriguez L, Lakshmikanth T, et al. Bifidobacteria-mediated immune system imprinting early in life. Cell 2021; 184: 3884-98.e11.
15. Perez-Muñoz ME, Arrieta MC, Ramer-Tait AE, et al. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome 2017; 5: 48.