Colonização microbiana: um fator determinante da saúde durante os primeiros 1000 dias de vida
Pelo Pr. Marie-Claire Arrieta
Departamentos de Fisiologia e Farmacologia e Pediatria, Faculdade de Medicina Cumming, Universidade de Calgary, Centro de Investigação e Inovação em Saúde, Calgary, Alberta, Canadá
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Sobre este artigo
Estudos epidemiológicos e mecanicistas realizados nos últimos 20 anos demonstraram que a microbiota no início da vida desempenha um papel na patogénese de várias doenças não transmissíveis (DNT). Este conjunto de triliões de microrganismos, que reside principalmente no intestino, estabelece um diálogo dinâmico com as células do hospedeiro. É através deste diálogo que o hospedeiro integra os metabolitos e as estruturas microbianas na programação dos mecanismos imunitários, neurológicos, metabólicos e endócrinos que lhe permitirão desenvolver-se. Embora este diálogo se prolongue ao longo de toda a vida, existe um período único no início do desenvolvimento, conhecido como “janela de oportunidade”, durante o qual o diálogo entre os microrganismos e o hospedeiro prepara o terreno para a homeostasia do hospedeiro ou para os seus desvios. Este período dura cerca de 1000 dias, abrangendo o crescimento fetal e os dois primeiros anos de vida humana, e é objeto de intensa investigação.
COMPOSIÇÃO E FUNÇÃO DA MICROBIOTA NO INÍCIO DA VIDA
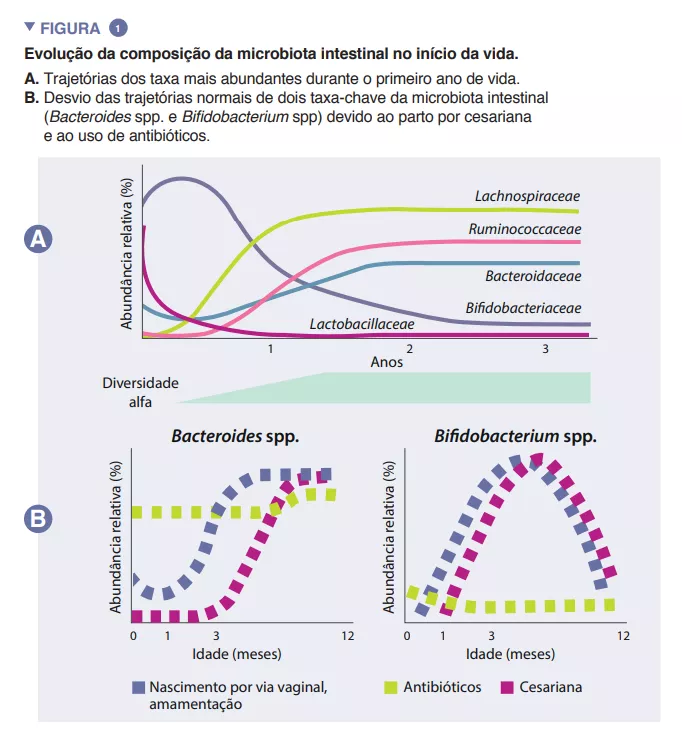
A microbiota intestinal do lactente começa a desenvolver-se à nascença com um ecossistema muito simples, e a diversidade das suas espécies aumenta ao longo de um período de cerca de 2 a 3 anos (Caixa). Este processo desenrola-se em várias etapas, com perfis comuns identificados entre diferentes populações humanas (Figura 1). A colonização começa com espécies pioneiras provenientes principalmente do canal vaginal e das fezes ou da pele da mãe, consoante a criança tenha nascido por via vaginal ou por cesariana, respetivamente. As crianças nascidas por via vaginal apresentam uma maior abundância de Lactobacillus, Prevotella e Sneathia, enquanto as nascidas por cesariana são inicialmente colonizadas por Staphylococcus, Propionibacterium e Corynebacterium. As crianças amamentadas ao peito têm uma maior abundância de espécies dos géneros Bifidobacterium e Lactobacillus do que as crianças alimentadas com leite infantil, que têm uma maior abundância de Bacteroides, Enterobacteriaceae e Clostridiaceae. Com a introdução de alimentos sólidos, a microbiota intestinal torna-se cada vez mais diversificada, passando para um estado dominado por Bacteroidaceae, Lachnospiraceae e Ruminococcaceae, que persiste até à idade adulta (Figura 1) [1].
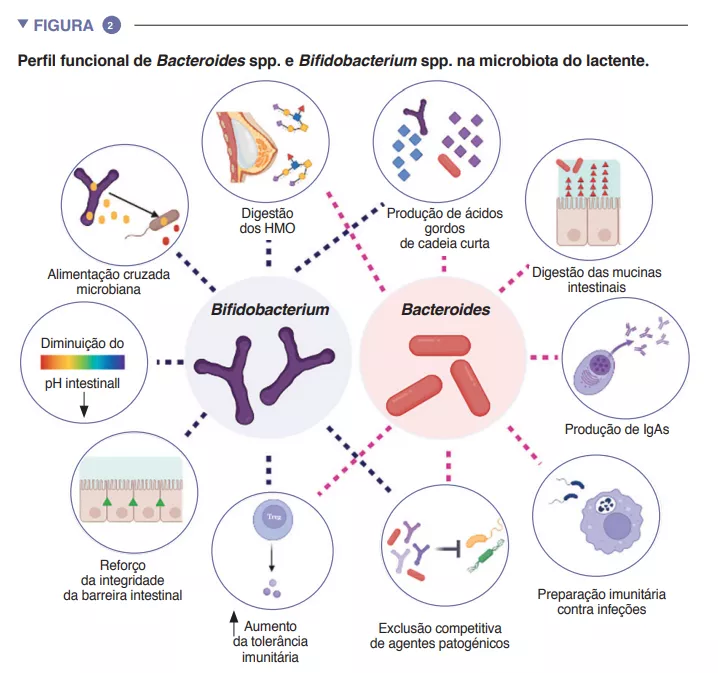
O intestino do lactente é uma fase metabólica importante, contribuindo para a digestão, o metabolismo energético e a educação imunitária. Através da digestão microbiana dos componentes do leite materno, as espécies do género Bifidobacterium baixam o pH do lúmen intestinal produzindo lactato e acetato, o que biano lipopolissacarídeo e promovendo o desenvolvimento de respostas imunitárias adaptativas tolerogénicas no intestino [4]. Dada a sua adaptabilidade particular ao ambiente intestinal do lactente, a sua transmissibilidade da mãe para o filho, a sua dominância no intestino do lactente, a sua importância para outros membros deste ecossistema microbiano e os seus benefícios para o hospedeiro, as espécies dos géneros Bacteroides e Bifidobacterium são provavelmente espécies-chave na microbiota do lactente humano (Figura 2).
OS FATORES QUE INFLUENCIAM A MICROBIOTA NO INÍCIO DA VIDA
As espécies pioneiras podem ter um impacto duradouro na trajetória da microbiota intestinal do lactente através de efeitos prioritários. Este processo ecológico implica que uma chegada precoce a um novo ecossistema desempenha um papel fundamental na formação da comunidade. Este processo explica a influência do modo de parto na composição inicial da microbiota do lactente. Grandes estudos de coorte identificaram diferenças na microbiota associadas ao parto por cesariana que persistem durante meses após o nascimento e que são suscetíveis de ter impacto neste período crítico do desenvolé considerado uma estratégia crucial para aumentar a absorção intestinal de nutrientes. O acetato é responsável pela maioria dos ácidos gordos de cadeia curta (AGCC) produzidos no intestino infantil e está implicado na prevenção de infeções por enteropatogénios [2]. As bifidobactérias também estão envolvidas num processo conhecido como cross-feeding ou alimentação cruzada, no qual a produção de acetato e lactato serve de substrato para o crescimento de outras espécies, tais como Roseburia, Eubacterium, Faecalibacterium e Anaeroestipes, promovendo assim a diversidade da microbiota. As espécies de Bacteroides também podem fermentar o leite materno e são importantes produtores de propionato, um AGCC. As espécies do género Bacteroides também têm uma capacidade única de metabolizar oligossacáridos derivados da mucina [3]. Esta plasticidade metabólica melhora a sua adaptabilidade às flutuações das condições intestinais entre as refeições, bem como após o desmame e a introdução de alimentos sólidos. As espécies do género Bacteroides são também essenciais para a educação imunitária, constituindo uma fonte importante do componente microvimento do hospedeiro [5]. Estas incluem uma menor abundância de espécies dos géneros Bacteroides e Bifidobacterium e uma maior abundância de espécies potencialmente patogénicas.
Para além do modo de parto, a disponibilidade e abundância de substratos nutricionais têm um efeito decisivo sobre a microbiota no início da vida. O leite materno contém mais de 10 g/L de HMO (human milk oligosaccharides, oligossacarídeos do leite humano), sendo a 2’fucosil-lactose (2’FL) e a trifucosilacto-N-hexaose (TF-LNH) as mais abundantes [6]. A maioria dos HMO são digeridos por espécies dos géneros Bifidobacterium e Bacteroides em AGCC. As bifidobactérias têm um vasto repertório de genes para digerir HMO. Várias subespécies de B. longum são frequentemente encontradas no intestino dos lactentes, sendo as subespécies infantis (B. infantis), longum (B. longum) e breve (B. breve) frequentemente isoladas das fezes de crianças saudáveis amamentadas, enquanto os lactentes alimentados com leite infantil são frequentemente colonizados por B. adolescentis. Destas subespécies, B. infantis tem o maior repertório de genes para digerir todas as estruturas HMO no leite humano [7]. O leite materno também influencia a composição da microbiota do lactente através de fatores imunitários, tais como compostos antimicrobianos (lactoferrina e lisozima) e efetores imunitários (IgAs, células imunitárias e citocinas), que são essenciais para a exclusão imunitária de microrganismos patogénicos [1]. É de notar que, em comparação com os lactentes amamentados, a menor abundância de Bifidobacterium observada em lactentes alimentados com leite infantil está associada a concentrações mais baixas de lactato e IgAs e a um pH mais elevado no lúmen intestinal.
Para além do modo de parto e da alimentação do lactente, outros fatores como o tabagismo materno, o índice de massa corporal, a diabetes gestacional, a asma familiar e o stress podem influenciar a microbiota no início da vida [8]. Os mecanismos subjacentes às associações entre estes fatores e a microbiota do lactente ainda não são claros, mas envolvem provavelmente alterações no microbiota materno e a subsequente transmissão vertical à criança, bem como o aumento do risco de cesariana e as famílias mais baixas de sucesso do aleitamento materno associadas a muitos destes fatores. Em geral, os efeitos individuais de fatores como o modo de parto, a utilização de antibióticos e o aleitamento materno estão relativamente bem caracterizados. No entanto, os efeitos combinados destas exposições continuam a ser mal compreendidos.
A criança foi colonizada in utero?
- Foi detetado ADN microbiano na placenta, no líquido amniótico e no mecónio, o que sugere a existência de colonização in utero.
- A impossibilidade de cultivar microrganismos detetados no útero, o efeito constante do modo de parto na microbiota e a geração bem-sucedida de animais axénicos a partir de embriões levaram ao consenso atual de que a colonização microbiana em recém-nascidos saudáveis começa no nascimento [15].
DISBIOSE NO INÍCIO DA VIDA: UMA CAUSA DE DOENÇAS NÃO TRANSMISSÍVEIS
A microbiota no início da vida é um ecossistema jovem e é, por isso, menos resiliente por natureza. A resiliência ecológica é a capacidade de um ecossistema regressar ao seu estado original após uma perturbação. A microbiota de um lactente corre, portanto, um risco maior de ter a sua trajetória permanentemente alterada numa fase crítica do desenvolvimento. A utilização peri e pós-natal de antibióticos induz alterações radicais na composição e diversidade da microbiota do lactente, conhecidas como “disbiose”, reduzindo a abundância de bifidobactérias e a diversidade global da microbiota e aumentando as espécies patogénicas. Este efeito é observado mesmo quando os antibióticos são administrados apenas às mães durante o parto vaginal (para prevenir infeções estreptocócicas B) e aumenta quando são administrados aos lactentes durante o primeiro ano de vida, seguindo uma relação dose-resposta [9]. É de notar que mesmo um único ciclo de amoxicilina administrado a lactentes reduziu a abundância de bifidobactérias durante vários meses, demonstrando a sensibilidade deste importante grupo de bactérias a estes medicamentos de uso comum [10].
A exposição a antibióticos durante a gestação ou antes do desmame em roedores pode agravar as respostas imunitárias alérgicas (IgE, linfócitos Th2 e Th17), a adiposidade e a obesidade, as respostas autoimunes e a colite crónica [1]. Estas respostas sistémicas à disbiose no início da vida são consistentes com dados epidemiológicos consistentes que associam o uso de antibióticos no início da vida a várias doenças não transmissíveis. Por exemplo, uma revisão sistemática e meta-análise de 13 estudos identificou uma associação dose-resposta entre o uso de antibióticos e a obesidade, com um risco acrescido que varia entre 11% para lactentes que recebem uma única dose e 24% quando é administrado mais do que um tratamento [9]. Mais recentemente, uma revisão sistemática e uma meta-análise de 160 estudos que envolveram mais de 22 milhões de crianças encontraram associações significativas entre a utilização de antibióticos em crianças e a dermatite atópica, a alergia alimentar, a rinoconjuntivite alérgica, a asma, a artrite juvenil, a psoríase e as perturbações do espetro do autismo [11].
A direccionalidade e a causalidade são muito difíceis de estabelecer a partir de estudos epidemiológicos. No entanto, os resultados combinados de estudos pré-clínicos e as associações dose-resposta estabelecidas entre a utilização de antibióticos e a asma e a obesidade, em particular, argumentam a favor de medidas mais rigorosas para a utilização correta de antibióticos. Um estudo recente de crianças canadianas relatou um declínio na incidência de asma que foi paralelo à queda nas prescrições de antibióticos a nível da população entre 2000 e 2014. É importante referir que a composição da microbiota no primeiro ano de vida desempenhou um papel na associação entre a exposição a antibióticos e o diagnóstico de asma aos 5 anos de idade [12]. Este importante estudo fornece fortes evidências de uma relação causal entre a utilização de antibióticos e a asma em seres humanos, e demonstra a necessidade de uma utilização prudente de antibióticos para reduzir a incidência de asma.
RESTABELECER A DISBIOSE: EM QUE PONTO ESTAMOS?
As consequências deletérias da disbiose no início da vida merecem mais estudo, mas também ação. Reduzir o uso de cesarianas, de leite infantil e de antibióticos é um objetivo louvável, mas o seu potencial de sucesso é limitado tendo em conta as necessidades da sociedade. Foram experimentadas várias estratégias para restaurar a microbiota, com resultados mistos. Foram testados dois métodos para restaurar o ecossistema em cesarianas programadas: a sementeira vaginal e o transplante de microbiota fecal (TMF). A sementeira vaginal consiste em impregnar a pele e/ ou a cavidade oral de um recém-nascido com as secreções vaginais da mãe. Os três ensaios atualmente publicados sobre a sementeira vaginal mostraram que este método não restaura a microbiota após a cesariana para se assemelhar à microbiota após o parto vaginal [8]. Em contraste, o TMF mãe-lactente (administrado durante a primeira mamada) foi suficiente para corrigir a microbiota após a cesariana [13]. No entanto, embora os autores tenham testado as amostras utilizadas para deteção de agentes patogénicos, esta prática controversa acarreta um risco infecioso significativo e desnecessário para um recém-nascido saudável, e é pouco provável que se torne uma opção viável.
O uso de pré e probióticos pode ser uma abordagem mais prática e viável para restaurar a microbiota, particularmente à luz dos estudos resumidos acima. Um estudo recente mostrou que a depleção de bifidobactérias e genes que utilizam HMO poderia ser melhorada através da combinação da administração de uma estirpe de B. infantis com a amamentação [14]. Esta estratégia também atenuou as respostas pró-inflamatórias indutoras de alergia ao fim de um ano, mostrando mecanismos imunitários benéficos a longo prazo. No entanto, não há provas suficientes de que as atuais estratégias de restauração da microbiota sejam capazes de travar as famílias alarmantes de MNT pediátricas.
CONCLUSÃO
A microbiota no início da vida é parte integrante da saúde infantil. O nosso conhecimento sobre os perfis composicionais e funcionais da colonização microbiana precoce, bem como sobre os fatores que apoiam ou perturbam esses perfis, aumentou consideravelmente. No entanto, os mecanismos que explicam a forma como a disbiose contribui para a patogénese da doença são mal compreendidos. Medidas de base ecológica para reconstituir espécies-chave da microbiota infantil, perdidas devido à utilização de antibióticos, ao parto por cesariana ou ao consumo de leite infantil, bem como os seus substratos nutricionais, poderiam revelar-se eficazes. No entanto, as estratégias atuais para restaurar a microbiota são insuficientes e ainda não demonstraram a sua eficácia na redução do risco de doenças não transmissíveis (MNT). Este é o próximo passo crucial para mudar a política e a prática médica.
1. Laforest-Lapointe I, Arrieta MC. Patterns of Early-Life Gut Microbial Colonization during Human Immune Development: An Ecological Perspective. Front Immunol 2017; 8: 788.
2. Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 2011; 469: 543-7.
3. Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 2005; 307: 1955-9.
4. Telesford KM, Yan W, Ochoa-Reparaz J, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes 2015; 6: 234-42.
5. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118: 511-21.
6. Thurl S, Munzert M, Boehm G, et al. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev 2017; 75: 920-33.
7. Underwood MA, German JB, Lebrilla CB, et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res 2015; 77: 229-35.
8. Korpela K, de Vos WM. Infant gut microbiota restoration: state of the art. Gut Microbes 2022; 14: 2118811.
9. Mc- Donnell L, Gilkes A, Ashworth M, et al. Association between antibiotics and gut microbiome dysbiosis in children: systematic review and meta-analysis. Gut Microbes 2021; 13: 1-18.
10. Korpela K, Salonen A, Saxen H, et al. Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatr Res 2020; 88: 438-43.
11. Duong QA, Pittet LF, Curtis N, et al. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. J Infect 2022; 85: 213-300.
12. Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med 2020; 8: 1094-105.
13. Korpela K, Helve O, Kolho KL, et al. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell 2020; 183: 324-34.e5.
14. Henrick BM, Rodriguez L, Lakshmikanth T, et al. Bifidobacteria-mediated immune system imprinting early in life. Cell 2021; 184: 3884-98.e11.
15. Perez-Muñoz ME, Arrieta MC, Ramer-Tait AE, et al. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome 2017; 5: 48.