ПРОИЗВОДСИВО ГИСТАМИНА МИКРОБИОТОЙ КИШЕЧНИКА ВЫЗЫВАЕТ ВИСЦЕРАЛЬНУЮ ГИПЕРАЛГЕЗИЮ ПОСРЕДСТВОМ СИГНАЛЬНОГО ПУТИ РЕЦЕПТОРА ГИСТАМИНА 4 У МЫШЕЙ
КОММЕНТАРИИ К СТАТЬЕ РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Об этой статье
Автор
52% 1 из 2 человек, страдавших расстройством пищеварения, связанным с микробиотой, был осведомлен о наличии этой связи
Comment on the article by De Palma et al. Science Translational Medicine 2022 [1]
Кишечная микробиота связана с хроническими болевыми расстройствами, такими как синдром раздраженного кишечника (СРК), однако конкретные патофизиологические механизмы такой связи остаются неясными. Авторы статьи сообщают, что снижение потребления ферментируемых углеводов уменьшало боль в животе у пациентов с СРК, что сопровождалось изменениями микробиоты кишечника и снижением концентрации гистамина в моче. Для изучения роли кишечных бактерий и нейроактивного медиатора гистамина в висцеральной гиперчувствительности использовали микробиологически стерильных мышей, которых колонизировали фекальной микробиотой от пациентов с СРК. У микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК, у которых был высокий уровень гистамина в моче, развилась висцеральная гипералгезия наряду с активацией тучных клеток. Когда эти мыши получали рацион с уменьшенным содержанием ферментируемых углеводов, у них отмечалось снижение висцеральной гиперчувствительности и накопления тучных клеток в толстой кишке. Авторы установили, что фекальная микробиота от пациентов с СРК с высоким содержанием гистамина в моче продуцировала большое количество гистамина in vitro. Был идентифицирован штамм Klebsiella aerogenes, несущий вариант гена гистидиндекарбоксилазы, основного производителя этого гистамина. Этот бактериальный штамм был очень распространен в фекальной микробиоте трех независимых когорт пациентов с СРК по сравнению со здоровыми добровольцами. Фармакологическая блокада рецептора гистамина Н4 in vivo ингибировала висцеральную гиперчувствительность и уменьшала накопление тучных клеток в толстой кишке микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина. Эти результаты предполагают, что терапевтические стратегии, направленные против бактериального гистамина, могут помочь в лечении висцеральной гипералгезии у части пациентов с СРК с хронической болью в животе.
ЧТО МЫ УЖЕ ЗНАЕМ?
Микробиота кишечника участвует в патофизиологии некоторых хронических болевых расстройств, включаяболь при синдроме раздраженного кишечника (СРК) и фибромиалгии [2]. В основу этого предположения легли результаты исследований, сообщающие о связи между выраженностью боли и изменениями в составе микробиоты кишечника, различиями болевых порогов у обычных мышей и мышей, организм которых не содержит микроорганизмов, подвергнутых бактериальной колонизации, и способности бактерий продуцировать нейроактивные метаболиты in vitro [3]. Еще не удалось получить данные, убедительно доказывающие существование причинноследственной связи, установить механизмы висцеральной боли, обусловленной микробиотой кишечника, или выявить конкретные связанные с этим виды бактерий. Авторы ранее сообщали об уменьшении боли в животе у пациентов с СРК после ограничения потребления ферментируемых углеводов. Э т о улучшение ассоциировалось с изменениями профилей микробиоты кишечника и более низким содержанием в моче гистамина [2], известного медиатора, связанного с висцеральной гиперчувствительностью [4]. В этой статье авторы исследовали ф у н к ц и и м и к р о б и о т ы к и ш е ч н и к а , вызывающие выработку гистамина и висцеральную гиперчувствительность, на микробиологически стерильных мышах, которых колонизировали фекальной микробиотой пациентов с СРК или здоровых людей.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Микробиота кишечника вовлечена в патофизиологию хронической боли у пациентов с СРК
- На фоне диеты, богатой ферментируемыми углеводами, некоторые бактерии в микробиоте, включая Klebsiella aerogenes, способствуют выработке гистамина
- Гистамин, продуцируемый микробиотой, играет роль в развитии висцеральной гиперчувствительности, стимулируя рекрутинг тучных клеток путем активации рецептора H4.
- Фармакологическая блокада рецептора гистамина Н4 in vivo ингибирует висцеральную гиперчувствительность и уменьшает накопление тучных клеток в толстой кишке микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина. Эти результаты предполагают, что терапевтические стратегии, направленные против бактериального гистамина, могут помочь в лечении висцеральной гипералгезии у части пациентов с СРК с хронической болью в животе.
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
Впервые была отмечена положительная корреляция между выраженностью висцеральной боли и концентрацией гистамина в моче в когорте пациентов с СРК.
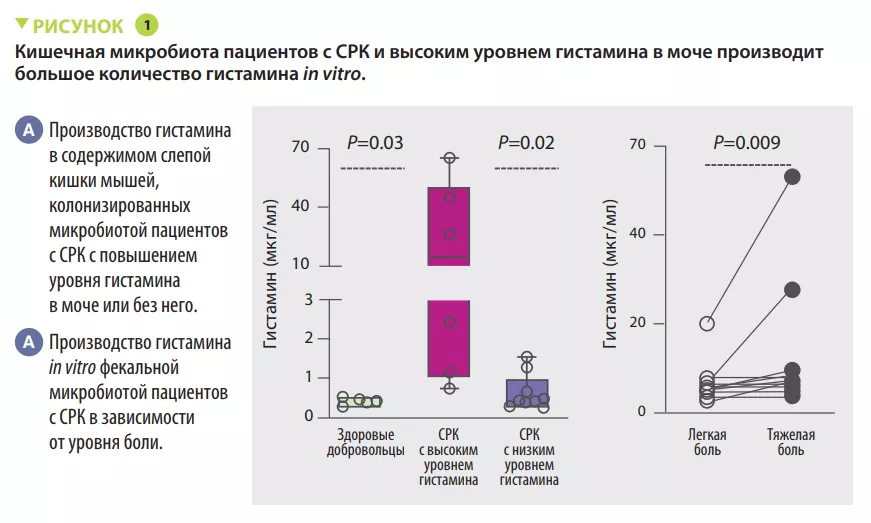
Висцеральная гиперчувствительность и механическая чувствительность кишечника, оцениваемые по изменению потенциала действия в афферентных нервах толстой кишки, были выше у микробиологически стерильных мышей, колонизированных ЗАКЛЮЧЕНИЕ Микробиота кишечника вовлечена в патофизиологию висцеральной боли у пациентов с СРК. У некоторых пациентов она связана с производством гистамина на фоне диеты, богатой ферментируемыми углеводами. Нацеленное воздействие на гистаминпродуцирующие бактерии или блокада рецептора H4 может стать действенной терапевтической стратегией для таких пациентов. фекальной микробиотой пациентов с СРК с более высоким уровнем гистамина в моче по сравнению с мышами, колонизированными микробиотой от пациентов с СРК с низким уровнем гистамина в моче. Было показано, что микробиота отвечает за выработку гистамина у пациентов с СРК с высоким уровнем этого метаболита в моче (рисунок 1). Кроме того, диета с низким содержанием ферментируемых углеводов снижала гистамин-опосредованную висцеральную гиперчувствительность.
С помощью методов культуромики удалось идентифицировать бактерии рода Klebsiella в качестве основного продуцента гистамина у пациентов с СРК с повышенным уровнем этого соединения в моче.
В отличие от здоровых добровольцев, у пациентов с СРК отмечались более высокое преобладание K. aerogenes и более высокая относительная распространенность гена гистидиндекарбоксилазы (hdc), ответственной за выработку гистамина. С механических позиций, гистамин, продуцируемый K. aerogenes, участвует в рекрутинге тучных клеток, влияя на болевой фенотип у мышей. Экспрессия H4 R (гистаминовый рецептор 4) была повышена в толстой кишке мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина в моче. Блокада H4R in vitro блокировала хемотаксис тучных клеток. Наконец, блокада H4 R in vivo снижала висцерально-моторные реакции на растяжение колоректального сегмента у мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина в моче.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Исследование показывает, что производство гистамина некоторыми бактериями в микробиоте кишечника оказывает особое влияние на болевые симптомы у части пациентов с СРК, потребляющих большое количество ферментируемых углеводов. Можно предположить, что вздутие кишечника, связанное с выработкой газа, не является основным ноцицептивным триггером у этих пациентов. Идентификация K. aerogenes или других гистаминпродуцирующих бактерий может помочь в разработке диетических рекомендаций и методов лечения, нацеленных на микробиоту, или использование антагонистов рецепторов H4 в этой подгруппе пациентов с СРК.
ЗАКЛЮЧЕНИЕ
Микробиота кишечника вовлечена в патофизиологию висцеральной боли у пациентов с СРК. У некоторых пациентов она связана с производством гистамина на фоне диеты, богатой ферментируемыми углеводами. Нацеленное воздействие на гистаминпродуцирующие бактерии или блокада рецептора H4 может стать действенной терапевтической стратегией для таких пациентов.
1. De Palma G, Shimbori C, Reed DE, et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice. Sci Transl Med 2022 ; 14 : eabj1895.
2. McIntosh K, Reed DE, Schneider T, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: A randomised controlled trial. Gut 2017 ; 66 : 1241-51.
3. Lyte M. Microbial endocrinology: Host-microbiota neuroendocrine interactions influencing brain and behavior. Gut Microbes 2014 ; 5 : 381–9.
4. Cenac N, Andrews CN, Holzhausen M, et al. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest 2007 ; 117 : 636-47.