La production d’histamine par le microbiote intestinal induit une hyperalgésie viscérale par le biais du récepteur 4 de l’histamine chez la souris
ARTICLE COMMENTÉ - RUBRIQUE ADULTE
Par le Pr Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
52% Seule 1 personne sur 2 ayant souffert d’une pathologie digestive impliquant le microbiote fait le lien
Commentaire de l’article de De Palma et al. (Science Translational Medicine 2022) [1]
Le microbiote intestinal a été impliqué dans la douleur chronique, y compris au cours du syndrome de l’intestin irritable (SII), mais les mécanismes physiopathologiques spécifiques restent flous. Dans cet article, les auteurs ont montré que la diminution de l’apport en glucides fermentescibles améliorait la douleur abdominale chez les patients atteints du SII, ce qui s’accompagnait de modifications du microbiote intestinal et d’une diminution de s concentrations urinaires d’histamine. Le rôle des bactéries intestinales et du médiateur neuroactif histamine dans l’hypersensibilité viscérale a ensuite été étudié grâce à des souris axéniques colonisées par le microbiote fécal de patients atteints de SII. Les souris axéniques colonisées avec le microbiote fécal de patients atteints de SII qui présentaient une histamine urinaire élevée) développent une hyperalgie viscérale et une activation des mastocytes. Lorsque ces souris ont été nourries avec un régime contenant une quantité réduite de glucides fermentescibles, les animaux ont montré une diminution de l’hypersensibilité viscérale et de l’accumulation de mastocytes dans le côlon. Les auteurs ont ensuite observé que le microbiote fécal de patients atteints de SII avec des taux d’histamine urinaire élevée produisait de grandes quantités d’histamine in vitro. Les auteurs ont identifié Klebsiella aerogenes, portant une variante du gène de l’histidine décarboxylase, comme producteur majeur de cette histamine. Cette souche bactérienne était très abondante dans le microbiote fécal de de patients atteints de SII issus de trois cohortes indépendantes par rapport aux individus sains. Le blocage pharmacologique du récepteur 4 de l’histamine in vivo permettait d’inhiber l’hypersensibilité viscérale et de diminuer l’accumulation de mastocytes dans le côlon des souris axéniquescolonisées par le microbiote fécal de patients SII produisant beaucoup d’histamine. Ces résultats suggèrent que des stratégies thérapeutiques dirigées contre l’histamine bactérienne pourraient aider à traiter l’hyperalgésie viscérale chez un sous-groupe de patients atteints de SII avec douleurs abdominales chroniques.
QUE SAIT-ON DÉJÀ À CE SUJET ?
Le microbiote intestinal a été impliqué dans la physiopathologie de certains troubles douloureux chroniques, notamment la douleur associée au syndrome de l’intestin irritable (SII) et à la fibromyalgie [2]. Cette hypothèse repose en grande partie sur des études montrant une association entre le niveau de douleur et les altérations de composition du microbiote intestinal, sur les différences de seuils de douleur entre des souris élevées de manière conventionnelle et des souris axéniques, qui se normalisent après la colonisation bactérienne, ou sur la capacité des bactéries à produire des métabolites neuroactifs in vitro [3]. Cependant, les données démontrant un lien de causalité et les mécanismes précis qui sous-tendent la douleur viscérale induite par le microbiote intestinal, ainsi que l’identification des espèces bactériennes spécifiques impliquées, font défaut. Les auteurs de cert article ont précédemment rapporté que la douleur abdominale chez les patients atteints de SII s’améliorait après une restriction des apports alimentaires en glucides fermentescibles. Cette amélioration était associée à des changements dans les profils du microbiote intestinal et à des concentrations plus faibles d’histamine urinaire [2], un médiateur connu impliqué dans l’hypersensibilité viscérale [4]. Dans le présent article, les auteurs ont étudié les fonctions du microbiote intestinal qui déclenchent la production d’histamine et l’hypersensibilité viscérale en utilisant des souris axéniques colonisées par le microbiote fécal de patients atteints de SII ou d’individus sains.
POINTS CLÉS
- Le microbiote intestinal est impliqué dans la douleur chronique au cours du SII
- Dans le cadre d’un régime riche en glucides fermentescibles, certaines bactéries du microbiote, dont Klebsiella aerogenes, contribuent à la production d’histamine
- L’histamine produite par le microbiote joue un rôle dans l’hypersensibilité viscérale en favorisant le recrutement de mastocytes, via l’activation du récepteur H4
- Le blocage pharmacologique du récepteur 4 de l’histamine in vivo permet d’inhiber l’hypersensibilité viscérale et de diminuer l’accumulation de mastocytes dans le côlon des souris axéniques colonisées par le microbiote fécal de patients SII produisant beaucoup d’histamine. Ces résultats suggèrent que des stratégies thérapeutiques dirigées contre l’histamine bactérienne pourraient aider à traiter l’hyperalgésie viscérale chez un sous-groupe de patients atteints de SII avec douleurs abdominales chroniques
QUELS SONT LES PRINCIPAUX RÉSULTATS APPORTÉS PAR CETTE ÉTUDE ?
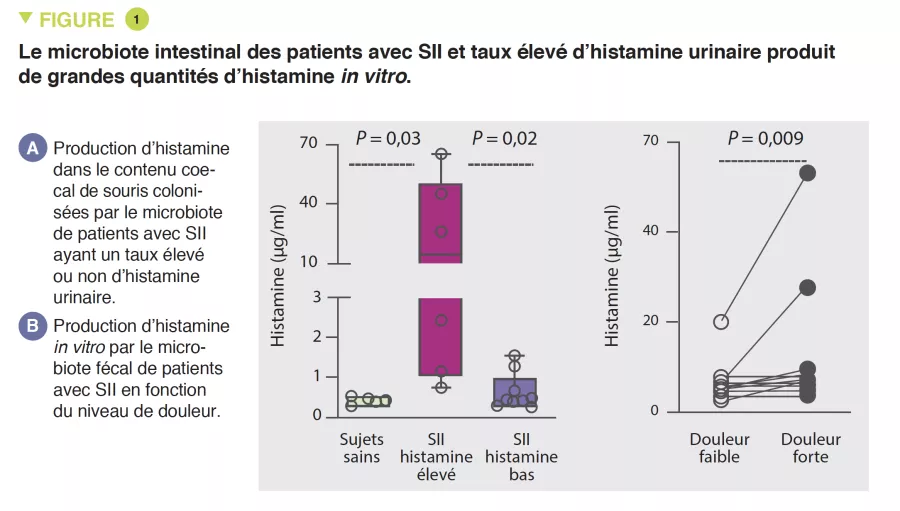
Une corrélation positive était d’abord observée entre la sévérité de la douleur viscérale et la concentration urinaire d’histamine dans une cohorte de patients avec SII.
L’hypersensibilité viscérale et la mécanosensibilité intestinale, évaluée par la mesure du potentiel d’action dans les nerfs afférents du côlon, était plus élevée chez les souris axéniques colonisées avec le microbiote fécal de patients avec SII ayant un taux d’histamine urinaire élevé par rapport celles colonisées par un microbiote associé à un taux d’histamine urinaire faible. Le microbiote était bien responsable de la production d’histamine chez les patients avec SII et niveau urinaire élevé de ce métabolite (Figure 1). De plus, un régime pauvre en glucides fermentescibles réduisait l’hypersensibilité viscérale médiée par l’histamine.
En utilisant une approche de culturomique, la bactérie Klebsiella a ensuite été identifiée comme la productrice principale d’histamine chez les patients avec SII et dont le niveau urinaire de cette molécule était élevé.
Par rapport aux sujets sains, les patients avec SII avaient une prévalence plus élevée de K. aerogenes et une abondance relative plus élevée du gène histidine decarboxylase (hdc) qui est responsable de la production d’histamine. D’un point de vue mécanistique, l’histamine produite par K. aerogenes était impliquée dans le recrutement des mastocytes, jouant un rôle dans le phénotype douloureux chez la souris. L’expression de H4R (récepteur 4 de l’histamine) était augmentée dans le côlon de souris colonisées par le microbiote fécal de patients atteints de SII présentant des taux élevés d’histamine urinaire. In vitro, le blocage de H4R bloquait le chimiotactisme des mastocytes. Finalement, in vivo, le blocage de H4R réduisait les réponses viscéro-motrices à la distension colorectale des souris colonisées avec le microbiote fécal de patients avec SII ayant un taux d’histamine urinaire élevé.
QUELLES SONT LES CONSÉQUENCES EN PRATIQUE ?
Cette étude démontre le rôle spécifique de la production d’histamine par certaines bactéries du microbiote intestinal dans les symptômes douloureux d’un sous-groupe de patients avec SII, dans le contexte d’un régime riche en glucides fermentescibles. Cela suggère que la distension intestinale liée à la production de gaz n’est pas le principal déclencheur nociceptif chez ces patients. L’identification de K. aerogenes, ou d’autres bactéries sources d’histamine, pourrait guider des recommandations diététiques, les thérapies ciblant le microbiote ou l’utilisation d’antagonistes des récepteurs H4 chez un sous-groupe de patients avec SII.
Conclusion
Le microbiote est impliqué dans la douleur viscérale au cours du SII. Chez un sous-groupe de patients, cela est lié à la production d’histamine dans le cadre d’un régime riche en glucides fermentescibles. Cibler les bactéries productrices d’histamine ou bloquer le récepteur H4 pourrait être une stratégie thérapeutique chez ces patients.
1. De Palma G, Shimbori C, Reed DE, et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice. Sci Transl Med 2022 ; 14 : eabj1895.
2. McIntosh K, Reed DE, Schneider T, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: A randomised controlled trial. Gut 2017 ; 66 : 1241-51.
3. Lyte M. Microbial endocrinology: Host-microbiota neuroendocrine interactions influencing brain and behavior. Gut Microbes 2014 ; 5 : 381–9.
4. Cenac N, Andrews CN, Holzhausen M, et al. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest 2007 ; 117 : 636-47.