Parkinson : découverte et inhibition du métabolisme de la lévodopa par les bactéries intestinales
Article commenté - Rubrique adulte
Par le Pr. Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

Levodopa (L-DOPA) Parkinson's disease drug, molecular model. L-DOPA is a precursor of the catecholamine neurotransmitters dopamine, norepinephrine and epinephrine and is used in the treatment of Parkinson's disease. Atoms are represented as wires. A map of electrostatic potential surrounds the molecule.
A propos de cet article
Auteur
Commentaire de l’article original de Rekdal et al. (Science 2019 [1])
Le microbiote intestinal humain métabolise la lévodopa (L-dopa), médicament utilisé pour le traitement de la maladie de Parkinson, réduisant potentiellement la disponibilité du médicament et provoquant des effets indésirables. Cependant, les micro-organismes, gènes et enzymes responsables de cette activité chez les patients et la sensibilité aux médicaments inhibiteurs ciblant l’hôte sont inconnus. Ici, les auteurs décrivent une voie inter-espèces pour le métabolisme de la L-dopa dans le microbiote intestinal. La conversion de la L-dopa en dopamine par une tyrosine décarboxylase dépendante du pyridoxal phosphate chez Enterococcus faecalis est suivie par la transformation de la dopamine en m-tyramine par une déshydroxylase dépendante du molybdène d’Eggerthella lenta. Ces enzymes prédisent le métabolisme des médicaments dans des microbiotes intestinaux humains complexes. Le médicament, qui cible la décarboxylase des acides aminés aromatiques de l’hôte, ne prévient pas la décarboxylation de la L-dopa par le microbiote intestinal ; mais les auteurs ont identifié un composé qui inhibe cette activité dans les microbiotes des patients atteints de maladie de Parkinson, augmentant ainsi la biodisponibilité de la L-dopa dans un modèle murin.
Que sait-on déjà à ce sujet ?
La maladie de Parkinson est une maladie neurologique invalidante affectant plus de 1 % de la population mondiale âgée de plus de 60 ans. Le principal médicament utilisé pour traiter la maladie de Parkinson est la lévodopa (L-dopa) [2]. Pour être efficace, la L-dopa doit pénétrer dans le cerveau et être convertie en dopamine (neurotransmetteur) par une enzyme humaine, la décarboxylase des acides aminés aromatiques (AADC). Cependant, le tractus gastro-intestinal est également un site majeur pour la décarboxylation de la L-dopa, et ce métabolisme est problématique car la dopamine générée en périphérie ne peut pas traverser la barrière hémato-encéphalique et provoque des effets secondaires indésirables. Ainsi, la L-dopa est co-administrée avec des médicaments qui bloquent son métabolisme périphérique, y compris le carbidopa, qui est un inhibiteur de l’AADC. Même avec ces médicaments, jusqu’à 56 % de la L-dopa ne parvient pas au cerveau. En outre, l’efficacité et les effets secondaires du traitement par L-dopa sont extrêmement hétérogènes chez les patients atteints de Parkinson, et cette variabilité ne peut être complètement expliquée par les différences de métabolisme de l’hôte. Des études antérieures chez l’homme et sur modèles animaux ont démontré que le microbiote intestinal peut métaboliser la L-dopa [3]. La principale voie proposée implique une décarboxylation initiale de la L-dopa en dopamine, suivie par la conversion de la dopamine en m-tyramine par une réaction de déshydroxylation.
Bien que ces activités métaboliques se soient produites dans des échantillons de microbiote intestinal, les organismes spécifiques, les gènes et les enzymes responsables restent inconnus. Les effets des inhibiteurs ciblant l’hôte, comme la carbidopa, sur le métabolisme microbien intestinal de la L-dopa ne sont pas clairs non plus. Pour faire un premier pas vers la compréhension du rôle du microbiote intestinal dans le traitement de la maladie de Parkinson, les auteurs ont cherché à élucider les bases moléculaires du métabolisme microbien intestinal de la L-dopa et de la dopamine.
Points clés
-
Certaines bactéries du micro- biote intestinal peuvent méta- boliser la L-dopa en dopamine puis en m-tyramine, limitant la disponibilité de la L-dopa au cerveau
-
Le microbiote joue un rôle dans l’efficacité et la toxicité de la L-dopa pour le traitement de la maladie de Parkinson
-
L’utilisation d’un inhibiteur spé- cifique du métabolisme bactérien de la L-dopa peut permettre d’augmenter la biodisponibilité de la L-dopa, et donc d’augmenter son efficacité
Quels sont les principaux résultats apportés par cette étude ?
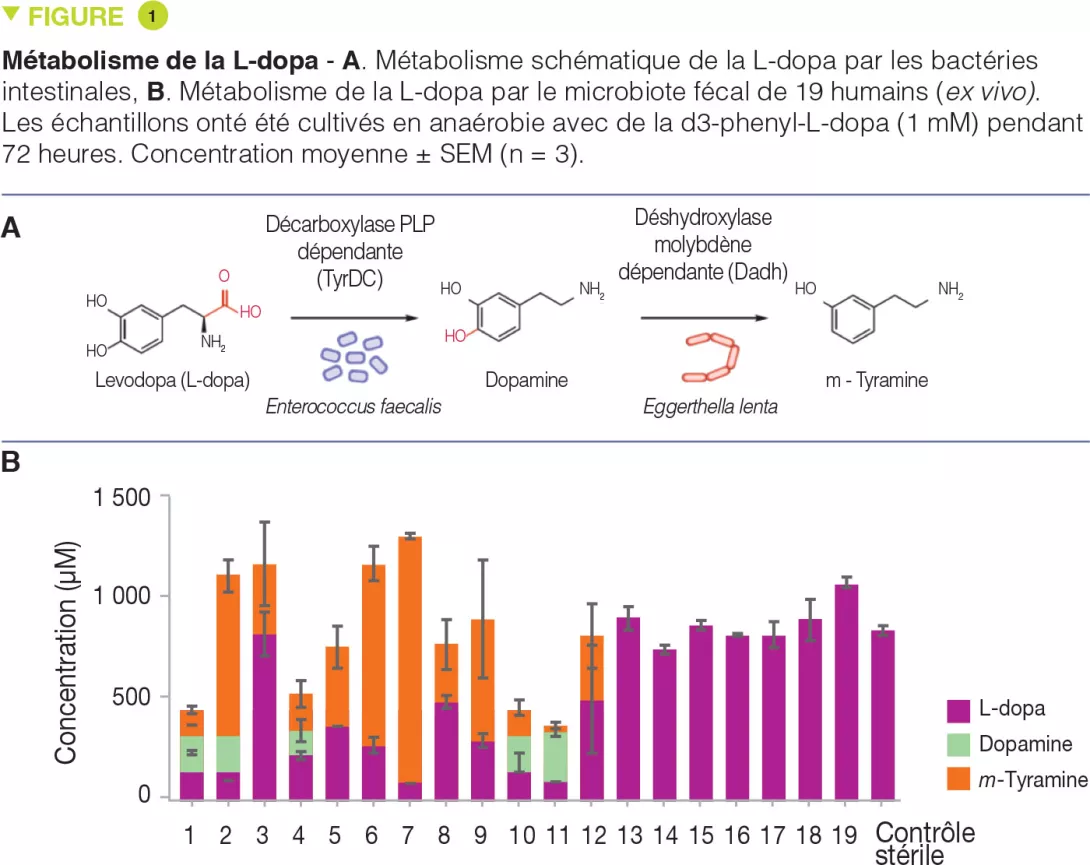
Les auteurs ont émis l’hypothèse que la décarboxylation de la L-dopa nécessiterait une enzyme dépendante du pyridoxal phosphate (PLP). Ils ont analysé les génomes de bactéries intestinales et identifié une tyrosine décarboxylase conservée (TyrDC) dans Enterococcus faecalis (Figure 1A). Des expériences génétiques et biochimiques ont révélé que TyrDC décarboxyle simultanément la L-dopa et son substrat préféré, la tyrosine. Ensuite, ils ont utilisé des méthodes d’enrichissement pour isoler une souche d’Eggerthella lenta capable de déhydroxyler la dopamine (Figure 1A). Une analyse transcriptomique a permis d’identifier que l’enzyme responsable de cette activité est une déshydroxylase dépendante du molybdène (Dadh). De façon inattendue, la présence de cette enzyme dans le microbiote intestinal n’est pas corrélée avec le métabolisme de la dopamine. C’est en fait un polymorphisme génétique sur un nucléotide (SNP) dans le gène Dadh qui prédit l’activité. La capacité à métaboliser la L-dopa selon cette voie était variable d’un sujet à l’autre (Figure 1B). Dans le microbiote intestinal des patients atteints de Parkinson, l’abondance d’E. faecalis, de tyrDC, et du SNP de Dadh est corrélée avec le métabolisme de la L-dopa et de la dopamine, ce qui confirme leur pertinence. Les auteurs ont ensuite montré que la carbidopa, qui inhibe l’AADC humain, n’avait un effet que minime sur la décarboxylation de la L-dopa par E. faecalis, et un effet nul sur le microbiote intestinal complexe de patients, ce qui suggère que ce médicament ne peut probablement pas empêcher le métabolisme microbien de la L-dopa in vivo. Etant donné la préférence de TyrDC pour la tyrosine, les auteurs ont recherché des molécules « imitant » la tyrosine. Ils ont identifié la (S)-α-fluorométhyltyrosine (AFMT) comme inhibiteur sélectif de la décarboxylation bactérienne intestinale de la L-dopa. L’AFMT, co-administrée avec la L-dopa et la carbidopa à des souris colonisées avec E. faecalis, permettait d’augmenter la concentration sérique de L-dopa.
Quelles sont les conséquences en pratique ?
Ces résultats démontrent que le microbiote intestinal est un acteur du métabolisme de la L-dopa et qu’il peut jouer un rôle dans son efficacité et sa toxicité. Cette étude ouvre la voie vers la mise au point de biomarqueurs prédictifs de l’efficacité et de la toxicité de la L-dopa. D’autre part, étant donné que les mécanismes moléculaires sont élucidés, l’utilisation d’inhibiteurs spécifiques du métabolisme de la L-dopa par le microbiote intestinal est envisageable chez les patients porteurs des activités bactériennes délétères dans leur microbiote.
Conclusion
Chez certains patients, le microbiote intestinal peut métaboliser la L-dopa. Cela joue possiblement un rôle dans l’hétérogénéité de l’efficacité et de la toxicité de ce traitement de la maladie de Parkinson. L’utilisation d’inhibiteurs de ce métabolisme bactérien pourrait être une solution. Plus globalement, cette étude est une nouvelle preuve du rôle du microbiote intestinal dans la pharmacocinétique et la pharmacodynamie des médicaments. Elle ouvre des perspectives prometteuses pour le nouveau champ que l’on pourrait appeler la « pharmacomicrobiomique ».






