Microbiote et maladies métaboliques
Synthèse
Par le Pr. Yolanda Sanz
Unité de recherche en Écologie microbienne, Nutrition et Santé ; Institut d’agrochimie et de technologie alimentaire ; Conseil supérieur de recherches scientifiques (IATA-CSIC), Valence, Espagne
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
Human digestive system microbiota, 3D illustration.
A propos de cet article
Auteur
En raison de sa forte prévalence et de son rôle dans le développement de multiples maladies non transmissibles (syndrome métabolique [SMet] et diabète de type 2 [DT2]), l’obésité est l’un des plus grands défis de santé publique du XXIe siècle. Les données prouvant le rôle des altérations du microbiote intestinal, en partie dues à une alimentation déséquilibrée, dans les mécanismes faisant le lien entre l’obésité, l’inflammation et les troubles métaboliques, offrent de nouvelles perspectives : elles permettent de mieux comprendre l’étiologie de la maladie et mettre au point des stratégies de prise en charge. Les pistes explorées portent notamment sur la transplantation de microbiote fécal (TMF), les aliments destinés à nourrir nos micro-organismes bénéfiques (prébiotiques) et nos bactéries indigènes (probiotiques) pour restaurer nos intestins avec les micro-organismes bénéfiques manquants. Les éléments dont on dispose sont prometteurs mais il faut encore identifier les bactéries intestinales qui aideront à prévenir l’obésité, et personnaliser les régimes alimentaires afin d’optimiser les fonctions métaboliques de nos micro-organismes intestinaux.
Obésité, syndrôme métabolique et diabète
L’obésité est une épidémie mondiale qu’aucun pays n’a su endiguer à ce jour. Depuis les années 1980, la prévalence globale de l’obésité a triplé aux États-Unis et dans de nombreux pays européens, faisant de cette maladie l’un des plus grands défis de santé publique du XXIe siècle. En effet, l’obésité est associée à des taux élevés de comorbidités, qui constituent un facteur de risque majeur de multiples maladies non transmissibles. L’insulino-résistance induite par l’obésité est considérée comme un facteur clé du SMet, entraînant souvent une défaillance des cellules β pancréatiques et conduisant au DT2 [1].
Inflammation métabolique : de l'obésité aux comorbidités chroniques
On sait aujourd’hui que l’état inflammatoire chronique associé à l’obésité affecte les tissus adipeux mais également d’autres organes notamment le cerveau, les muscles, le foie, le pancréas et l’intestin [1, 2]. L’implication du système immunitaire intestinal et les micro-organismes qui se développent en cas d’alimentation déséquilibrée sont notamment apparus récemment comme des facteurs supplémentaires de l’inflammation métabolique associée à l’obésité, et pourraient également représenter des cibles thérapeutiques [2, 3].
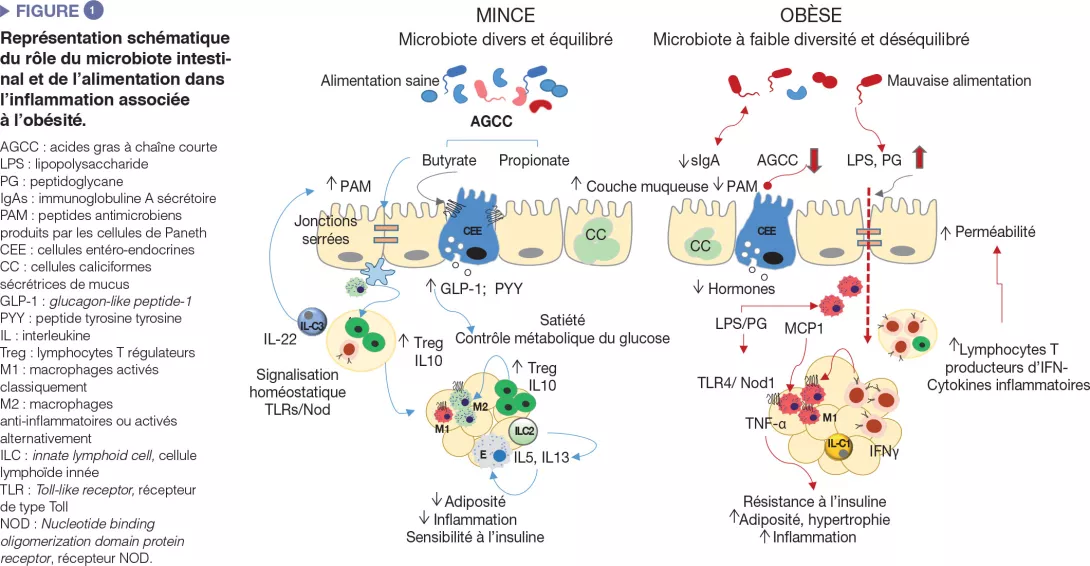
En quoi le microbiote intestinal est-il impliqué?
L’implication du microbiote intestinal dans l’obésité a été en partie déduite d’études observationnelles faisant état de dysbiose chez des sujets obèses comparativement à des sujets minces dans des évaluations transversales. Les preuves de modulations du microbiote intestinal lors d’interventions diététiques, médicamenteuses ou chirurgicales dans le but de perdre du poids et d’améliorer les complications métaboliques ont permis d’établir des relations similaires où l’obésité était associée à une réduction de la diversité des espèces et une augmentation des taxa bactériens comme Proteobacteria et Bilophila wadsworthia. En revanche, les phénotypes métaboliques sains étaient souvent associés à des augmentations du phylum Bacteroidetes ou du ratio Firmicutes/Bacteroidetes ou des genres Bacteroides, Prevotella, Akkermansia, Faecalibacterium ou Christensenella [4, 5]. Les résultats obtenus étaient cependant parfois contradictoires, en partie à cause de l’hétérogénéité des études et de leurs limites méthodologiques. D’autres méta-analyses ont montré que le seul biomarqueur qui pouvait être généralisé concernant l’obésité était la réduction de la diversité des espèces bactériennes [6]. Par ailleurs, les sujets obèses n’ont probablement pas tous le même profil dysbiotique, notamment en raison de la grande variabilité du microbiote et de la complexité des phénotypes métaboliques (obésité avec et sans autres complications). Plus récemment, les altérations du microbiote intestinal qui précèdent le développement de l’obésité ont été identifiées comme un des facteurs étiologiques. Une récente étude longitudinale a notamment montré qu’une réduction de la diversité des espèces bactériennes, liée à de mauvaises habitudes alimentaires, produit les conditions favorables à une prolifération de Proteobacteria (entérobactéries), qui précède l’apparition du surpoids chez des enfants suivis pendant 4 ans [7].
Une preuve encore plus concluante du rôle causal du microbiote dans la définition du phénotype métabolique du sujet a été obtenue grâce à la TMF, via laquelle le microbiote dysbiotique de sujets malades a été transféré à de nouveaux animaux receveurs. La plupart de ces expériences ont montré que la TMF était suffisante pour reproduire le phénotype métabolique du donneur (mince ou obèse) [8].
Le biomarqueur microbiotique le plus fréquemment associé à l'obésité est la réduction de la diversité d'espèces bactériennes, qui pourrait également prédisposer au développement de l'obésité, de l'inflammation chronique et des complications métaboliques.
Mécanismes d'action médiés par le microbiote
Les micro-organismes intestinaux influencent le métabolisme énergétique en stimulant notre capacité à métaboliser les nutriments et à extraire les calories de l’alimentation mais également en régulant l’absorption des sucres et des lipides ainsi que leur dépôt dans les tissus périphériques [8]. Les micro-organismes intestinaux et leurs produits métaboliques sont également impliqués dans la régulation du système entéro-endocrinien via, par exemple, la production d’acides gras à chaîne courte induisant la synthèse d’hormones intestinales (entre autres GLP-1, PYY) qui agissent par des voies endocriniennes et neuronales et qui régulent l’appétit, la prise alimentaire et le métabolisme du glucose [9]. Le microbiote intestinal est aussi un régulateur majeur de la barrière intestinale et du système immunitaire, dont les altérations sont impliquées dans l’inflammation de bas grade et l’insulino-résistance associées à l’obésité (Figure 1) [2, 3].
Il est probable qu'un modèle unique de dysbiose intestinale pour l'obésité ne puisse pas être identifié, celui-ci pouvant dépendre des complications métaboliques sous-jacentes et d'autres caractéristiques biologiques et environnementales du sujet.
Altérations de la fonction barrière de la muqueuse dans l'obésité
Une alimentation déséquilibrée provoque des altérations de la muqueuse intestinale qui affectent sa pénétrabilité et favorisent la translocation de composants bactériens comme le lipopolysaccharide (LPS) et le peptidoglycane, voire de micro-organismes entiers, qui peuvent activer l’immunité innée dans des organes métaboliquement actifs. Ces défauts dans la fonction barrière ont été attribués à une inflammation locale causée par une alimentation riche en graisses saturées et la dysbiose résultante, ainsi qu’à des perturbations au niveau de la couche de mucus [10] et de la production de peptides antimicrobiens par les cellules de Paneth (Reg3γ, lysozyme 1) [11]. On a par exemple démontré que des taux plasmatiques accrus de LPS (« endotoxémie métabolique ») provoquaient une obésité et des troubles métaboliques dans des modèles animaux et qu’ils étaient associés à une élévation de l’indice de masse corporelle, à une alimentation riche en graisses, à une inflammation postprandiale et à un risque de DT2 chez l’homme. Ce phénomène pourrait être favorisé par la prolifération de bactéries à Gram négatif comme les entérobactéries, qui sont une source de LPS en cas d’alimentation riche en graisses. Les LPS pourraient activer l’immunité innée dans l’intestin et au-delà induire le recrutement de cellules immunitaires inflammatoires dans les tissus métaboliques, comme les macrophages. Une alimentation riche en graisses saturées pourrait également favoriser la croissance d’autres bactéries à Gram négatif comme Bilophila wadsworthia, qui génèrent le sulfure d’hydrogène, un métabolite toxique pour les entérocytes qui conduit à une hyperperméabilité intestinale, à une inflammation et à des troubles métaboliques [12]. Enfin, une alimentation riche en graisses pourrait également augmenter les taux circulants de peptidoglycanes, probablement par le biais des modifications induites par l’alimentation au niveau de l’expression du peptide antimicrobien lysozyme 1, qui hydrolyse les composants des parois cellulaires bactériennes. En fonction du type de peptidoglycanes, ceux-ci pourraient agir comme des ligands de Nod1 au niveau des macrophages pro-inflammatoires du tissu adipeux ou du foie et provoquer une résistance à l’insuline, alors que des effets opposés semblent se produire dans les cellules bêta-pancréatiques, possiblement selon un mécanisme de compensation [13].
Dérèglement des cellules immunocompétentes intestinales dans l'obésité
Comme dans d’autres organes métaboliques, notamment le tissu adipeux et le foie, une dégradation de l’homéostasie immunitaire a été observée au niveau intestinal dans l’obésité. Lorsque l’obésité est induite par l’alimentation, divers sousgroupes de cellules de l’immunité innée et adaptative au sein de l’intestin adoptent un phénotype pro-inflammatoire, principalement démontré par une augmentation des macrophages et cytokines pro-inflammatoires (IFNγ).
En parallèle, on observe une réduction des proportions de lymphocytes Treg et d’ILC de type 3 productrices d’IL-22, qui aident à maintenir l’intégrité de la muqueuse et l’homéostasie intestinale chez les sujets minces [2, 3]. Certaines de ces altérations sont inversées par une déplétion du microbiote (par exemple par une antibiothérapie) ou par l’administration de bifidobactéries spécifiques qui restaurent également la dysbiose intestinale induite par l’alimentation dans l’obésité, ce qui confirme le rôle causal du microbiote intestinal dans l’inflammation métabolique [3]. De plus, les cellules immunitaires intestinales IgA+ agissent comme des médiateurs de la muqueuse pour la régulation glycémique systémique dans l’obésité induite par l’alimentation riche en graisses.
Ce type de régime réduit le nombre de cellules immunitaires IgA+ et d’IgA sécrétoires. La réduction des IgA pourrait venir renforcer les effets de l’alimentation riche en graisses et ajouter un niveau supplémentaire de déstabilisation de la communauté bactérienne par l’augmentation de la perméabilité intestinale et l’inflammation du tissu adipeux [14].
Comment la modulation du microbiote pourrait-elle impacter l'évolution de la maladie ?
FMT
Un essai clinique a montré que la sensibilité à l’insuline pouvait être améliorée chez des patients atteints de SMet 6 semaines après une transplantation de microbiote fécal provenant d’un donneur sain mince [5]. Une augmentation de la diversité microbienne et de l’abondance des bactéries productrices de butyrate a également été observée. Un autre essai conduit chez des sujets présentant des signes de SMet et recevant le microbiote de patients répondant à la chirurgie bariatrique a rapporté des modifications au niveau de l’expression des récepteurs dopaminergiques qui pourraient expliquer un meilleur contrôle de la prise alimentaire, mais cette étude n’a pas confirmé les effets sur la résistance à l’insuline*. De nombreux autres essais visant à évaluer les effets de la TMF sur l’obésité sont en cours, mais les résultats n’ont pas encore été publiés [5]. Les preuves scientifiques justifiant le recours à cette stratégie de lutte contre les complications de l’obésité sont donc toujours très limitées.
Une dysbiose intestinale entretenue par une alimentation déséquilibrée contribue au dérèglement du système immunitaire intestinal, qui constitue un facteur supplémentaire de l'inflammation métabolique associée à l'obésité et représente également une cible thérapeutique.
Fibres alimentaires
De nombreuses données chez l’homme montrent que la consommation d’aliments avec une teneur en fibres supérieure aux recommandations en vigueur (25 g/jour pour les adultes) améliore le maintien du poids et réduit le risque de coronaropathie et de DT2. Certains des effets de ces fibres sont dus à leurs propriétés physico-chimiques (par exemple non digestibilité, viscosité, etc.) qui contribuent à réduire les réponses glycémiques et l’apport énergétique et à améliorer le profil lipidique sanguin. D’autres effets pourraient être médiés par leur impact sur le microbiote intestinal, qui fermente les fibres et génère des métabolites tels que les AGCC (butyrate, propionate, etc.), actifs dans le métabolisme de l’hôte. Les AGCC induisent la production de peptides entéro-endocrines (GLP-1, GLP-2, PYY) qui renforcent la barrière intestinale, induisent la satiété, améliorent le métabolisme du glucose et exercent des effets anti-inflammatoires dans l’obésité. La consommation de fibres augmente également la diversité du microbiote intestinal, qui est associée à un phénotype métabolique sain. En outre, les effets bénéfiques des fibres ne dépendent pas seulement du type et de la quantité de fibres, mais également de la structure du microbiote de la personne, de sa diversité et de la présence ou de l’absence d’espèces bactériennes spécifiques impliquées dans leur utilisation [15]. Tout cela montre la nécessité de tendre vers des recommandations diététiques plus personnalisées [15].
Bactéries bénéfiques
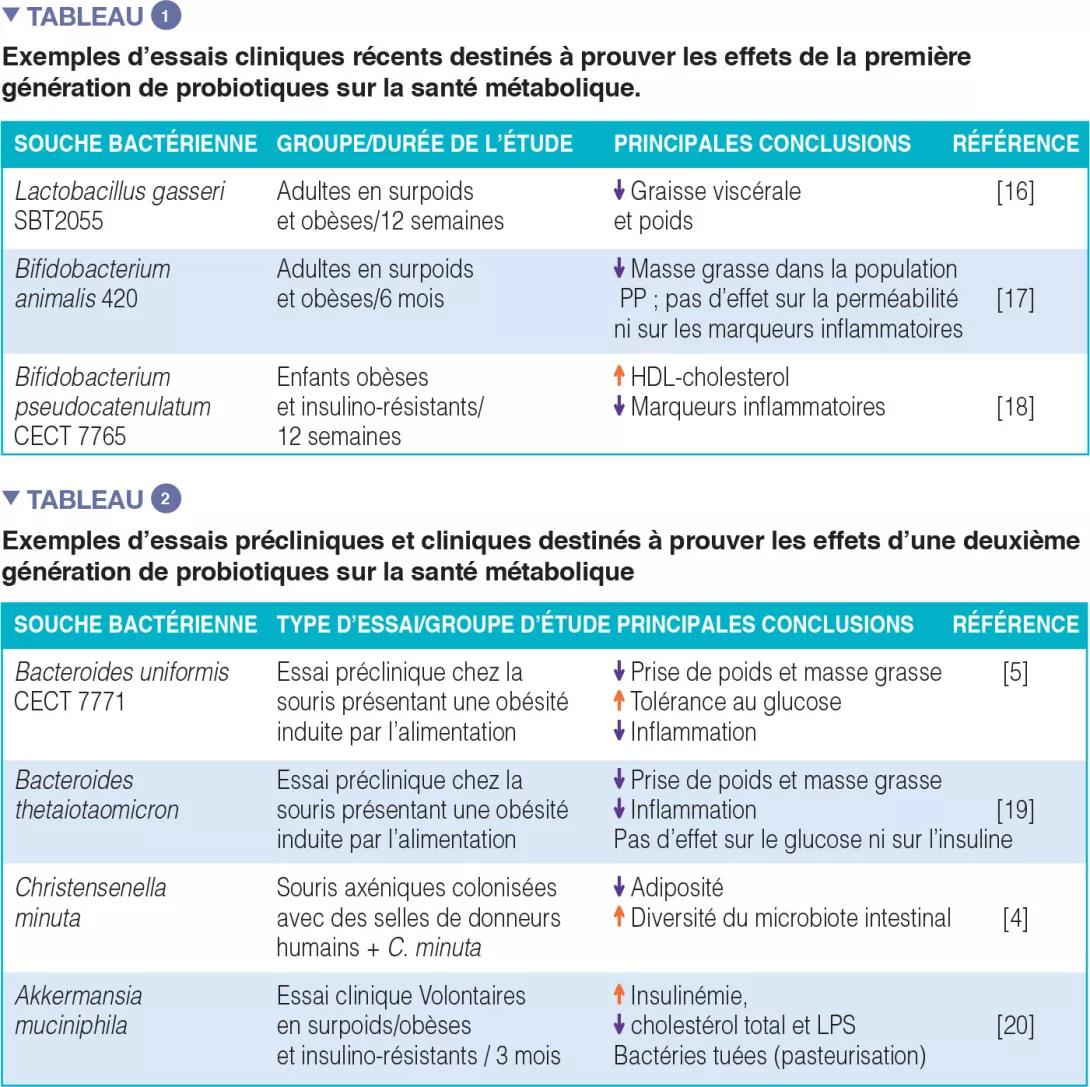
Les première et deuxième générations de probiotiques. La plupart des essais cliniques d’efficacité ont été conduits avec des souches bactériennes traditionnellement utilisées comme probiotiques chez l’homme, « la première génération de probiotiques », qui comprend essentiellement des Lactobacillus et des Bifidobacterium. Le Tableau 1 en donne quelques exemples, mais on peut en trouver bien d’autres dans la littérature, associés à des résultats positifs et négatifs. On a également tenté d’isoler, dans le microbiote indigène humain, de nouvelles espèces bactériennes systématiquement associées à un phénotype métabolique sain dans le but de créer une deuxième génération de probiotiques. Ceux-ci pourraient nous aider à apporter à notre microbiote intestinal les micro-organismes manquants. Le Tableau 2 reprend quelques-unes des études conduites chez des modèles animaux et la seule conduite chez l’homme à ce jour.
Conclusion
Des données scientifiques confirment le rôle des altérations du microbiote intestinal, en partie dues à une alimentation déséquilibrée, dans l’obésité et les troubles métaboliques. L’inflammation intestinale apparaît comme un facteur de l’inflammation systémique dans l’obésité. Ce processus est modulé par le microbiote intestinal et l’alimentation, qui constituent ensemble à la fois une cause et une cible thérapeutique. Des essais expérimentaux ont fourni la preuve du concept selon lequel un « microbiote sain », des bactéries intestinales spécifiques ou des fibres alimentaires qui potentialisent leurs fonctions pourraient jouer un rôle dans la prise en charge de l’obésité. Pour pouvoir espérer développer des solutions concrètes dans la lutte contre l’obésité, il reste encore à identifier les bactéries intestinales impliquées et personnaliser les régimes alimentaires afin d’optimiser les fonctions du microbiote intestinal au bénéfice de notre santé métabolique.