Critères cliniques et biologiques de réponse à un traitement standardisé de rectocolite chez l’enfant : une étude multicentrique prospective
Article commenté - Rubrique Enfant
Par le Pr Emmanuel Mas
Gastro-entérologie et nutrition, Hôpital des Enfants, Toulouse, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
Section of the large intestine with Ulcerative Colitis. Illustration.
A propos de cet article
Commentaire de l’article original de Hyams et al. (Lancet 2019 [1])
Du fait de l’absence de données basées sur les preuves d’efficacité thérapeutique, le choix des traitements pour les enfants chez lesquels une rectocolite hémorragique (RCH) vient d’être diagnostiquée est aléatoire. C’est pourquoi les auteurs ont fait l’hypothèse que des facteurs cliniques, transcriptomiques et microbiens pourraient prédire l’évolution de la maladie avant le traitement. Dans cette étude de cohorte initiale, ils ont recruté des patients de 4 à 17 ans atteints de RCH nouvellement diagnostiquée dans 29 centres aux États-Unis et au Canada. Les patients ont d’abord reçu de la mésalazine ou des corticoïdes selon un protocole préétabli, avec des critères d’escalade vers des immunomodulateurs (thiopurines) ou une biothérapie par anti-TNFα. Un séquençage de l’ARN a été réalisé pour définir l’expression génique rectale avant le traitement, et un séquençage 16S pour caractériser les microbiotes rectal et fécal. Le critère principal était une rémission sans corticoïde à la 52e semaine, sans autre traitement que la mésalazine.
Que sait-on déjà à ce sujet ?
Les scores cliniques, biologiques et/ou endoscopiques, tels que le PUCAI (pediatric ulcerative colitis activity index), permettent de classer la sévérité de la RCH chez l’enfant. On distingue les formes minimes (PUCAI 10-30), modérées à sévères (35-60) et sévère/fulminante (≥ 65). Les 5-aminosalycilates peuvent être efficaces dans les formes minimes, alors que les corticoïdes sont utilisés dans les formes modérées ; toutefois, un certain nombre d’enfants seront cortico-dépendants ou réfractaires et nécessiteront une escalade thérapeutique (immunomodulateurs, voire anti-TNFα).
Cependant, il n’existe pas d’étude prospective ayant évalué la réponse à un traitement standardisé lors du diagnostic de RCH.
Quels sont les principaux résultats apportés par cette étude ?
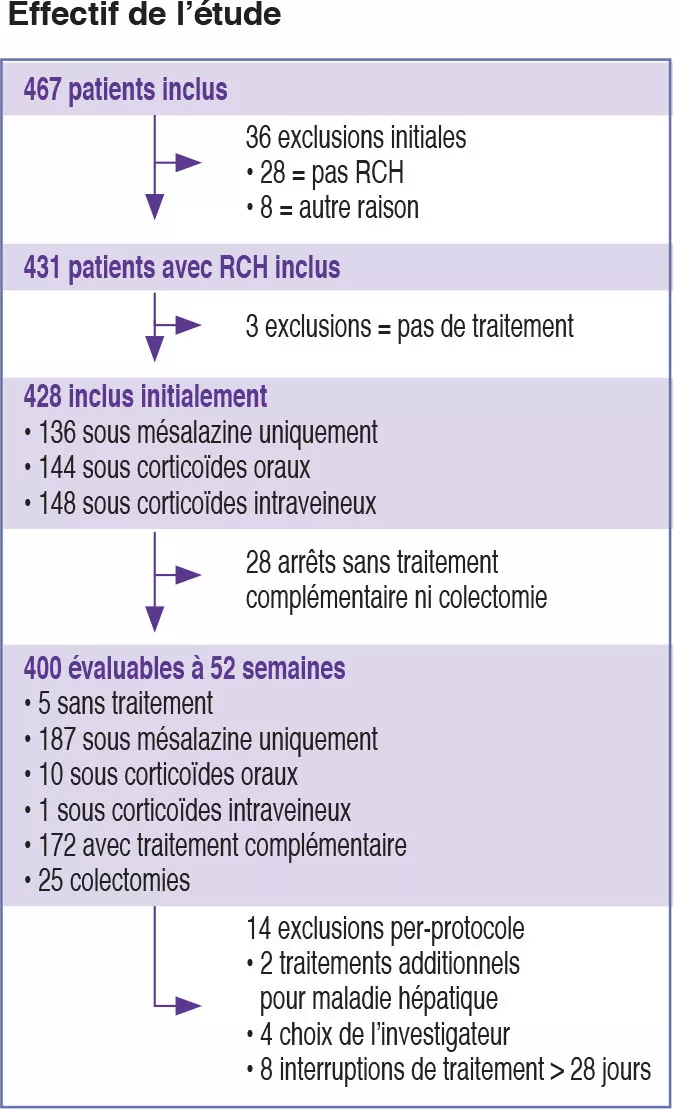
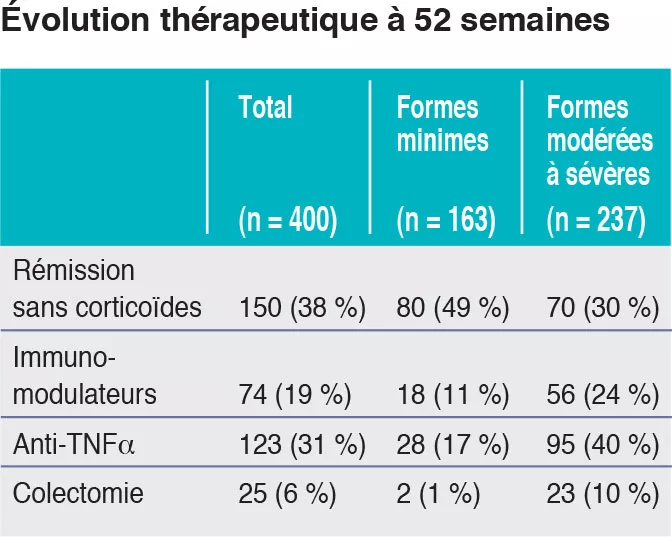
Dans cette étude prospective multicentrique, réalisée dans 29 centres aux États-Unis et au Canada entre 2012 et 2015, 467 enfants âgés de 4 à 17 ans ont été recrutés (Figure 1). Le critère principal de jugement était la rémission, définie par un PUCAI < 10, à la semaine 52, sans autre traitement que la mésalazine (sans corticoïdes ni colectomie). Les auteurs ont défini la sévérité initiale en minime (traitement par mésalazine ou corticoïdes oraux avec PUCAI < 45) et modérée à sévère (corticoïdes oraux avec PUCAI ≥ 45 ou corticoïdes intraveineux). En plus des paramètres cliniques et biologiques habituels, cette étude a évalué l’expression génique à partir de biopsies rectales ainsi que les microbiomes rectal et fécal avant traitement. 428 enfants ont débuté le traitement : âge moyen de 12,7 ans, 50 % de filles, 42 % de formes minimes (PUCAI moyen de 31,9 ± 12,1 DS) et 58 % de formes modérées à sévères (PUCAI moyen de 62,9 ± 13,2 DS). À 52 semaines, 150 (38 %) des 400 participants évaluables étaient en rémission sans corticoïdes, dont 80 (49 %) avaient une forme minime et 70 (30 %) avaient une forme modérée à sévère (Tableau 1).
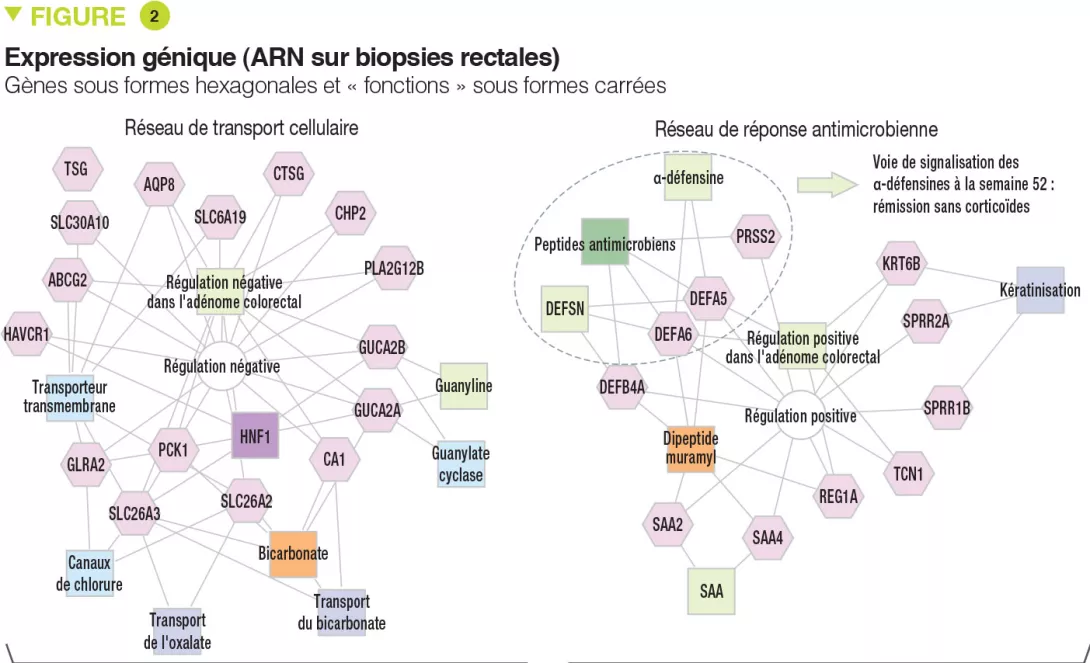
Des paramètres cliniques, biologiques et endoscopiques qui étaient associés à une rémission sans corticoïdes ont été validés dans une autre étude prospective indépendante ayant inclus 307 enfants. À noter que la rémission sans corticoïdes est obtenue avant 16 semaines pour les formes modérées à sévères (après quoi elle ne peut plus être obtenue) alors qu’elle peut l’être jusqu’à 52 semaines dans les formes minimes. En outre, même des enfants avec des formes très sévères ont pu obtenir une rémission sans corticoïdes à 52 semaines (41/133 [31 %] avec PUCAI ≥ 65) et, à l’inverse, certains enfants qui avaient une forme minime étaient sous anti-TNFα à 52 semaines (13/90 [14 %] avec PUCAI < 35). Les auteurs ont trouvé que 33 gènes étaient exprimés différemment entre les patients ayant une forme modérée à sévère qui avaient obtenu une rémission sans corticoïdes (n = 51) ou non (n = 101). Parmi ces gènes, 18 étaient surexprimés, associés au transport cellulaire et à des canaux ; 15 étaient sous-exprimés, associés à la réponse antimicrobienne (Figure 2). La voie de signalisation des α-défensines antimicrobiennes avait la plus forte association négative avec la rémission sans corticoïdes à la semaine 52. Cependant, l’ensemble de ces 33 gènes était associé négativement avec la nécessité d’une escalade thérapeutique vers les anti-TNFα.
Points clés
-
Les choix thérapeutiques dépendent de la sévérité
de la RCH (scores PUCAI, Mayo) mais aussi de la réponse thérapeutique à 4 semaines -
D’autres critères (taux Hb, éosinophiles rectaux, 25-OH vitamine D) sont aussi à prendre en considération
-
L’intégration de nouveaux paramètres (expression génique et microbiote) pourrait faciliter une médecine personnalisée dans le futur
Quelles sont les conséquences en pratique ?
Il est important de retenir les facteurs prédictifs de rémission sans corticoïdes et d’escalade thérapeutique déterminées d’après les analyses multivariées.
Les facteurs prédictifs d’une rémission sans corticoïdes à 52 semaines étaient :
- PUCAI < 45, Hb ≥ 10 g/dL ;
- rémission à 4 semaines ;
- expression faible des gènes antimicrobiens ;
- abondance relative augmentée des Ruminococcaceae et diminuée de Sutterella.
Les facteurs prédictifs d’une escalade vers les anti-TNFα étaient :
- score Mayo total ≥ 11 ;
- nombre d’éosinophiles dans biopsies rectales < 32 par champs à fort grossissement ;
- 25O-H vitamine D < 20 ng/mL ;
- Hb < 10 g/dL ;
- absence de rémission à 4 semaines ;
- diminution des gènes impliqués dans le transport et des gènes antimicrobiens ;
- abondance relative diminuée de Oscillospira.
Conclusion
Cette étude a montré des paramètres qu’il faut prendre en considération dans les choix thérapeutiques pour les enfants nouvellement diagnostiqués avec une RCH. L’analyse de l’expression des gènes rectaux et du microbiote pourrait aider à prédire la réponse thérapeutique, mais aussi à déterminer de nouvelles cibles thérapeutiques.




