Microbiota y enfermedades metabólicas
Síntesis
Por el Pr. Yolanda Sanz
Grupo de Investigación sobre Ecología Microbiana, Nutrición y Salud en el Instituto de Agroquímica y Tecnología de los Alimentos - Consejo Superior de Investigaciones Científicas (IATA-CSIC), Valencia, España
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Human digestive system microbiota, 3D illustration.
Acerca de este artículo
Autor
La obesidad es uno de los mayores retos a los que se enfrenta la salud pública en el siglo XXI por su alta prevalencia y su implicación en el desarrollo de multitud de enfermedades no transmisibles (síndrome metabólico o MetS, y diabetes mellitus de tipo 2 o T2DM). Las pruebas de la función que desempeñan las alteraciones de la microbiota intestinal, en parte debido a dietas poco saludables, en los mecanismos que vinculan la obesidad con la inflamación y la disfunción metabólica, abren nuevas oportunidades para un mejor entendimiento de la etiología de la enfermedad y para el diseño de estrategias de abordaje. En este último ámbito, las vías de investigación incluyen en particular a los trasplantes de microbiota fecal (TMF), los ingredientes alimenticios destinados a nutrir nuestros microorganismos beneficiosos (como las fibras prebióticas) y las bacterias indigenas (conocidas como probióticos) que pueden proporcionar los microorganismos beneficiosos que le falten a nuestro intestino. Los elementos disponibles son prometedores, pero aún hay trabajo que hacer para identificar las bacterias intestinales efectoras que ayudarán a reprogramar y prevenir la obesidad, y que permitirán personalizar dietas con el objetivo de optimizar las funciones metabólicas de nuestros microbios intestinales.
Obesidad, síndrome metabólico y diabetes
La obesidad es una epidemia mundial que ningún país ha sido capaz de invertir a día de hoy. La prevalencia global de obesidad se ha triplicado en los Estados Unidos y en muchos países europeos desde los años 1980, lo que convierte a esta enfermedad en uno de los mayores retos para la salud pública del siglo XXI. De hecho, la obesidad presenta altas tasas de comorbilidades, lo que supone un factor de riesgo importante para la aparición de multitud de enfermedades no transmisibles. La resistencia a la insulina provocada por la obesidad se considera un factor causal clave del síndrome metabólico, que a menudo conlleva una disfunción de las células β pancreáticas, y que acaba por desencadenar la aparición de DMT2 [1].
Inflamación metabólica: de la obesidad a las comorbilidades crónicas
Actualmente, se ha documentado ampliamente que el estado inflamatorio crónico asociado a la obesidad y relacionado causalmente con complicaciones metabólicas afecta al tejido adiposo y a otros órganos, como el cerebro, los músculos, el hígado, el páncreas y los intestinos, y que muestran diferentes particularidades [1, 2]. Concretamente, la implicación del sistema inmunológico intestinal y los microbios que crecen ante la exposición a dietas poco saludables han surgido recientemente como factores adicionales de inflamación metabólica asociada a la obesidad y podrían representar, a su vez, objetivos terapéuticos [2, 3].
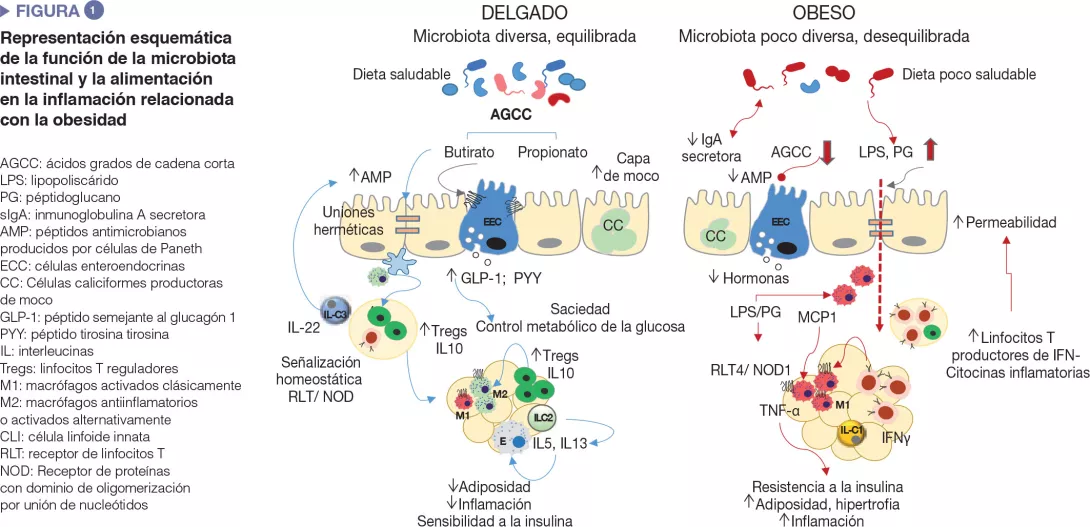
¿Cuál es la implicación de la microbiota intestinal?
La implicación de la microbiota intestinal en la obesidad se ha deducido en parte gracias a estudios observacionales que han registrado casos de disbiosis en personas obesas frente a personas delgadas en evaluaciones transversales. La evidencia de los cambios en la microbiota intestinal durante intervenciones de tipo dietético, médico o quirúrgico destinadas a la pérdida de peso y para mejorar las complicaciones metabólicas ha permitido establecer relaciones similares en las que la obesidad se asociaba con una disminución de la diversidad de especies y un aumento de los taxones de bacterias como Proteobacteria (enterobacterias) y Bilophila wadsworthia. Contrariamente, los fenotipos metabólicos sanos a menudo se asociaron con un aumento de la proporción de los filos Bacteroidetes, de la relación Bacteroidetes/Firmicutes o de los géneros Bacteroides, Prevotella, Akkermansia, Faecalibacterium o Christensenella [4, 5]. Sin embargo, los hallazgos no fueron completamente congruentes entre los estudios, en parte por la heterogeneidad de los estudios y las limitaciones metodológicas. Otros metaanálisis han indicado que el único biomarcador que podía generalizarse para la obesidad era una diversidad reducida de especies bacterianas [6]. Además, las personas obesas probablemente tampoco tienen todas el mismo patrón disbiótico, especialmente si se tiene en cuenta la elevada variabilidad interindividual de la microbiota y la complejidad de los fenotipos metabólicos (obesidad con y sin otras complicaciones). Más recientemente, se ha descubierto que las alteraciones de la microbiota intestinal que preceden el desarrollo de la obesidad han sido identificadas como agentes causales de la enfermedad. Cabe destacar un estudio longitudinal reciente que muestra que una diversidad reducida de especies bacterianas, vinculada a dietas poco saludables, ofrece unas condiciones favorables a la proliferación de Proteobacteria (enterobacterias), que precede la aparición de sobrepeso, según se observó durante un seguimiento de 4 años realizado en niños [7].
Se ha obtenido una prueba aún más definitiva de la función causal de la microbiota en la definición del fenotipo metabólico de la persona gracias al TMF. Al transferir la microbiota disbiótica de personas enfermas a nuevos receptores animales, la mayoría de estos experimentos han mostrado que el TMF era suficiente para replicar el fenotipo metabólico del donante (delgado u obeso) [8].
El biomarcador microbiótico más frecuente asociado a la obesidad es una diversidad reducida de especies bacterianas, que también podría predisponer a padecer obesidad, inflamación
crónica y complicaciones metabólicas.
Mecanismos de acción en los que interviene la microbiota
La microbiota intestinal influye en el metabolismo de la energía gracias a su capacidad para aumentar la capacidad humana para metabolizar nutrientes y extraer calorías de la alimentación, así como para regular la absorción de glúcidos y lípidos y su depósito en los tejidos periféricos [8]. Los microbios intestinales y sus productos metabólicos también intervienen en la regulación del sistema enteroendocrino, por ejemplo, a través de la producción de ácidos grasos de cadena corta, que inducen la síntesis de hormonas intestinales (p. ej.: GLP-1, PYY) que actúan mediante vías endocrinas y neuronales que regulan el apetito, la ingesta de alimentos y el metabolismo de la glucosa [9]. Además, la microbiota intestinal es un importante regulador de la barrera intestinal y del sistema inmunológico, cuyas alteraciones están implicadas en la inflamación de baja intensidad y la resistencia a la insulina, relacionadas con la obesidad, como se detalla a continuación y se esquematiza en la (Figura 1) [2,3].
Es probable que no se puede identificar un único patrón de disbiosis intestinal en la obesidad, ya que puede depender de las complicaciones metabólicas subyacentes y otros rasgos biológicos y ambientales de la persona.
Funcionamiento deficiente de la barrera mucosa en la obesidad
Una alimentación desequilibrada provoca deficiencias en la barrera mucosa intestinal afectando a su penetrabilidad y favoreciendo la translocación de los componentes bacterianos, como el lipopolisacárido bacteriano (LPS) y el peptidoglucano o incluso microorganismos enteros, que pueden activar la inmunidad innata en los órganos metabólicamente activos. Se atribuye una barrera mucosa intestinal deficiente a la inflamación local causada por dietas ricas en grasas saturadas y la disbiosis que provocan, así como a trastornos en la capa de moco [10] y en la producción de péptidos antimicrobianos por las células de Paneth (Reg3γ, lisozima 1) [11]. Por ejemplo, se ha observado que un aumento de los niveles séricos de LPS (conocida como «endotoxemia metabólica ») causaba obesidad y disfunción metabólica en modelos animales y que se asociaba con un índice de masa corporal elevado, una dieta rica en grasas, inflamación posprandial y un riesgo de DMT2 en humanos. Esto puede verse favorecido por la proliferación de bacterias gramnegativas como las enterobacterias, que son una fuente de LPS ante una dieta rica en grasas. Los LPS podrían activar la inmunidad innata en el intestino y más allá, e inducir el reclutamiento de células inmunitarias inflamatorias en tejidos metabólicos, como los macrófagos. Las dietas ricas en grasas saturadas también podrían promover el crecimiento de otras bacterias gramnegativas como Bilophila wadsworthia, que genera ácido sulfhídrico, un metabolito tóxico para los enterocitos que conduce a una hiperpermeabilidad intestinal, inflamación y disfunción metabólica [12]. Por último, es posible que una dieta rica en grasas (DRG) también aumente los peptidoglucanos circulantes, probablemente debido a los cambios provocados por la dieta en la expresión del péptido antimicrobiano lisozima 1, que hidroliza los componentes de las paredes celulares bacterianas. Según el tipo de peptidoglucano, pueden actuar como ligandos de Nod1 de macrófagos proinflamatorios del tejido adiposo o del hígado, causando resistencia a la insulina, mientras que los efectos opuestos parecen producirse en las células beta del páncreas, posiblemente como un mecanismo de compensación [13].
Trastorno de la regulación de las células inmunocompetentes intestinales en la obesidad
Al igual que otros órganos metabólicos, incluidos el tejido adiposo y el hígado, se ha observado una degradación de la homeostasis inmunológica en el intestino durante la obesidad. En la obesidad causada por la alimentación existen varios subconjuntos de células inmunitarias innatas y adaptativas en el intestino que adoptan un fenotipo proinflamatorio, demostrado principalmente por un aumento de macrófagos proinflamatorios y citocinas (IFNγ). Paralelamente, se producen reducciones en las proporciones de linfocitos T reguladores y de células linfoides innatas (CLI) de tipo 3 productoras de IL- 22, que ayudan a mantener la integridad de la mucosa y la homeostasis intestinal en personas delgadas [2,3].
Algunas de estas alteraciones se invierten mediante la disminución de la microbiota (p.ej.: con un tratamiento antibiótico) o la administración de, por ejemplo, Bifidobacterias específicas que también restauran la disbiosis intestinal causada por la alimentación en la obesidad, reforzando el papel causal de la microbiota intestinal en la inflamación metabólica [3]. Además, las células inmunitarias intestinales IgA+ actúan como mediadores mucosos de la regulación glicémica sistémica en la obesidad causada por una alimentación rica en grasas.
Este tipo de dieta reduce el número de células inmunitarias IgA+ e IgA secretoras. La reducción de IgA podría reforzar los efectos de la dieta rica en grasas y añadir otro nivel de desestabilización para la comunidad bacteriana, relacionado con el aumento de la permeabilidad intestinal y la inflamación del tejido adiposo [14].
Qué impacto podría tener la modulación de la microbiota en la microbiota en la evolución de la enfermedad
TMF
un estudio clínico mostró que la sensibilidad a la insulina podía mejorar en pacientes con síndrome metabólico 6 semanas después de haber recibido un trasplante de microbiota intestinal de un donante delgado y sano [5]. Además, se observó un aumento en la diversidad microbiana y una abundancia de las bacterias productoras de butirato. En otro estudio realizado en personas con síntomas de síndrome metabólico que recibieron la microbiota de pacientes que respondían bien a la cirugía bariátrica, se observaron cambios en la expresión de los receptores de dopamina, lo que podría justificarse por un mejor control de la ingesta de alimentos, pero no confirmó los efectos en la resistencia a la insulina*. Se han registrado muchos otros ensayos para evaluar los efectos del TMF en la obesidad, pero los resultados aún no se han publicado [5]. Por lo tanto, la evidencia científica que apoya el uso de esta estrategia para abordar las complicaciones de la obesidad todavía es muy limitada.
Una disbiosis intestinal mantenida por dietas poco saludables contribuye a la desregulación del sistema inmunológico intestinal, lo que constituye un factor adicional de inflamación
metabólica asociada a la obesidad y además representaun objetivo terapéutico.
Fibras vegetales
as dietas con ingesta de fibra por encima de las recomendaciones actuales (25 g/día para adultos) mejoran el mantenimiento del peso y reducen el riesgo de cardiopatía coronaria y DMT2, según un amplio corpus de pruebas en humanos. Algunos de los efectos de estas fibras se deben a sus propiedades físico- químicas (p. ej.: indigestibilidad, viscosidad, etc.), que contribuyen a reducir las respuestas glucémicas y el consumo de energía, así como a mejorar el perfil lipídico de la sangre. Otros efectos podrían estar producidos por su impacto en la microbiota intestinal de la persona, que fermenta fibras que generan metabolitos como ácidos grasos de cadena corta (AGCC: butirato, propionato, etc.) con un papel activo en el metabolismo del hospedador. Los AGCC inducen la producción de péptidos enteroendocrinos (GLP-1, GLP-2, PYY) que refuerzan la barrera intestinal, inducen saciedad, mejoran el metabolismo de la glucosa y ejercen efectos antiinflamatorios en la obesidad. La ingesta de fibra también aumenta la diversidad de la microbiota intestinal que se asocia a un fenotipo metabólico saludable. Además, los efectos benéficos de las fibras dependen no solo del tipo y de la cantidad de fibras, sino también de la estructura de la microbiota de la persona, de su diversidad y de la presencia o ausencia de especies bacterianas específicas implicadas en su utilización [15]. Todo esto apunta a la necesidad de avanzar hacia unas recomendaciones alimenticias más personalizadas [15].
Bacterias beneficiosas
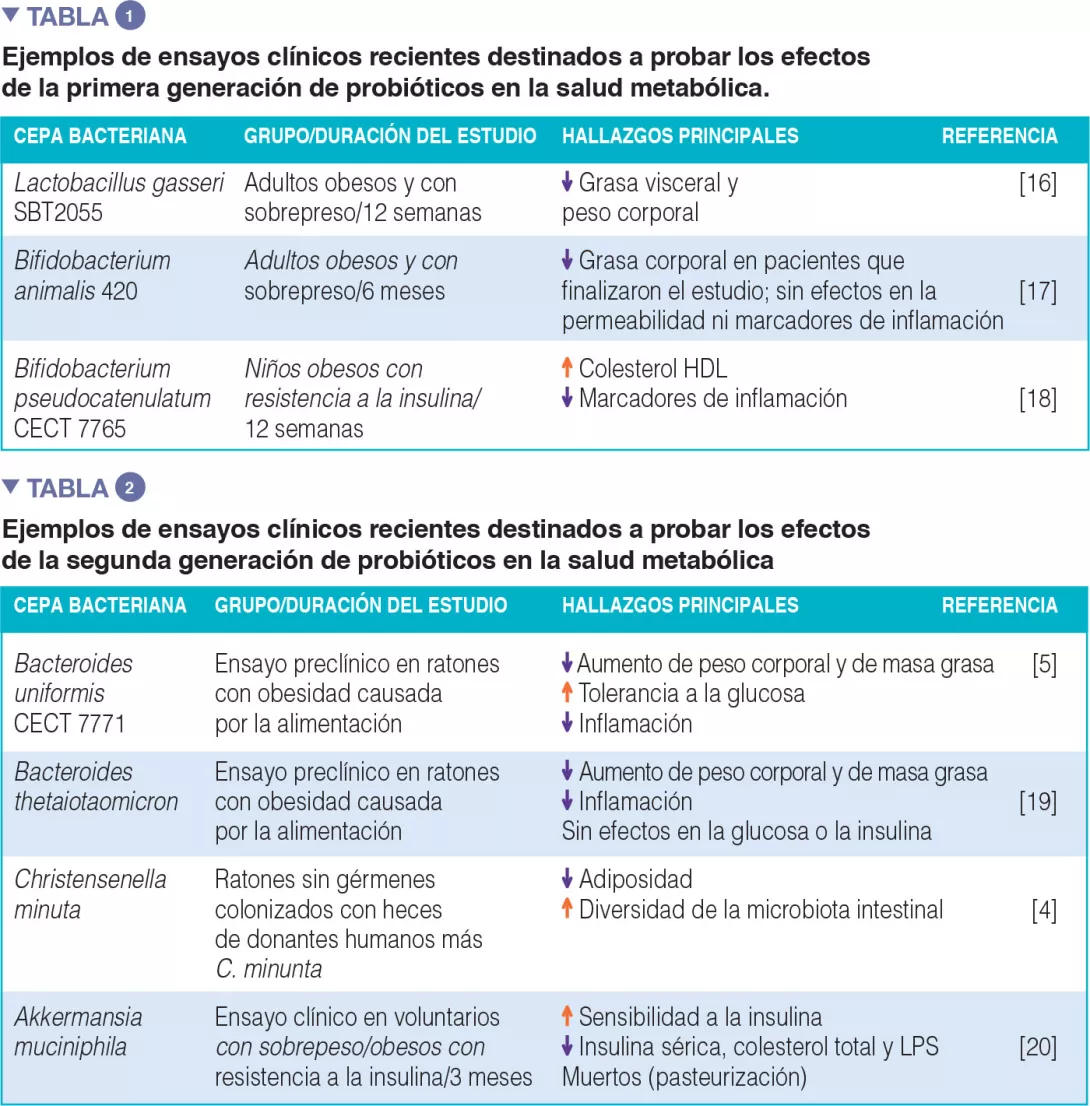
primera y segunda generación de probióticos: la mayoría de estudios clínicos sobre eficacia se han realizado con cepas bacterianas tradicionalmente utilizadas como probióticos para humanos, «primera generación de probióticos », que se compone básicamente de Lactobacillus y Bifidobacterium. En la Tabla 1 se recogen algunos ejemplos, aunque se pueden encontrar muchos más en la literatura, con resultados positivos y negativos. También se han hecho algunos intentos de aislar nuevas especies bacterianas de la microbiota humana indigena, constantemente asociada con un fenotipo metabólico sano, con vistas a crear una «segunda generación de probióticos». Estos podrían ayudarnos a proporcionar a nuestra microbiota intestinal los microorganismos que le falten. La Tabla 2 recoge algunos de los estudios realizados en modelos animales (ensayos preclínicos) y el único realizado en humanos hasta el momento.
Conclusión
La evidencia científica confirma la función que desempeñan las alteraciones de la microbiota intestinal en la obesidad y las complicaciones metabólicas, en parte debido a dietas poco saludables. La inflamación intestinal se presenta como un factor de inflamación sistémica en la obesidad. Este proceso se modula mediante la microbiota y la alimentación, que juntas representan tanto una causa como un objetivo terapéutico. Los ensayos experimentales han ofrecido una prueba de concepto de que una «microbiota sana», unas bacterias intestinales específicas, o las fibras vegetales que potencian sus funciones, pueden ser importantes en el abordaje de la obesidad. Para avanzar más en el desarrollo de soluciones tangibles para la obesidad, aún son necesarios más esfuerzos para identificar las bacterias intestinales efectoras que colaboran en la reprogramación de la obesidad y para personalizar las dietas con vistas a optimizar las funciones de la microbiota intestinal en beneficio de nuestra salud metabólica.






