МИКРОБИОТА И РАССТРОЙСТВА ОБМЕНА ВЕЩЕСТВ
ОБЗОРНАЯ СТАТЬЯ
Проф. Йоланда Санз (Yolanda Sanz)
Исследовательский отдел экологии, питания и здоровья; Институт агрохимии и пищевых технологий; Национальный совет по исследовани- ям (IATA-CSIC), Валенсия, Испания
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Human digestive system microbiota, 3D illustration.
Об этой статье
Автор
Ожирение является одной из самых значительных проблем здравоохранения в XXI веке вследствие высокой распространенности и той роли, которую оно играет в развитии множества неинфекционных заболеваний (метаболический синдром (MetS) и сахарный диабет 2-го типа (T2DM)). Доказательства роли изменений микробиоты кишечника, частично вследствие нездорового питания, в механизмах, связывающих ожирение с воспалением и метаболической дисфункцией, открывают новые возможности для более глубокого изучения этиологии заболеваний и разработки стратегий лечения. Изученные пути лечения заболеваний включают трансплантацию фекальной микробиоты (ТФМ), составляющие рациона, предназначенные для питания полезных микроорганизмов в нашем теле (такие как пребиотические волокна), и резидентные бактерии (известные как пробиотики) для восполнения недостающих микроорганизмов в нашем кишечнике. Полученные данные являются перспективными, но еще предстоит идентифицировать сочетания кишечных бактерий эффекторов, которые помогут перепрограммировать и предотвратить ожирение, а также персонализировать режимы питания с целью оптимизации метаболических функций кишечных бактерий.
ОЖИРЕНИЕ, МЕТАБОЛИЧЕСКИЙ СИНДРОМ И ДИАБЕТ
Мы наблюдаем по всему миру эпидемию ожирения, которую ни одна страна пока не способна победить. Общая распространенность ожирения в США и многих странах ЕС утроилась с 1980-х годов, став одной из крупнейших проблем здравоохранения XXI века (http://www.who.int). Действительно, ожирение демонстрирует высокие уровни коморбидности и явля- ется основным фактором риска развития различных неинфекционных заболеваний. Вызванную ожирением резистентность к инсулину считают ключевым фактором в развитии MetS, который часто прогрессирует до потери β-клеток поджелудочной железы, что в итоге является причиной начала T2DM [1].
МЕТАБОЛИЧЕСКОЕ ВОСПАЛЕНИЕ: ПУТЬ ОТ ОЖИРЕНИЯ К ХРОНИЧЕСКИМ СОПУТСТВУЮЩИМ ЗАБОЛЕВАНИЯМ
В настоящее время хорошо известно, что хронический воспалительный процесс, связанный с ожирением и вызывающий метаболические осложнения, влияет на жировую ткань и прочие части тела, включая мозг, мускулатуру, печень, поджелудочную железу и кишечник, демонстрируя при этом различные особенности [1, 2]. В частности, недавно оказалось, что в развитии связанного с ожирением метаболического воспаления дополнительно участвуют иммунная система кишечника и бактерии, рост которых ускоряется под влиянием нездорового питания, и они также могут представлять собой терапевтические мишени [2, 3].
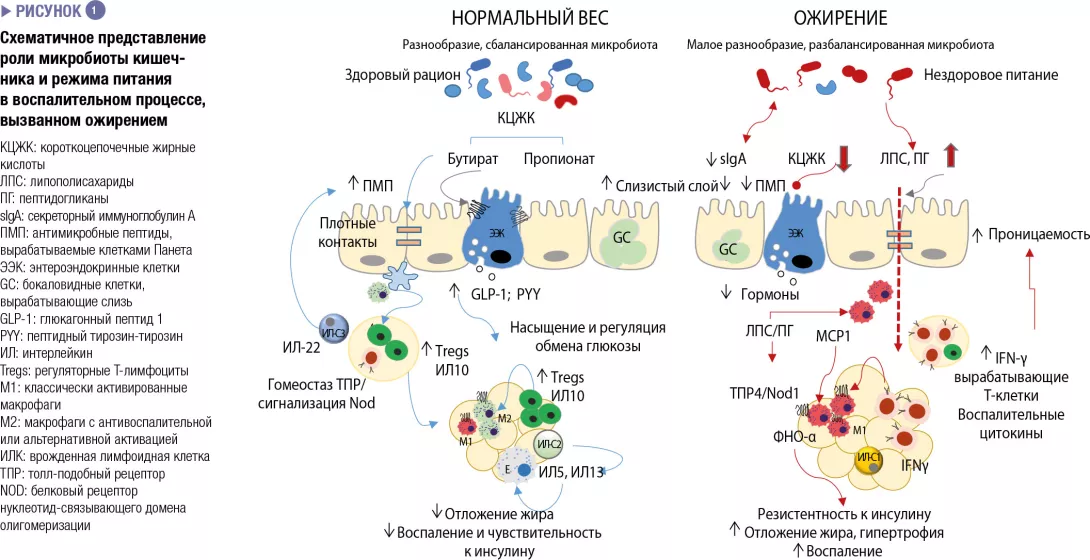
КАКОВА РОЛЬ МИКРОБИОТЫ КИШЕЧНИКА?
Роль микробиоты кишечника в ожирении частично определяют по результатам обсервационных исследований, в которых отмечается дисбиоз у лиц, страдающих ожирением, по сравнению с лицами с нормальной массой тела при перекрестной оценке. Данные об изменениях в кишечной микробиоте при изменениях режима питания, медицинских или хирургических вмешательствах, направленных на снижение веса и на облегчение метаболических осложнений, позволили установить наличие похожих взаимосвязей, при которых ожирение было связано со снижением видового разнообразия и возрастанием таких бактериальных таксонов, как Proteobacteria (энтеробактерии) и Bilophila wadsworthia. Напротив, здоровые метаболические фенотипы часто были связаны с увеличением группы Bacteroidetes или соотношения Bacteroidetes/ Firmicutes либо родов Bacteroides, Prevotella, Akkermansia, Faecalibacterium или Christensenella [4, 5]. Однако данные разных исследований совпадали не полностью отчасти вследствие гетерогенности исследований и ограничений их планирования. Дальнейший метаанализ показывает, что единственным биомаркером, который в целом можно связать с ожирением, было разнообразие бактериальных видов [6]. Также вероятно, что всех страдающих ожирением лиц нельзя отнести к како- му-то определенному паттерну дисбиоза в первую очередь из-за высокой вариабельности микробиоты у разных людей и сложности метаболических фенотипов (ожирение с другими осложнениями и без них). В последнее время определено, что изменения кишечной микробиоты, которые предшествуют ожирению, имеют причинную связь с этиологией. Примечательно недавно проведенное продольное исследование, показавшее, что связанное с привычкой к нездоровому питанию снижение разнообразия бактериальных видов обеспечивает сценарий, который благоприятствует чрезмерному росту количества Proteobacteria (энтеробактерий), предшествующему набору лишнего веса в 4-летнем периоде последующего наблюдения у детей [7].
Более очевидное доказательство казуальной роли микробиоты в определении метаболического фенотипа у испытуемого получили в ходе ТФМ, при трансплантации дисбиотической микробиоты больных испытуемых другим животным-реципиентам. Большинство этих экспериментов показали, что ТФМ было достаточно для репликации метаболического фенотипа донора (худоба или тучность) [8].
Наиболее достоверный основанный на микробиоте биомаркер, связанный с ожирением, – уменьшенное разнообразие видов бактерий, которое может также предшествовать развитию ожирения, хронического воспаления и метаболических осложнений.
ОПОСРЕДОВАННЫЕ МИКРОБИОТОЙ МЕХАНИЗМЫ ДЕЙСТВИЯ
Влияние микробиоты кишечника на энергетический метаболизм за счет ее способности повышать возможности человека по метаболизации питательных веществ и получению калорий из рациона, а также регулировать абсорбцию сахаров и липидов и их отложение в периферических тканях [8]. Кишечные бактерии и продукты их метаболизма также участвуют в регуляции энтероэндокринной системы, например, посредством выработки короткоцепочечных жирных кислот, которые индуцируют синтез кишечных гормонов (напр., GLP-1, PYY). В свою очередь те по эндокринным и нервным путям регулируют аппетит, потребление пищи и метаболизм глюкозы [9]. Кроме того, микробиота кишечника – основной регулятор кишечного барьера и иммунной системы, и изменения в ней причастны к связанному с ожирением неспецифическому воспалению и резистентности к инсулину, согласно нижеприведенному описанию схематического изображения на рисунке 1 [2, 3].
Возможно, уникальный паттерн кишечного дисбиоза при ожирении идентифицировать нельзя, и он может зависеть от лежащих в его основе метаболических осложнений и других биологических и внешних факторов отдельного индивидуума.
НАРУШЕНИЕ ФУНКЦИОНИРОВАНИЯ СЛИЗИСТОГО БАРЬЕРА ПРИ ОЖИРЕНИИ
Нездоровое питание вызывает нарушения барьерной функции слизистой оболочки кишечника, которые влияют на его проницаемость и благоприятствуют транслокации бактериальных компонентов, таких как бактериальный липополисахарид (ЛПС) и пептидогликан или даже целых микроорганизмов, которые могут активировать механизмы врожденного иммунитета в метаболически активных органах. Дефект слизистого барьера кишечника обусловлен местным воспалением, которое было вызвано питанием, богатым насыщенными жирами, и вызванным режимом питания дисбиозом, а также связано с сопутствующими нарушениями в слизистом слое [10] и в выработке антибактериальных пептидов клетками Панета (Reg3γ, лизосома 1) [11]. Например, продемонстрировано, что повышенные уровни ЛПС в плазме (известные как «метаболическая эндотоксемия») вызывают ожирение и метаболическую дисфункцию у животных моделей и связаны с повышенным индексом массы тела, питанием с высоким содержанием жира, постпрандиальным воспалением и риском возникновения T2DM у людей. Это может быть вызвано чрезмерным разрастанием грамотрицательных бактерий, таких как энтеробактерии, которые являются источником ЛПС при высокожировом питании. ЛПС могли активировать врожденный иммунитет в кишечнике и за его пределами и вы- звать накопление в метаболических тканях воспа- лительных иммунных клеток, таких как макрофаги. Богатое насыщенными жирами питание может также усиливать рост других грамотрицательных бактерий, таких как Bilophila wadsworthia, которые вырабатывают сульфид водорода, токсичный для энтероцитов метаболит, приводящий к повышению кишечной проницаемости, воспалению и метаболической дисфункции [12]. Наконец, высокожировая диета (ВЖД) может также повышать уровень пептидогликанов в крови, вероятно, благодаря вызванным питанием изменениям в экспрессии противомикробных пептидов лизосомы 1, которые гидролизуют компоненты бактериальных клеточных стенок. В зависимости от своего типа, пептидогликаны могут действовать как лиганды Nod1 провоспалительных макрофагов жировой ткани или печени, что вызывает резистентность к инсулину, в то время как в бета-клетках поджелудочной железы возникают противоположные эффекты, возможно по механизмам обратной связи [13].
ДИСРЕГУЛЯЦИЯ КИШЕЧНЫХ ИММУНОКОМПЕТЕНТНЫХ КЛЕТОК ПРИ ОЖИРЕНИИ
жировую ткань и печень, в кишечнике при ожирении наблюдается нарушение иммунного гомеостаза. При вызванном питанием ожирении различные субпопуляции врожденных и адаптивных иммунных клеток в кишечнике принимают провоспалительный фенотип, который вначале демонстрируется возрастанием провоспалительных макрофагов и цитокинов (IFNγ).
Одновременно происходит снижение доли регуляторных Т-клеток и ИЛК типа 3, вырабатывающих ИЛ-22, которые помогают поддерживать целостность слизистых оболочек и гомеостаз в кишечнике у испытуемых без лишнего веса [2, 3]. Некоторые из этих изменений устраняются при обеднении микробиоты (например, при терапии антибиотиками) или введении, например, особых бифидобактерий, которые также подавляют вызванный питанием кишечный дисбиоз при ожирении, что подтверждает причинную роль микробиоты кишечника в метаболическом воспалении [3].
Кроме того, кишечные иммунные клетки, продуцирующие IgA+ при вызванном ВЖД ожирении действуют в слизистой как медиаторы регуляции глюкозы по всему организму. ВЖД снижает число IgA+ иммунных клеток и секреторных IgA. Снижение IgA могло добавить еще один уровень дестабилизации в бактериальное сообщество к уже вызванному ВЖД, что связано с увеличением кишечной проницаемости и воспалением жировой ткани [14].
КАК МОДУЛЯЦИЯ МИКРОБИОТЫ МОЖЕТ ВЛИЯТЬ НА ЭВОЛЮЦИЮ ЗАБОЛЕВАНИЯ
ТФМ
Клинические исследования показали, что чувствительность к инсулину у людей с MetS может повыситься через 6 недель после трансплантации микробиоты кишечника от здорового донора с нормальным весом [5]. Наблюдалось также повышение разнообразия микробиоты и численности бактерий, вырабатывающих бутират. В другом исследовании, проведенном с участием лиц с показателями MetS, которые получили микробиоту респондеров, перенесших бариатрическую операцию, отмечались изменения в экспрессии дофаминовых рецепторов, что могло способствовать лучшему контролю приема пищи, но не подтвердило влияние на резистентность к инсулину. Во многих других исследованиях. оценивавших влияние ТФМ на ожирение, такое влияние было зафиксировано, но результаты еще не опубликованы [5]. Следовательно, научные доказательства, подтверждающие использование такой стратегии для лечения осложнений ожирения еще крайне ограничены.
Дисбиоз в кишечнике, установившийся из-за нездорового питания, вносит свой вклад в дисрегуляцию кишечной иммунной системы, что составляет дополнительный стимул для связанного с ожирением метаболического воспаления, а также представляет собой терапевтическую мишень.
Пищевые волокна
Большое количество данных, полученных при исследовании у людей, говорит о том, что режим питания с потреблением волокон выше текущих рекомендаций (25 г/день для взрослых) способствует поддержанию веса и снижает риск ишемической болезни сердца и T2DM. Некоторое влияние пищевых волокон связаны с их физико-химическими свойствами (например, неусвояемостью, вязкостью и так далее), что способствует снижению гликемических ответов и потреблению энергии, а также улучшению липидного профиля крови. Другие эффекты могут быть опосредованы их действием на микробиоту кишечника испытуемого, которая ферментирует волокна, вырабатывающие метаболиты, такие как короткоцепочечные жирные кислоты (SCFA: бутират, пропионат и т. д.) с активной ролью в метаболизме у хозяина. SCFA вызывают образование энтероэндокринных пептидов (GLP-1, GLP-2, PYY), которые усиливают кишечный барьер, вызывают насыщение, улучшают метаболизм глюкозы и оказывают противовоспалительное действие при ожирении. Потребление волокон также повышает разнообразие микробиоты кишечника, которое связано со здоровым метаболическим фенотипом. Также положительное влияние волокон зависит не только от типа и количества самих волокон, но также от структуры микробиоты, ее разнообразия и наличия или отсутствия определенных видов бактерий, участвующих в их переработке [15]. Вместе с тем это указывает на необходимость дви- жения в сторону более персонализированных рекомендаций по режиму питания [15].
Полезные бактерии
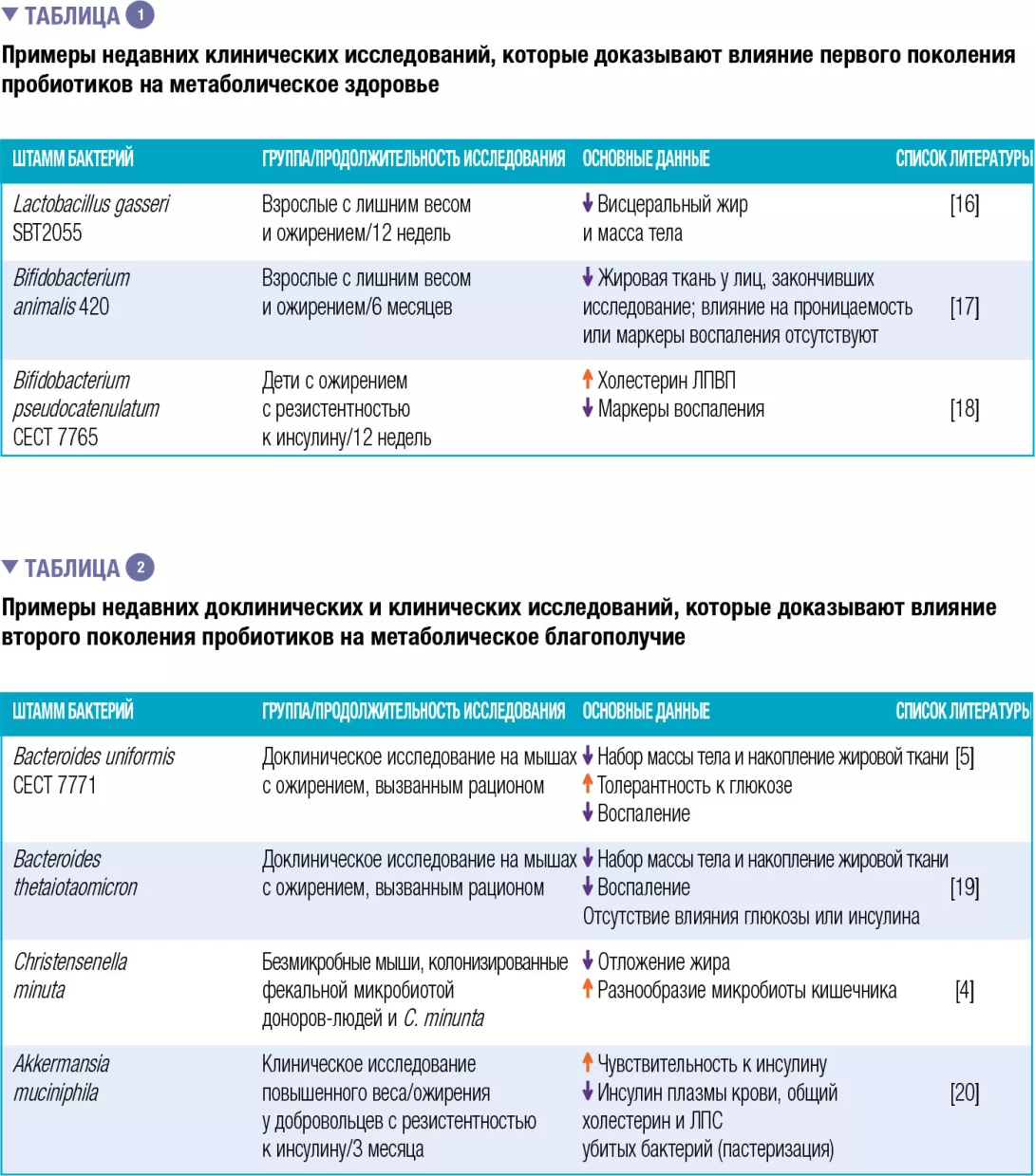
Первое и второе поколение пробиотиков: основную часть клинических исследований эффективности провели с бактериальными штаммами, традиционно используе- мыми в качестве пробиотиков у людей, «первым поколением пробиотиков», в которое обязательно входят Lactobacillus и Bifidobacterium. В таблице 1 обобщены некоторые примеры, хотя намного боль- ше имеется в литературе, с положительными и от- рицательными результатами.
Сделано было также несколько попыток выделить новые виды бактерий из местной микробиоты человека, на постоянной основе связанной со здоровым метаболическим фенотипом, с целью создать «второе поколение пробиотиков». Это может помочь нам увеличить наш потенциал для пополнения микробиоты кишечника недостающими бактериями. В таблице 2 приведена сводная информация по некоторым исследованиям, проведенным на животных моделях (доклинические исследования), и только одно к настоящему моменту проведено с участием людей.
ЗАКЛЮЧЕНИЕ
Научные данные подтверждают роль, которую изменения микробиоты кишечника, частично из-за нездорового питания, играют в ожирении и метаболических осложнениях. При ожирении воспаление в кишечнике запускает системное воспаление. Этот процесс модулируется микробиотой кишечника и питанием, которые вместе составляют как причину, так и терапевтическую мишень. Экспериментальные исследования подтвердили концепцию, что «здоровая микробиота», специфичные кишечные бактерии или пищевые волокна, которые усиливают их работу, могут играть роль в лечении ожирения. Чтобы продвинуться в области разработки конкретных решений при ожирении, необходимо предпринимать дальнейшие усилия для идентификации эффективно работающих кишечных бактерий, которые взаимодействуют при перепрограммировании ожирения, и персонализации диеты для оптимизации функций микробиоты кишечника с целью поддер








