БОЛЕЗНЬ ПАРКИНСОНА: ОТКРЫТИЕ И ИНГИБИРОВАНИЕ МЕТАБОЛИЗМА ЛЕВОДОПЫ КИШЕЧНЫМИ БАКТЕРИЯМИ
РЕЦЕНЗИИ - РАЗДЕЛ «ВЗРОСЛЫЕ»
Автор: проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и питания больницы Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы

Levodopa (L-DOPA) Parkinson's disease drug, molecular model. L-DOPA is a precursor of the catecholamine neurotransmitters dopamine, norepinephrine and epinephrine and is used in the treatment of Parkinson's disease. Atoms are represented as wires. A map of electrostatic potential surrounds the molecule.
Об этой статье
Автор
Комментарии к оригинальной статье Рекдала (Rekdal) с соавт. (Science 2019)
Микробиота кишечника человека метаболизирует лекарственное средство от болезни Паркинсона леводопу (L-дофу), потенциально снижая доступность лекарственного средства и вызывая побочные действия. Однако неизвестны микроорганизмы, гены и ферменты, ответственные за такую активность у пациентов и их чувствительность к ингибированию таргетированными для хозяина лекарственными средствами. Здесь авторы описывают межвидовой путь кишечного бактериального метаболизма L-дофы. После превращения L-дофы в дофамин с помощью пиридоксальфосфат-зависимой тирозиндекарбоксилазы из Enterococcus faecalis следует трансформация дофамина в m-тирамин с помощью молибден-зависимой дегидроксилазы из Eggerthella lenta. Эти ферменты позволяют прогнозировать метаболизм лекарственных средств микробиотой кишечника человека. Хотя лекарство, которое таргетировано в отношении декарбокилазы ароматических аминокислот хозяина, не предотвращает декарбоксилирование L-дофы кишечной микробиотой, авторы идентифицировали соединение, которое ингибирует эту активность в микробиоте пациентов с болезнью Паркинсона и повышает биодоступность L-дофы у мышей.
ЧТО УЖЕ ИЗВЕСТНО ПО ДАННОЙ ТЕМЕ?
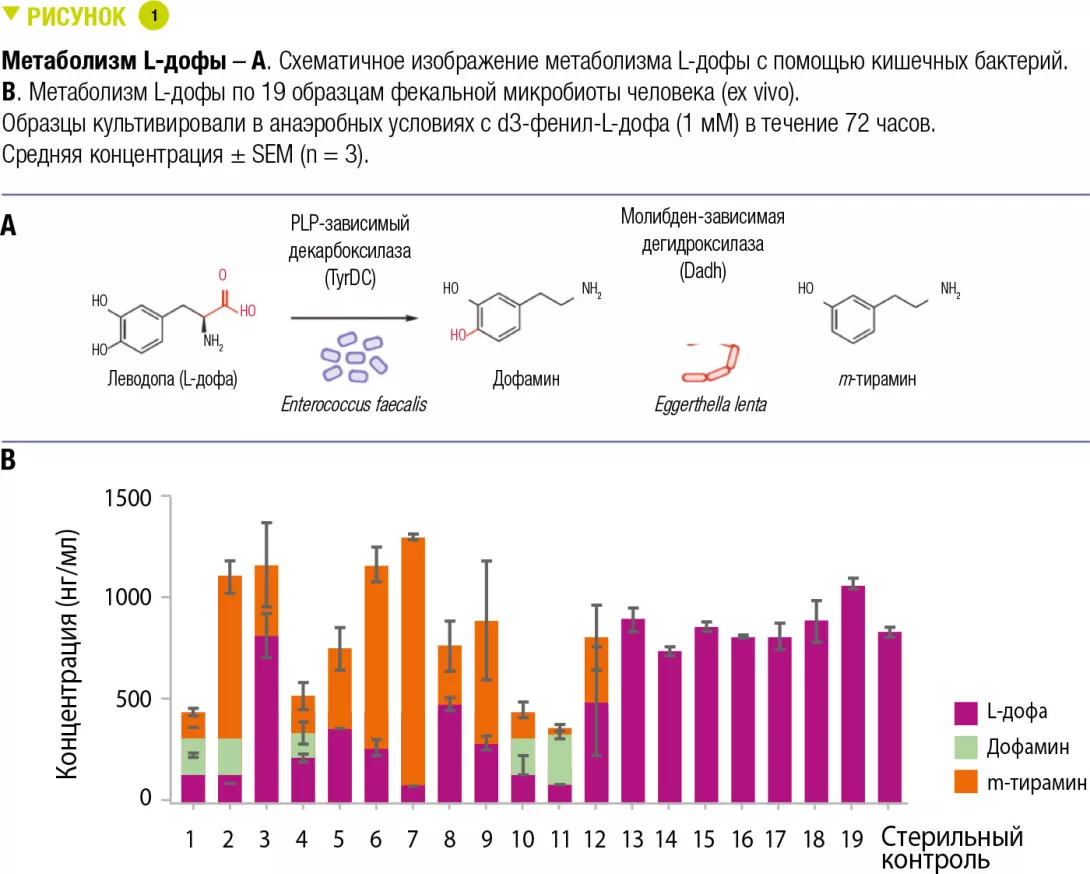
Болезнь Паркинсона – тяжело протекающее неврологическое заболевание, от которого страдает более 1 % населения мира в возрасте 60 лет и выше. Основное лекарство, которое используют для лечения болезни Паркинсона, – леводопа (L-дофа) [2]. Для эффективного воздействия, L-дофа должна попасть в головной мозг, где фермент человеческого организма декарбоксилаза ароматических аминокислот (AADC) превратит его в нейротрансмиттер дофамин. Однако желудочно-кишечный тракт также является основным местом декарбоксилирования L-дофы, и ее метаболизм представляет собой проблему, поскольку дофамин, образовавшийся на периферии, не может пересечь гематоэнцефалический барьер и вызывает нежелательные побочные эффекты. Таким образом, L-дофу вводят одновременно с лекарствами, блокирующими периферический метаболизм, включая ингибитор AADC карбидопу. Даже с этими лекарствами до 56% L-дофа не достигает головного мозга. Кроме того, эффективность и побочные эффекты лечения L-дофой крайне неоднородны у пациентов с болезнью Паркинсона, и их вариабельность нельзя полностью объяснить различиями в метаболизме хозяина. Предыдущие исследования у людей и на животных моделях продемонстрировали, что микробиота кишечника может метаболизировать L-дофу [3]. Основной предлагаемый путь включает первичное декарбоксилирование L-дофы до дофамина, после чего следует превращение дофамина в m-тирамин с помощью реакции дегидроксилирования.
Хотя продемонстрировано, что эти метаболические процессы происходят в комплексных образцах микробиоты кишечника, неизвестны отдельные микроорганизмы, гены и ферменты, отвечающие за это. Неясно также влияние, оказываемое таргетированными для хозяина ингибиторами, такими как карбидопа, на метаболизм L-дофы в кишечной микрофлоре. В качестве первого этапа по отношению к пониманию действия микробиоты кишечника на терапию болезни Паркинсона, авторы решили выявить молекулярную основу метаболизма L-дофы и дофамина кишечной микробиотой.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
-
Некоторые кишечные бактерии могут метаболизировать L-дофу до дофамина и затем до m-тирамина, что ограничивает их доступность в мозге
-
Микробиота кишечника играет роль в эффективности и токсичности лечения L-дофа пациентов с болезнью Паркинсона
-
Использование специфического ингибитора бактериального метаболизма L-дофы может повысить биодоступность L-дофы и тем самым усилить ее эффективность
КАКОВЫ ОСНОВНЫЕ ВЫВОДЫ ПО ЭТОМУ ИССЛЕДОВАНИЮ?
Авторы выдвинули гипотезу, что декарбоксилирование L-дофы потребовало бы зависимого от пиридоксальфосфата (PLP) фермента. Они получили геномы кишечных бактерий и идентифицировали консервативную тирозин декарбоксилазу (TyrDC) в Enterococcus faecalis (рисунок 1A). Генетические и биохимические эксперименты показали, что TyrDC одновременно декарбоксилирует как L-дофу, так и ее предпочтительный субстрат, тирозин. Затем они использовали обогащенное культивирование, чтобы выделить дофамин-дегидроксилирующий штамм Eggerthella lenta (рисунок 1A). Транскриптомный анализ показал, что ферментом, отвечающим за эту активность, является зависимая от молибденового кофактора дегидроксилаза дофамина (Dadh). Неожиданно, что присутствие этого фермента в геномах кишечных бактерий не коррелировало с метаболизмом дофамина. Вместо этого, об активности предупреждал однонуклеотидный полиморфизм (SNP) в гене dadh. Метаболизм L-дофы по этому пути был различным у разных субъектов (рису- нок 1B). В кишечной микробиоте пациентов с болезнью Паркинсона содержание E. faecalis, TyrDC и SNP dadh коррелировало с метаболизмом L-дофы и дофамина, что подтверждает существование такой связи. Авторы затем продемонстрировали, что ингибитор человеческого AADC карбидопа оказывал лишь минимальное влияние на декарбоксилирование L-дофы E. faecalis и был полностью неэффективен в образцах комплексной кишечной микробиоты пациентов, что подтверждает, что это средство, вероятно, не предотвращает микробный метаболизм L-дофы in vivo. Учитывая предпочтительность TyrDC в отношении тирозина, авторы проверили «имитатор» тирозина и идентифицировали (S)-α-фторметилтирозин (AFMT) в качестве селективного ингибитора декарбоксилирования L-дофы бактериями кишечника. Совместное вве- дение AFMT с L-дофой и карбидопой мышам, колонизированным E. faecalis, повышало концентрацию L-дофы в сыворотке крови.
КАКОЕ ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ ИМЕЮТ ЭТИ РЕЗУЛЬТАТЫ?
Эти данные показывают, что кишечная микробиота может метаболизировать L-дофу и тем самым влиять на эффективность и побочное действие этого лекарственного средства. Исследование показывает перспективы открытия прогностических биомаркеров эффективности и токсичности L-допы. Кроме того, поскольку известны базовые молекулярные механизмы, имеется возможность использовать специфичные ингибиторы кишечного микробного метаболизма L-дофы у пациентов, чья микробиота содержит бактерии, оказывающие неблагоприятное воздействие.
ЗАКЛЮЧЕНИЕ
Кишечная микробиота у некоторых пациентов с болезнью Паркинсона может метаболизировать L-дофу. Это может быть базовым фактором неоднородной эффективности и побочных действий такого способа лечения при болезни Паркинсона. Решением может стать использование ингибиторов этого бактериального метаболизма. В более общем смысле это исследование предоставляет новые данные касательно роли кишечной микробиоты в фармакокинетике и фармакодинамике лекарственных средств. Это открывает многообещающие перспективы в области, которую можно назвать «фармакомикробиомикой».








