El eje microbiota-intestino-cerebro en el síndrome del intestino irritable
Síntesis
Por el Pr. Premysl Bercik
Facultad de Ciencias de la Salud, Universidad McMaster, Instituto Farncombe de Investigación de la Salud Digestiva Familiar, Facultad de Ciencias de la Salud, Hamilton, Canadá
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
El Síndrome del intestino irritable (SII), caracterizado por dolor abdominal y alteración de los hábitos de defecación, es el trastorno gastrointestinal funcional más común y suele estar acompañado de enfermedades psiquiátricas concomitantes. No se conoce del todo su fisiopatología, pero parece que una alteración de la comunicación intestino-cerebro subyace en su génesis, un proceso en el que la microbiota desempeña una función importante. La composición de la microbiota y su actividad metabólica varía entre pacientes con SII y sujetos sanos de control, pero no se han identificado perfiles específicos. Sin embargo, el trasplante de microbiota fecal de pacientes con SII a ratones axénicos les induce una disfunción intestinal, una activación inmunitaria y un comportamiento alterado, signos similares a los observados en los pacientes, lo que sugiere una relación causal. Además, el tratamiento con antibióticos o probióticos mejora los síntomas en algunos casos de SII. Para optimizar el abordaje de los pacientes con SII, es necesario comprender mejor las interacciones entre el microbioma y el anfitrión que desembocan en síntomas intestinales y enfermedades psiquiátricas concomitantes, así como descubrir nuevos biomarcadores que identifiquen a quienes podrían beneficiarse de tratamientos dirigidos a la microbiota.
62% de los encuestados consideran que el consumo de probióticos es favorable para el mantenimiento de un equilibrio y un buen funcionamiento de las microbiotas
Síndrome del intestino irritable
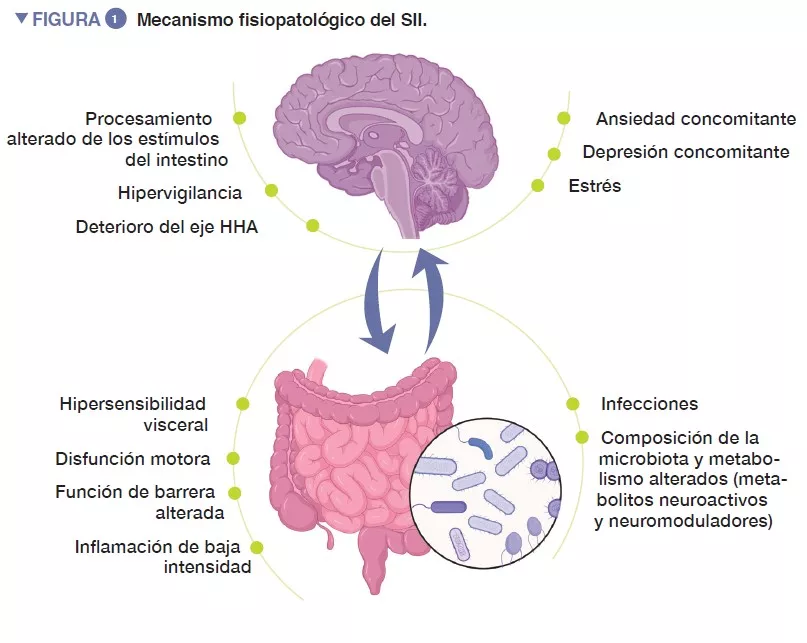
El Síndrome del intestino irritable (SII) es un trastorno funcional gastrointestinal caracterizado por un dolor abdominal recurrente, asociado a cambios en la frecuencia o en la forma de las deposiciones, en ausencia de otros trastornos orgánicos. Según los criterios de Roma IV, el SII se clasifica en cuatro subtipos: SII con estreñimiento predominante (SII-C), SII con diarrea predominante (SII-D), de hábito deposicional de tipo mixto (SII-M) o SII indeterminada (SII-I), es decir, que no se puede clasificar en los criterios de SII-C, D o M [1]. Varias enfermedades psiquiátricas concomitantes, como la ansiedad, la depresión y la somatización son habituales en pacientes con SII (Figura 1).
Aunque parece que las tasas de prevalencia del SII varían entre distintos países, se calcula que afecta aproximadamente a 1 de cada 10 personas en todo el mundo [2]. La SII puede aparecer a cualquier edad, pero su inicio se suele producir entre los 20 y 30 años. Las mujeres tienen casi dos veces más riesgo de tener síntomas de SII que los hombres, y también declaran que notan más cansancio y padecen más enfermedades psiquiátricas concomitantes. La calidad de vida de los pacientes con SII se ve gravemente perjudicada, ya que interfiere en su vida diaria, y a menudo les obliga a faltar al trabajo o a clase. La carga económica del SII en los sistemas sanitarios y en la sociedad es cuantiosa, tanto por sus costes directos como indirectos. El coste directo medio anual de los pacientes con SII se estimó en 1363 euros, a lo que hay que añadir que los pacientes faltan al trabajo una media de 8 a 22 días al año.
La fisiopatología del SII no se conoce en su totalidad, pero, en general, se debe a una alteración en el eje intestino-cerebro, una vía de comunicación bidireccional entre el tracto digestivo y el sistema nervioso central. Es posible que intervengan multitud de mecanismos subyacentes, incluso factores periféricos como una hipersensibilidad visceral, una motilidad alterada, una mayor permeabilidad intestinal y una inflamación de baja intensidad. Entre los factores principales, parece que desempeñan una función importante un procesamiento alterado de las señales del intestino, la hipervigilancia y el estrés, así como enfermedades psiquiátricas concomitantes, como la ansiedad y la depresión. En la última década, se ha prestado una atención cada vez mayor a la microbiota intestinal como factor clave en el SII.
Datos principales
- El SII se caracteriza por un dolor abdominal y una alteración de los hábitos de defecación.
- Su prevalencia se encuentra en torno al 11 %, afecta a las mujeres de forma predominante y tiene un notable impacto socioeconómico.
- Su fisiopatología no se conoce del todo, se considera una alteración de la interacción intestino-cerebro.
El microbioma en el síndrome del intestino irritable
Hay múltiples pruebas que implican a la microbiota intestinal en el SII, tanto de estudios clínicos como de modelos animales. En primer lugar, una gastroenteritis bacteriana es el mayor factor de riesgo de un SII, dado que aparecen síntomas crónicos en el 11-14 % de los pacientes tras una infección aguda por Campylobacter, Salmonella, Shigella, Escherichia coli o Clostridioides difficile [3]. Los datos clínicos sugieren que son factores de riesgo para el SII el sexo femenino, una edad joven, la gravedad de la infección y una morbilidad psiquiátrica previa. Además, se han identificado variantes en los genes relacionados con la permeabilidad intestinal, el reconocimiento de bacterias y las respuestas inmunitarias innatas.
La segunda línea de pruebas viene de estudios clínicos que han demostrado que ciertos antibióticos pueden mejorar los síntomas en una proporción de pacientes con SII [4]. Por otro lado, también hay datos clínicos que sugieren que el consumo de antibióticos, con una probable disbiosis intestinal subsiguiente, puede desembocar en la aparición de síntomas. Y, por último, numerosos ensayos clínicos sugieren que hay probióticos específicos que mejoran síntomas del SII como el dolor abdominal, la diarrea o la distensión abdominal.
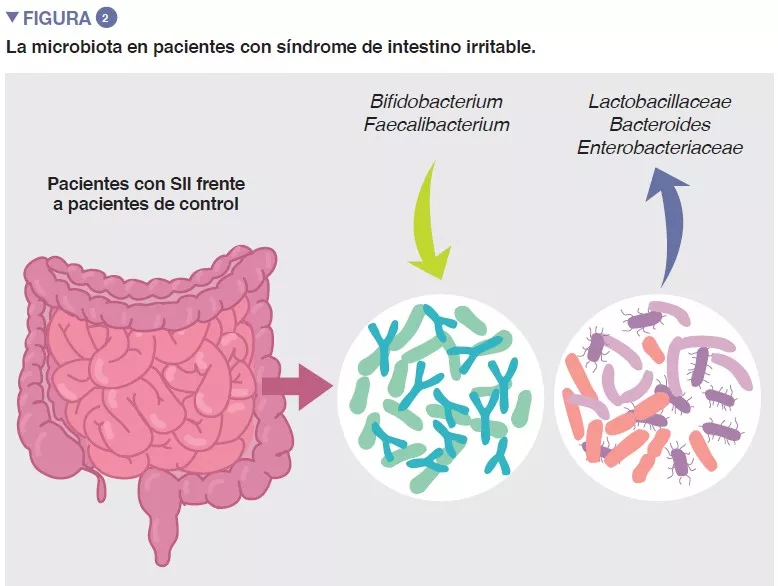
La población bacteriana que prolifera en el intestino, denominada de forma colectiva como microbiota intestinal, es uno de los principales determinantes de la homeostasis del intestino. Los datos acumulados muestran que la composición microbiana del intestino y su actividad metabólica difieren entre pacientes con SII y controles sanos, y se asocian a síntomas intestinales, además de a la ansiedad y la depresión. Sin embargo, los resultados de estudios individuales son muy variables y parece que no se puede atribuir un único perfil microbiano al SII. A pesar de esto, un reciente metaanálisis ha identificado a varias características microbianas, como un aumento en las familias Enterobacteriaceae y Lactobacillacea y en el género Bacteroides, así como una disminución en Clostridiales no cultivados, y en los géneros Faecalibacterium y Bifidobacterium en pacientes con SII, en comparación con controles sanos (Figura 2) [5]. También existen múltiples metabolitos bacterianos o del anfitrión que se encuentran alterados en pacientes con SII, como la fosfatidilcolina, la dopamina, el ácido p-hidroxibenzoico, los ácidos biliares, la triptamina y los metabolitos de la histamina. Sin embargo, todos estos hallazgos sugieren una asociación, aunque no demuestran una causalidad.
Un modelo de ratones con microbiota humanizada es una interesante herramienta para establecer la relación causal de la microbiota intestinal en el SII, y para estudiar los mecanismos subyacentes que conducen a una disfunción intestinal. Utilizamos la microbiota fecal de pacientes con SII-D y de edad y sexo similar a la de los controles sanos para colonizar ratones axénicos y los estudiamos pasadas 4 semanas. En los ratones colonizados con microbiota de SII-D se observó un tránsito gastrointestinal más rápido, cambios en la función de barrera intestinal e inflamación intestinal de baja intensidad, en comparación con ratones colonizados con microbiota de personas sanas [6]. Además, los ratones que habían sido colonizados con microbiota de pacientes con ansiedad comórbida también desarrollaron un comportamiento ansioso, lo que sugiere que el trasplante de microbioma de pacientes con SII a ratones no sólo altera la función intestinal, sino que también deteriora la comunicación intestino-cerebro. Esta anomalías funcionales se asociaron a cambios en múltiples redes de genes neuroinmunes, así como a cambios en numerosos metabolitos microbianos y del anfitrión. Curiosamente, el tratamiento con un probiótico normalizó el tránsito gastrointestinal y el comportamiento ansioso en ratones con microbiota de SII-D, lo que se asoció a cambios en los perfiles de la microbiota y en la producción bacteriana de indol. Todo ello reafirma la idea de que el microbioma intestinal desempeña una función clave en la comunicación intestino- cerebro [7].
Datos principales
- Una gastroenteritis bacteriana es el factor de riesgo más importante para el SII.
- Los tratamientos dirigidos a la microbiota (antibióticos, probióticos) pueden mejorar los síntomas del SII.
- Los perfiles de la microbiota y el metabolismo difieren en pacientes con SII y en controles sanos.
- El trasplante de microbiota de pacientes con SII a ratones axénicos puede provocar una disfunción intestinal y cerebral.
Eje microbiotaintestino- cerebro
El eje intestino-cerebro es un sistema de comunicación bidireccional entre el intestino y el cerebro integrado a través de la señalización neural, hormonal e inmunológica. Cada vez hay más pruebas que sugieren que la microbiota intestinal desempeña un papel clave en la comunicación entre el tracto gastrointestinal y el sistema nervioso central. La mayoría de datos se han obtenido de estudios en animales [8]. Los ratones axénicos tienen un comportamiento anormal, asociado a cambios en la expresión de varios genes y de la química del cerebro, a una alteración de la barrera hematoencefálica, a cambios en la morfología de las regiones cerebrales implicadas en el control del estado de ánimo y la ansiedad (la amígdala y el hipocampo), a una alteración del perfil de mielinización y plasticidad, así como a defectos generales en la microglía cerebral. La mayoría de estas anomalías se normalizan tras una colonización bacteriana. La microbiota también modifica el comportamiento en ratones convencionales, ya que la administración de antimicrobianos no absorbibles puede aumentar su comportamiento exploratorio, acompañado de cambios en el factor neurotrófico derivado del cerebro (BDNF) en el hipocampo y en la amígdala. También se han descrito cambios en el comportamiento causados por antibióticos en pacientes con tratamiento por infecciones agudas o durante la erradicación de una infección crónica por Helicobacter pylori; este trastorno fue acuñado como psicosis inducida por antibióticos. Curiosamente, un reciente estudio poblacional de gran envergadura ha descubierto que el consumo de antibióticos en la segunda infancia se asociaba a un mayor riesgo de padecer trastornos mentales posteriormente.
Sin embargo, el caso más evidente del eje microbiota-intestino-cerebro viene de pacientes con encefalopatía hepática asociada a una cirrosis, que se manifiesta con cambios en el comportamiento, el estado de ánimo y la cognición [9]. Se ha observado una mejora espectacular de la función cerebral tras la administración de antibióticos o laxantes en estos pacientes, y estudios recientes sugieren que se puede lograr una mejora similar mediante el trasplante de microbiota fecal.
En los últimos años, numerosos estudios han investigado el microbioma intestinal en pacientes con trastornos psiquiátricos como la depresión mayor y la ansiedad generalizada, y han descubierto que los perfiles microbianos diferían entre los pacientes y los controles sanos. Además, una transferencia de microbiota de pacientes a roedores axénicos o tratados con antibióticos provocó ansiedad y comportamientos de tipo depresivo. Esto nos lleva a plantearnos si esos probióticos, que tuvieron efectos beneficiosos en el comportamiento y la química cerebral en modelos animales, podrían utilizarse para tratar a pacientes con enfermedades psiquiátricas. Los resultados de los pocos estudios realizados hasta ahora sugieren que los probióticos, si se utilizan como tratamiento complementario, podrían mejorar los síntomas de algunos pacientes con trastorno depresivo mayor [10].
Realizamos un ensayo clínico aleatorizado (ECA) en pacientes con SII y depresión concomitante para evaluar los efectos de un probiótico que tuvo efectos beneficiosos en el comportamiento y en la química cerebral en varios modelos con ratones [11]. Descubrimos que, en comparación con el placebo, un tratamiento probiótico de 6 semanas mejoró las puntuaciones de depresión y los síntomas generales del SII. Esto se asoció a cambios en la activación neuronal en la amígdala y otras regiones cerebrales involucradas en el control del estado de ánimo, según se estudió mediante imágenes de resonancia magnética funcional. Esto sugiere que algunos probióticos pueden producir metabolitos neuroactivos que podrían aprovecharse no sólo para el tratamiento de pacientes con trastornos funcionales del intestino, sino también para aquellos con problemas de salud mental. Sin embargo, se necesitan estudios clínicos más rigurosos para confirmar y validar estos hallazgos.
Datos principales
- La microbiota intestinal modifica el comportamiento, así como la química y la estructura del cerebro en modelos animales.
- Los datos clínicos sugieren que el microbioma está implicado en la cognición y en los trastornos del estado de ánimo, como la encefalopatía hepática, la depresión mayor y la ansiedad generalizada.
- Es posible que ciertos probióticos específicos mejoren el comportamiento depresivo de los pacientes, pero se necesitan más datos clínicos para confirmar estos hallazgos.
Conclusión
El síndrome del intestino irritable es un trastorno gastrointestinal funcional habitual con frecuentes enfermedades psiquiátricas asociadas, que afecta negativamente a la calidad de vida de los pacientes y tiene importantes repercusiones socioeconómicas. Su fisiopatología no se conoce del todo, pero posiblemente se debe a varios factores, y se considera una alteración de la interacción intestino-cerebro. La microbiota intestinal parece desempeñar una función clave en el SII, posiblemente a través de interacciones con el sistema inmunitario o neural, aunque se deben elucidar los mecanismos subyacentes exactos. Las bacterias intestinales tienen la capacidad de influir en el comportamiento y la estructura del cerebro, y es posible que algunos probióticos sean beneficiosos para el tratamiento tanto de disfunciones del intestino como del cerebro.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016: 150: 1393-407.
2 Black CJ, Ford AC. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nat Rev Gastroenterol Hepatol 2020; 17: 473-86.
3 Barbara G, Grover M,Bercik P, et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology 2019; 156: 46-58.
4 Ford AC, Harris LA, Lacey BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
5 Pittayanon R, Lau JT, Yuan Y, et al. Gut microbiota in patients with irritable bowel syndrome - a systematic review. Gastroenterology 2019; 157: 97-108.
6 De Palma G, Lynch MD, Lu J, et al. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Sci Transl Med 2017; 9: eaaf6397.
7 Constante M, De Palma G, Lu J, et al. Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse model of irritable bowel syndrome. Neurogastroenterol Motil 2021; 33: e13985.
8 Morais LH, Schreiber HL, 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol 2021; 19: 241-55.
9 Acharya C, Bajaj JS. Chronic liver diseases and the microbiome-translating our knowledge of gut microbiota to management of chronic liver disease. Gastroenterology 2021; 160: 556-72.
10 Nikolova VL, Cleare AJ, Young AH, Stone JM. Updated review and meta-analysis of probiotics for the treatment of clinical depression: adjunctive vs. stand-alone treatment. J Clin Med 2021; 10: 647.
11 Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology 2017; 153: 448-59.






