El trasplante de microbiota fecal supera la resistencia al tratamiento con anti-PD-1 en pacientes con melanoma
Artículo comentado - Adulto
Por el Pr. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Comentario sobre el artículo de Davar et al. Science 2021 [1]
La inmunoterapia anti-PD-1 (proteína de muerte celular programada 1) ofrece beneficios clínicos a largo plazo a pacientes con un melanoma avanzado, aunque algunos pacientes son resistentes a estos tratamientos. La composición de la microbiota intestinal está relacionada con la eficacia de esta terapia en modelos preclínicos y en pacientes con cáncer. Con el objetivo de determinar si se puede superar la resistencia a la terapia anti-PD-1 modificando la mic robiota intestinal, este ensayo clínico evaluó la seguridad y la eficacia del trasplante de micro biota fecal (TMF) de sujetos con respuesta al tratamiento anti-PD-1 en pacientes con melanoma resistente a la PD-1. Esta combinación fue bien tolerada, produjo un beneficio clínico en 6 de los 15 pacientes evaluados e indujo una modificación rápida y duradera de la microbiota. En los pacientes que respondieron bien al tratamiento se observó una mayor abundancia de taxones que anteriormente se habían asociado a una respuesta a la inmunoterapia con anti- PD-1, como Faecalibacterium prausnitzii y Akkermansia muciniphila, una mayor activación de linfocitos CD8+ y una menor frecuencia de células mieloides que expresan la interleucina 8. Los pacientes que respondieron bien al tratamiento tenían firma s proteómicas y metabolómicas distintas, y el análisis bioinformático confirmó que el microbioma intestinal regulaba estos cambios. En conjunto, estos resultados muestran que un TMF asociado a una inmunoterapia con anti-PD-1 modificó el microbioma intestinal y reprogramó el microambiente tumoral para superar la resistencia a la terapia anti-PD-1 en un subconjunto de melanomas.
¿Qué se sabe ya sobre este tema?
El bloqueo de los puntos de control inmunitarios con anticuerpos monoclonales dirigidos a la proteína de muerte celular programada 1 (PD-1) ofrece beneficios clínicos a largo plazo en casi el 40 % de los pacientes con melanoma avanzado [2]. Además de los mecanismos tumorales intrínsecos que subyacen a la resistencia a los agentes anti-PD-1, el microbioma intestinal es un importante regulador tumoral extrínseco de las respuestas a los agentes anti-PD-1 [3]. En ratones, la composición del microbioma intestinal modula la actividad terapéutica de los anti-PD-1 y de los anticuerpos dirigidos contra su ligando (PD-L1). Es más, la administración de ciertas bacterias intestinales comensales o el trasplante de microbiota fecal (TMF) mejoran la eficacia de los agentes anti-PD-1 en ratones con melanoma [4]. Aunque varios estudios han señalado que un microbioma intestinal favorable se asocia a una respuesta a los anti-PD-1 en pacientes con cáncer, aún no se conoce exactamente su composición precisa. Específicamente en el melanoma, hay especies bacterianas clave pertenecientes a varios filos, en concreto Actinobacterias (Bifidobacteriaceae spp. y Coriobacteriaceae spp.) y Firmicutes (F. prausnitzii), que se asocian a una respuesta favorable a los agentes anti-PD-1 con una concordancia limitada entre las especies identificadas en varios estudios. No se ha estudiado la cuestión de si el tratamiento de transferencia de microbiota puede superar la resistencia a la anti-PD-1 en pacientes con melanoma avanzado. Para responder a esta cuestión, los autores diseñaron un estudio clínico abierto con un solo grupo para evaluar la seguridad y la eficacia del TMF obtenido de pacientes con melanoma en quienes se observó una respuesta a largo plazo a los agentes anti-PD-1 (R), en pacientes con melanoma metastásico resistente a los anti-PD-1.
Puntos clave
- La microbiota intestinal está implicada en la respuesta a los anti-PD-1 en oncología
- El TMF podría permitir superar la resistencia a los anti-PD-1 en un subconjunto de pacientes con melanoma resistente
- Es posible que algunas bacterias intestinales, como F. prausnitzii y Akkermansia muciniphila, estén implicadas en estos efectos
¿Cuáles son los principales resultados aportados por este estudio?
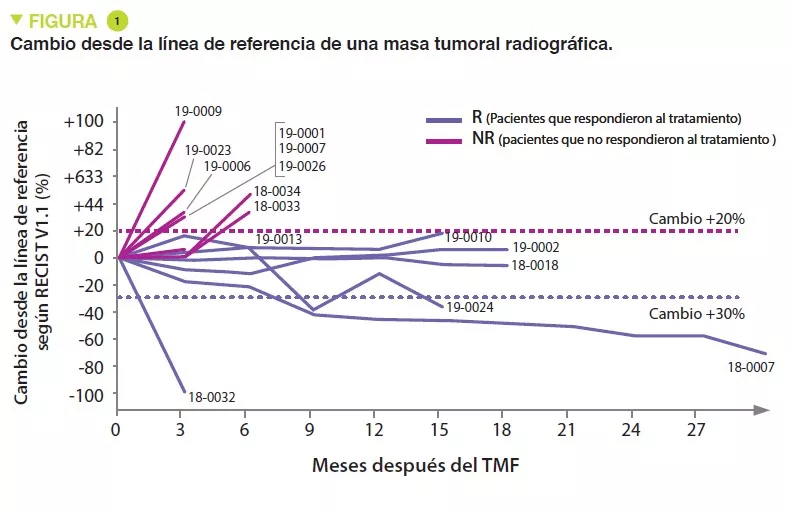
Se incluyeron 16 pacientes con melanoma primario resistente al tratamiento anti-PD-1 entre junio de 2018 y enero de 2020. Para tratar a los 16 pacientes se utilizaron siete donantes, de los cuales cuatro mostraron una respuesta completa (RC) y tres una respuesta parcial (RP), con una mediana de supervivencia sin progresión (SSP) de 56 meses (intervalo: 45 a 70 meses). Se administró un único TMF de un solo donante con pembrolizumab, seguido de pembrolizumab adicional cada 3 semanas hasta el empeoramiento de la enfermedad o hasta llegar a una toxicidad insoportable. Se realizaron evaluaciones radiográficas cada 12 semanas y la respuesta se clasificó según los criterios RECIST v1.1 (Figura 1). La microbiota intestinal de los receptores (obtenida antes del TMF, después cada semana durante 12 semanas, y después a intervalos de 3 semanas) y los donantes se analizó mediante secuenciación de escopeta (shotgun sequencing). Se hizo un seguimiento medio de 12 meses a los pacientes. Uno de los pacientes no se pudo evaluar, por lo que los resultados se refieren a 15 pacientes.
No se atribuyó ningún efecto secundario grave al TMF. Se observaron respuestas objetivas en 3 pacientes y en otros 3 se produjo una estabilización que duró > 12 meses.
La composición de la microbiota intestinal de los receptores se vio modificada por el TMF. En los pacientes que respondieron al tratamiento (Rs), la composición de la microbiota intestinal fue significativamente similar a la del donante, al contrario de lo que ocurrió en los que no respondieron al tratamiento (NRs). La mayoría de taxones que aumentaron significativamente en los Rs pertenecían al tipo Firmicutes (familias Lachnospiraceae y Ruminococcaceae) y Actinobacteria (familias Bifidobacteriaceae y Coriobacteriaceae), mientras que la mayoría de bacterias que se redujeron en los Rs pertenecían al tipo Bacteroidetes.
En general, aunque una colonización exitosa tras el TMF no siempre restableció la sensibilidad de los pacientes con melanoma resistente a la terapia anti-PD-1, la respuesta clínica se asoció a la implantación del TMF. Ya se han identificado varias especies de bacterias asociadas a la respuesta clínica (B. longum, Colinsella aerofaciens y F. prausnitzii).
El análisis inmunológico demostró que la respuesta al TMF se asociaba a la activación de los linfocitos CD8+. Los niveles de varias citocinas y quimiocinas circulantes disminuyeron tras el TMF en los Rs, incluida la MCP1, la IL-8 y la IL-18 (asociadas a la resistencia a los anti-PD-1), y la IL-12p70 y el IFN-γ (asociados a una respuesta antitumoral de los linfocitos T).
Por último, un análisis bioinformático mostró que la abundancia de comensales, que aumentó en los pacientes Rs (F. prausnitzii y A. muciniphila) se relacionaba con parámetros de laboratorio favorables, como un descenso de los niveles de IL-8.
¿Cuáles son las consecuencias en la práctica?
Este estudio sugiere que el TMF podría superar la resistencia a los anti-PD-1 en un subconjunto de pacientes con melanoma resistente. A pesar de que los resultados siguen siendo preliminares, confirman los resultados de un estudio previo publicado recientemente [5] y animan a realizar estudios controlados a mayor escala.
Conclusión
Este estudio abierto con un solo grupo sugiere que el TMF podría superar la resistencia a la terapia anti-PD-1 en un subconjunto de pacientes con melanoma resistente. Si se confirman los resultados en estudios realizados a mayor escala, la combinación de la modulación de la microbiota con la inmunoterapia podría revolucionar el tratamiento del cáncer.
1 Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021; 371 : 595-602.
2 Larkin J, Lao CD, Urb a WJ, et al. Efficacy and Safety of Nivolumab in Patients With BRAF V600 Mutant and BRAF Wild-Type Advanced Melanoma. A Pooled Analysis of 4 Clinical Trials. JAMA Oncol 2015 ; 1 : 433-40.
3 Finlay BB, Goldszmid R, Honda K, et al. Can we harness the microbiota to enhance the efficacy of cancer immunotherapy? Nat Rev Immunol 2020 ; 20 : 522-8.
4 Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97-103.
5 Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy- refractory melanoma patients. Science 2021 ; 371 : 602-9.






