ТРАНСПЛАНТАЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ ПОЗВОЛЯЕТ ПРЕОДОЛЕТЬ РЕЗИСТЕНТНОСТЬ К АНТИ-PD-1 ТЕРАПИИ У ПАЦИЕНТОВ С МЕЛАНОМОЙ
КОММЕНТАРИИ К СТАТЬЕ РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, Больница Сен-Антуан, Париж, Франция
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Комментарий к статье Davar et al. Science 2021 [1]
Иммунотерапия с помощью препаратов, блокирующих белок программируемой гибели клеток-1 (PD-1), приносит долгосрочную клиническую пользу пациентам с распространенной меланомой, даже несмотря на возникающую в ряде случаев устойчивость к терапии. Состав кишечной микробиоты коррелирует с эффективностью этой терапии в доклинических моделях и у онкологических пациентов. Для определения того, можно ли преодолеть резистентность к анти-PD-1 путем модификации кишечной микробиоты, в этом клиническом исследовании оценивали безопасность и эффективность трансплантации фекальной микробиоты (ТФМ) от пациентов с меланомой и ответом на анти-PD-1 пациентам с рефрактерностью к анти-PD-1. Процедура хорошо переносилась, при этом у 6 из 15 пациентов отмечена клиническая польза наряду с быстрым и стойким изменением микробиоты. У пациентов с ответом на лечение отмечалось повышенное содержание таксонов, ранее ассоциированных с ответом на анти-PD-1, таких как Faecalibacterium prausnitzii и Akkermansia muciniphila, повышенная активация CD8+ Т-клеток и снижение доли миелоидных клеток, экспрессирующих интерлейкин-8. Также у них наблюдались различные протеомические и метаболические изменения, контролируемые микробиомом кишечника. В совокупности эти результаты показывают, что ТФМ в сочетании с анти-PD-1 терапией изменяет микробиом кишечника и перепрограммирует микроокружение опухоли на преодоление устойчивости к анти-PD-1 у некоторых пациентов с меланомой.
ЧТО МЫ УЖЕ ЗНАЕМ?
Блокада иммунных контрольных точек моноклональными антителами, нацеленными на белок программируемой гибели клеток-1 (PD-1), приносит долгосрочную клиническую пользу почти 40% пациентов с распространенной меланомой [2]. В дополнение к внутренним опухолевым механизмам резистентности к анти-PD-1, микробиом кишечника является основным внешним регулятором ответа со стороны опухоли на анти-PD-1 терапию [3]. У мышей микробиом кишечника способен модулировать терапевтическую активность анти-PD-1 и антител, направленных против лиганда PD-1 (PD-1L). Кроме того, введение некоторых комменсальных кишечных бактерий или трансплантация фекальной микробиоты (ТФМ) повышает эффективность анти-PD-1 препаратов у мышей с меланомой [4]. Хотя положительные эффекты микробиома кишечника в отношении ответа на анти-PD-1 у онкологических пациентов отмечали в нескольких исследованиях, точные его характеристики, связанные с наблюдаемыми эффектами, еще не полностью изучены. По данным исследований, с благоприятным ответом на анти-PD-1 терапию при меланоме ассоциируются такие бактерии, как Actinobacteria (Bifidobacteriaceae spp. и Coriobacteriaceae spp.) и Firmicutes (F. prausnitzii). Вопрос, позволяет ли трансплантация микробиоты преодолеть резистентность к анти-PD-1 у пациентов с распространенной меланомой, не изучался. Чтобы ответить на него, авторы разработали открытое несравнительное клиническое исследование для оценки безопасности и эффективности ТФМ от пациентов с меланомой и долгосрочным ответом на анти-PD-1 терапию (R) пациентам с метастатической меланомой, рефрактерной к анти-PD-1.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Микробиота кишечника влияет на ответ злокачественной опухоли на терапию анти-PD-1 препаратами
- ТФМ может помочь преодолеть резистентность к анти-PD-1 у части пациентов с рефрактерной меланомой
- Это может происходить благодаря некоторым кишечным бактериям, таким как F. prausnitzii и A. muciniphila
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
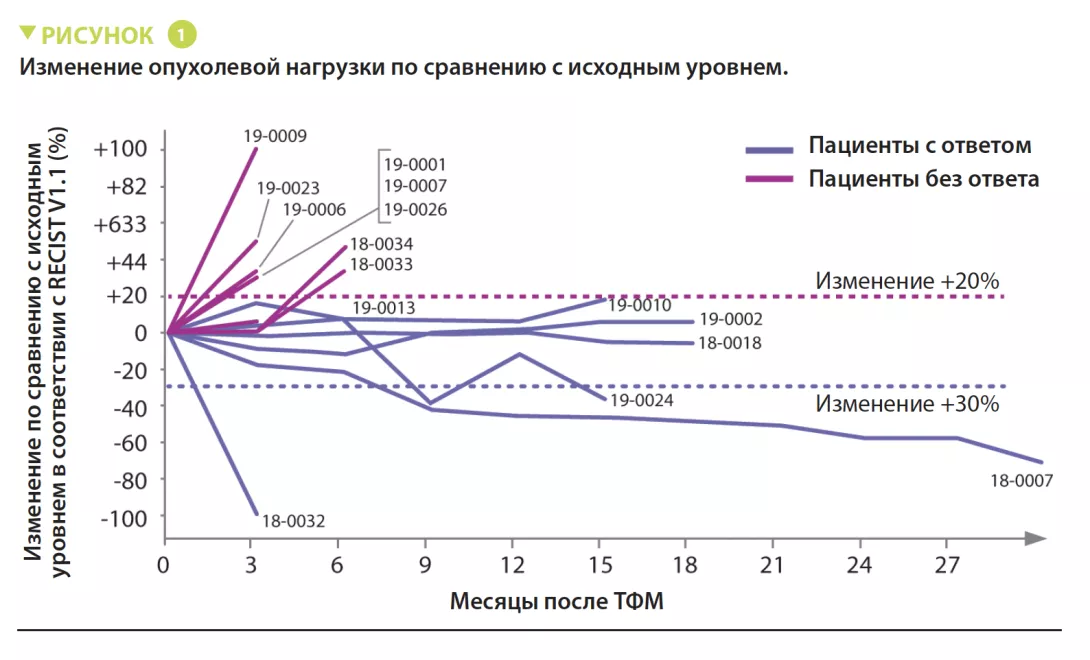
В период с июня 2018 года по январь 2020 года в исследование были включены 16 пациентов с первичной меланомой, рефрактерной к лечению анти-PD-1. Для лечения 16 пациентов использовали материал 7 доноров, 4 из которых имели полный ответ (ПО) и 3 — частичный ответ (ЧО), с медианой выживаемости без прогрессирования (ВБП) 56 месяцев (диапазон: от 45 до 70 месяцев). Каждый пациент получил один трансплантат фекальной микробиоты от одного донора одновременно с получением пембролизумаба. Далее пациенты продолжали получать пембролизумаб каждые 3 недели пока заболевание прогрессировало или неприемлемой токсичности. Рентгенографические оценки проводились каждые 12 недель, а ответ оценивали в соответствии с критериями RECIST v1.1 (рисунок 1). Микробиоту кишечника доноров и реципиентов, собранную до ТФМ, а затем каждую неделю в течение 12 недель и далее каждые 3 недели, анализировали с помощью секвенирования методом дробовика. Пациенты находились под наблюдением в среднем 12 месяцев. Заболевание 1 пациента не поддавалось оценке, поэтому в анализ вошли данные 15 пациентов.
Серьезных побочных эффектов ТФМ отмечено не было. Объективные ответы наблюдались у 3 пациентов, а стабилизация продолжительностью > 12 месяцев наблюдалась еще у 3 пациентов.
Кишечная микробиота у реципиентов претерпела изменения после ТФМ. Состав микробиоты у пациентов, ответивших на лечение, был схож с составом микробиоты доноров, чего нельзя было сказать о пациентах, не ответивших на лечение. У ответивших пациентов отмечалось увеличение содержания представителей филумов Firmicutes (Lachnospiraceae и Ruminococcaceae) и Actinobacteria (Bifidobacteriaceae и Coriobacteriaceae), тогда как у пациентов без ответа наблюдалось уменьшение содержания представителей тип Bacteroidetes.
Хотя успешная колонизация после ТФМ не всегда восстанавливала чувствительность меланомы к анти-PD-1 терапии, в целом наступившие клинические ответы были связаны с ТФМ. Ряд видов бактерий, ассоциированных с клиническим ответом (B. longum, Colinsella aerofaciens и F. prausnitzii), уже был описан ранее.
Результаты иммунологического анализа показали, что ответ на ТФМ был связан с активацией CD8+ Т-клеток. У пациентов с ответом после ТФМ отмечалось снижение уровней нескольких циркулирующих цитокинов, включая MCP1, ИЛ-8 и ИЛ-18 (связанных с резистентностью к PD-1), ИЛ-12p70 и ИФН-γ (связанных с противоопухолевым ответом со стороны Т-клеток).
По данным сетевого анализа повышение содержания комменсалов F. prausnitzii и A. muciniphila у этих пациентов коррелировало с благоприятными лабораторными изменениями, такими как снижение уровня ИЛ-8.
ЧТО ЭТО ЗНАЧИТ НА ПРАКТИКЕ?
Результаты исследования показывают, что ТФМ может помочь преодолеть резистентность к анти-PD-1 терапии у части пациентов с рефрактерной меланомой. Хотя это предварительные результаты, они подтверждают выводы предыдущего исследования [5] и выступают в пользу проведения новых контролируемых и более масштабных исследований.
ЗАКЛЮЧЕНИЕ
Результаты открытого несравнительного исследования показали, что ТФМ может помочь преодолеть резистентность к PD-1 терапии у некоторых пациентов с рефрактерной меланомой. Если эти результаты будут подтверждены в масштабных контролируемых исследованиях, подход в виде модуляции микробиоты на фоне иммунотерапии может совершить революцию в терапии онкологических заболеваний.
1 Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021; 371 : 595-602.
2 Larkin J, Lao CD, Urb a WJ, et al. Efficacy and Safety of Nivolumab in Patients With BRAF V600 Mutant and BRAF Wild-Type Advanced Melanoma. A Pooled Analysis of 4 Clinical Trials. JAMA Oncol 2015 ; 1 : 433-40.
3 Finlay BB, Goldszmid R, Honda K, et al. Can we harness the microbiota to enhance the efficacy of cancer immunotherapy? Nat Rev Immunol 2020 ; 20 : 522-8.
4 Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97-103.
5 Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy- refractory melanoma patients. Science 2021 ; 371 : 602-9.








