ОСЬ КИШЕЧНИК — ГОЛОВНОЙ МОЗГ И СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА
ОБЗОР
Проф. Премысл Берцик (Premysl Bercik)
Факультет медицинских наук, Университет МакМастер, Научно-исследовательский институт здоровья и пищеварительной системы семьи Фарнкомб, Факультет медицинских наук, Гамильтон, Канада
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
СРК или синдром раздраженного кишечника характеризуется болью в животе и изменением привычного ритма опорожнения кишечника. Он является наиболее распространенным функциональным расстройством желудочно-кишечного тракта и часто сопровождается психическими нарушениями. Патофизиология заболевания полностью не изучена, но считается, что СРК возникает в результате нарушения коммуникации между кишечником и головным мозгом, причем важную роль в этом процессе играет микробиота. Состав микробиоты и ее метаболическая активность различаются у пациентов с СРК и здоровых людей, однако каких-то специфических профилей микробиоты выявлено не было. Трансплантация фекальной микробиоты от пациентов с СРК мышам, в организме которых не содержатся микроорганизмы, вызывает дисфункцию кишечника, активацию иммунной системы и изменение поведения мышей, аналогичные таковым у пациентов, что предполагает существование причинно-следственной связи. Кроме того, лечение антибиотиками или пробиотиками улучшает симптомы у некоторых пациентов с СРК. Чтобы предложить пациентам с СРК более эффективное лечение нужно изучить взаимодействия между микрофлорой и организмом, которые приводят к симптомам со стороны кишечника и психическим нарушениям. Немаловажен поиск новых биомаркеров, позволяющих отбирать пациентов, которые могут извлечь наибольшую пользу от лечения, направленного на микробиоту.
62% опрошенных считают, что потребление пробиотиков помогает поддерживать здоровый баланс и функцию микробиоты
СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА
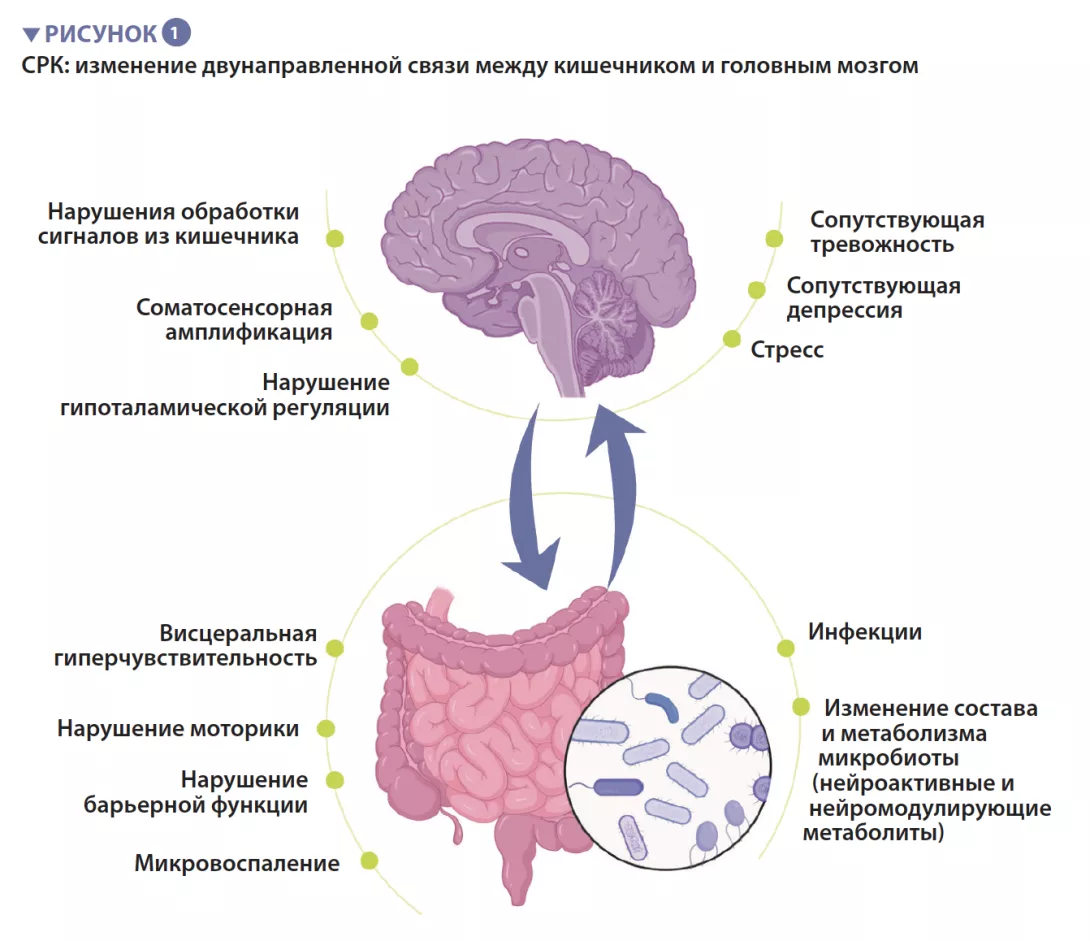
Синдром раздраженного кишечника — это функциональное желудочно-кишечное расстройство, характеризующееся рецидивирующей болью в животе, которая связана с изменениями частоты дефекации или формы кала при отсутствии какого-либо органического расстройства. Согласно римским критериям (ROME IV), выделяют 4 подтипа СРК: СРК с преобладанием запора (СРК-З), СРК с преобладанием диареи (СРК-Д), смешанный вариант (СРК-С) и неклассифицированный вариант (СРК-Н), который не соответствует критериям СРК-З, Д или С [1]. У пациентов с СРК часто встречаются сопутствующие психические нарушения, такие как тревожность, депрессия и соматические расстройства (рисунок 1).
Хотя распространенность СРК различается в разных странах, по оценкам, от этого заболевания страдает приблизительно каждый десятый человек во всем мире [2]. СРК может развиться в любом возрасте, но его начало обычно приходится на период от 20 до 30 лет. У женщин СРК возникает почти в два раза чаще, чем у мужчин. Также у женщин отмечается более выраженная утомляемость и сопутствующие психические нарушения. Качество жизни пациентов с СРК серьезно ухудшается, что нарушает повседневную жизнь, снижая возможность работать или учиться. Экономическое бремя СРК для систем здравоохранения и общества довольно велико и включает как прямые, так и косвенные издержки. Среднегодовые прямые затраты на пациентов с СРК составляют около 1363 евро, плюс пропуск от 8 до 22 рабочих дней в год.
Патофизиология СРК полностью не изучена, но в целом болезнь возникает из-за нарушения функционирования осикишечник — головноймозг, т.е.д в у н а п р а в л е н н о й с в я з и м е ж д у пищеварительным трактом и центральной нервной системой. Предположительно она включает в себя несколько основных механизмов, в том числе периферические ф а к т о р ы , т а к и е к а к в и с ц е р а л ь н а я г и п е р ч у в с т в и т е л ь н о с т ь , и з м е н е н и я моторики, повышение проницаемости кишечника и микровоспаление. Центральные факторы включают нарушения обработки сигналов, поступающих из кишечника, соматосенсорную амплификацию, стресс, а т а кже с о п у т с т в ующи е п с и х и ч е с к и е н а р у ш е н и я , т а к и е к а к т р е в о ж н о с т ь и д е п р е с с и я . В т е ч е н и е п о с л е д н е г о десятилетия все больше внимания уделяется микробиоте кишечника как ведущей причине развития СРК.
Основные факты
- СРК характеризуется болью в животе и изменением привычного ритма опорожнения кишечника.
- Распространенность составляет около 11%, чаще возникает у женщин и оказывает значимое социально- экономическое воздействие.
- Патофизиология не до конца изучена, подозревается роль нарушений взаимодействия между кишечником и головным мозгом.
ОСОБЕННОСТИ МИКРОБИОМА ПРИ СИНДРОМЕ РАЗДРАЖЕННОГО КИШЕЧНИКА
В к л и н и ч е с к и х и с с л е д о в а н и я х и экспериментах на животных показана связь между кишечной микробиотой и СРК. Во- первых, бактериальный гастроэнтерит является самым сильным фактором риска СРК, при этом у 11–14% пациентов после острой инфекции, вызванной Campylobacter, S a l m o n e l l a , S h i g e l l a , E s c h e r i c h i a c o l i или Clostridioides difficile, развиваются хронические симптомы [3]. Клинические наблюдения показывают, что женский пол, более молодой возраст, степень тяжести инфекции и существующие психические нарушения являются факторами риска СРК. Также выявлены варианты генов, связанных с проницаемостью кишечника, распознаванием бактерий и врожденным иммунным ответом.
Результаты клинических исследований показали, что некоторые антибиотики могут улучшить симптомы у части пациентов с СРК [4]. С другой стороны, клинические данные также показывают, что применение антибиотиков может вызывать дисбиоз кишечника с последующим появлением с и м п т о м о в С Р К . Н а к о н е ц , д а н н ы е многочисленных клинических исследований п о к а з а л и с п о с о б н о с т ь н е к о т о р ы х пробиотиков улучшать симптомы СРК, такие как боль в животе, диарея или вздутие живота.
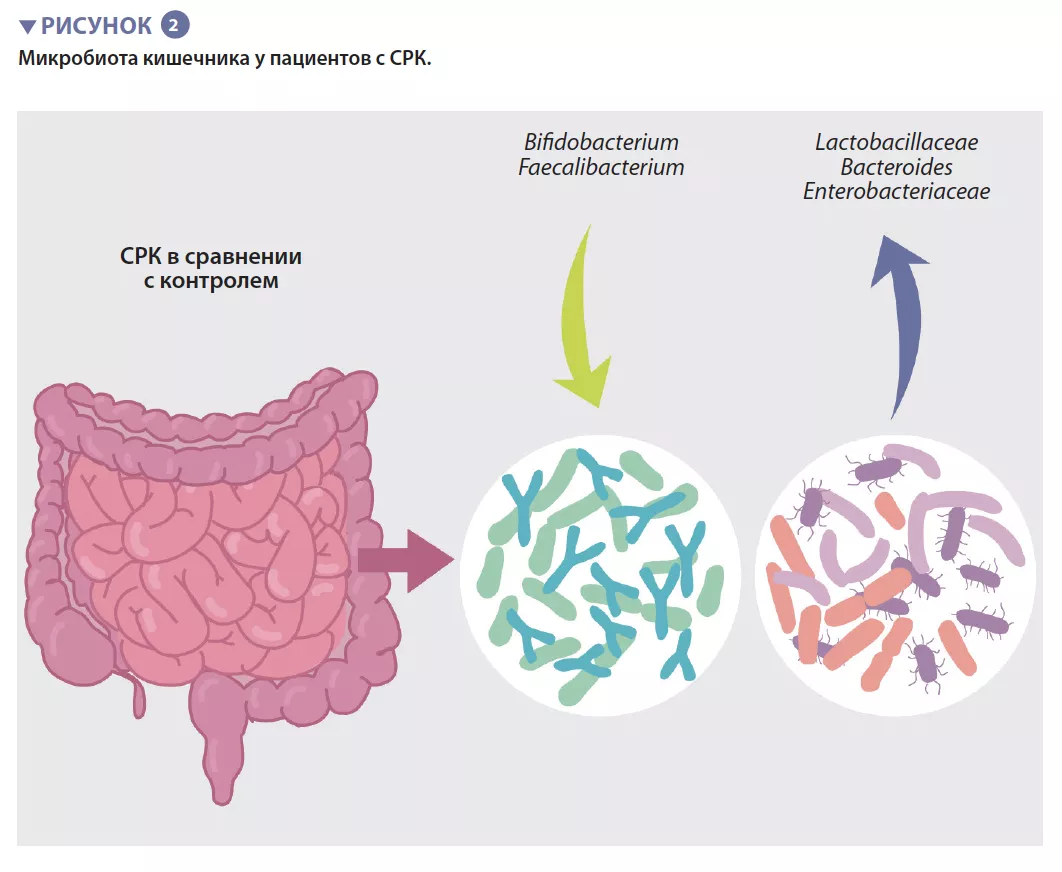
Бактериальная популяция, обитающая в кишечнике, в совокупности называемая кишечной микробиотой, является одним из основных определяющих факторов п о д д е р ж а н и я к и ш е ч н о г о г о м е о с т а з а . Накопленные данные показывают, что м и к р о б н ы й с о с т а в к и ш е ч н и к а и е г о метаболическая активность связаны с кишечными симптомами, тревожностью, д е п р е с с и е й и р а з л и ч а ю т с я м е ж д у пациентами с СРК и здоровыми людьми. О д н а к о и с с л е д о в а н и я п о к а з ы в а ю т , что уникального микробного профиля, который можно было бы отнести к СРК, не существует. Авторы недавнего мета- анализа выявили несколько особенностей м и к р о б и о т ы , в к л ю ч а я у в е л и ч е н и е содержания представителей семейств Enterobacteriaceae, Lactobacillaceae и рода Bacteroides наряду со снижением содержания некультивируемых видов Clostridiales, родов Faecalibacterium и Bifidobacterium у пациентов с С Р К п о с р а в н е н и ю с о з д о р о в ы м и людьми (рисунок 2) [5]. Также обнаружено множество бактериальных метаболитов или метаболитов микробов хозяина, содержание которых изменяется у пациентов с С Р К , в к л ю ч а я ф о с ф а т и д и л х о л и н , дофамин, р-гидроксибензойную кислоту, желчные кислоты, триптамин и метаболиты гистамина. Однако все это ничего не говорит о существовании реальной причинно- следственной связи.
Мышиная модель человеческой микробиоты я в л я е т с я ц е н н ы м и н с т р у м е н т о м д л я установления причинной роли микробиоты кишечника в развитии СРК и изучения основных механизмов, приводящих к дисфункции кишечника. Мы использовали фекальную микробиоту пациентов с СРК-Д и здоровых людей соответствующего возраста и пола для колонизации кишечника стерильных мышей и исследовали их через 4 недели. По сравнению с мышами, получивших микробиоту от здоровых людей, у экспериментальных мышей отмечалось уменьшение времени кишечного транзита, снижение барьерных функций кишечника и развитие микровоспаления [6]. Также у экспериментальных мышей развилось тревожное поведение: предполагается, ч т о т р а н с п л а н т а ц и я м и к р о б и о м а о т пациентов с СРК в организм мыши не только изменяла функцию кишечника, но и нарушала коммуникацию между кишечником и головным мозгом. Эти функциональные нарушения были связаны с изменениями экспрессии многих нейроиммунных генов, а также уровней различных микробных и мышиных метаболитов. Добавление в корм пробиотиков нормализовало кишечный транзит и купировало тревожное поведение у мышей с микробиотой от пациентов с СРК-Д, что ассоциировалось с изменениями профилей микробиоты и выработкой бактериального индола, подтверждая гипотезу о том, что микробиом кишечника играет ключевую роль в коммуникации между кишечником и головным мозгом [7].
Основные факты
- Бактериальный гастроэнтерит — наиболее значимый фактор риска СРК.
- Лечение, направленное на микробиоту (антибиотики, пробиотики), может улучшить симптомы СРК.
- Профили микробиоты и метаболизм у пациентов с СРК и здоровыми людьми различаются.
- Трансплантация микробиоты от пациентов с СРК стерильным мышам может вызвать нарушение функций кишечника и головного мозга.
ОСЬ КИШЕЧНИК — ГОЛОВНОЙ МОЗГ
Ось кишечник — головной мозг представляет собой двунаправленную систему связи между кишечником и мозгом посредством нейронной, гормональной и иммунологической сигнализации. Все больше данных показывает, что микробиота кишечника играет ключевую роль в коммуникации между желудочно-кишечным трактом и центральной нервной системой, причем большинство данных было получено из исследований на животных [8]. Стерильные мыши демонстрируют аномальное поведение, связанное с изменениями экспрессии множества генов и химических процессов в головном мозге, проницаемости гематоэнцефалического барьера, морфологии различных областей головного мозга, участвующих в контроле настроения и тревожности (миндалевидное тело и гиппокамп), профиля миелинизации и пластичности нейронов, а также диффузными нарушениями микроглии головного мозга. Большинство этих аномалий нормализуются после бактериальной колонизации кишечника. Микробиота также изменяет поведение обычных мышей, поскольку введение антимикробных препаратов, не всасывающихся в кишечника, может повысить у них поисковое поведение наряду с изменением содержания нейротрофический фактор мозга (BDNF) в гиппокампе и миндалевидном теле. Изменения в поведении на фоне применения антибиотиков также были описаны у пациентов, получавших лечение острых инфекций или во время эрадикации хронической инфекции Helicobacter pylori. Это состояние было названо «антибиотик-индуцированный психоз». Интересно, что, по данным недавнего крупного популяционного исследования, использование антибиотиков в раннем детстве было связано с повышенным риском развития психических расстройств в более старшем возрасте.
Однако наиболее очевидные доказательства существования оси кишечник — головной мозг поступают от пациентов с цирроз-ассоциированной печеночной энцефалопатией, которая проявляется изменениями поведения, настроения и когнитивных функций [9]. После приема антибиотиков или слабительных средств у этих пациентов наступает резкое улучшение функций головного мозга, а недавние исследования показали, что аналогичное улучшение также может быть достигнуто путем трансплантации фекальной микробиоты.
В последние годы проведено несколько исследований микробиома кишечника у пациентов с психическими расстройствами, такими как большое депрессивное расстройство и генерализованное тревожное расстройство. Установлены различия микробиологических профилей у пациентов и здоровых людей. Кроме того, перенос микробиоты от пациентов к грызунам без микробов в организме или получавшим антибиотики, вызывал у последних тревожное и депрессивное поведение. В связи с этим возникает вопрос, можно ли применять пробиотики, которые показали благоприятное влияние на поведение и химию мозга в моделях на животных, для лечения пациентов с психическими заболеваниями. Результаты нескольких завершенных исследований свидетельствуют о том, что пробиотики, применяемые в качестве дополнительного лечения, могут улучшить симптомы у некоторых пациентов с большим депрессивным расстройством [10].
Мы провели пилотное рандомизированное контролируемое исследование у пациентов с СРК и сопутствующей депрессией для оценки влияния пробиотика, который оказал благоприятное влияние на поведение и химию головного мозга в нескольких мышиных моделях [11]. Мы обнаружили, что, по сравнению с плацебо, 6-недельное лечение пробиотиками улучшало показатели депрессии и общие симптомы СРК. Это было связано с изменениями активации нейронов в миндалевидном теле и других областях головного мозга, участвующих в контроле настроения, что оценивалось с помощью функциональной магнитно-резонансной томографии. Можно предположить, что некоторые пробиотики способны продуцировать нейроактивные метаболиты, которые можно использовать не только для лечения пациентов с функциональными расстройствами кишечника, но и с психическими нарушениями. Однако, чтобы подтвердить эти результаты, необходимы более строгие клинические исследования.
Основные факты
- Микробиота кишечника влияет на поведение, а также химию и структуру мозга в животных моделях.
- Клинические данные показывают, что микробиом участвует в развитии когнитивных расстройств и нарушений настроения при печеночной энцефалопатии, большом депрессивном расстройстве и генерализованном тревожном расстройстве.
- Некоторые пробиотики могут улучшить симптомы депрессии у пациентов, но для подтверждения этих результатов необходимы дополнительные клинические данные.
ЗАКЛЮЧЕНИЕ
Синдром раздраженного кишечника — распространенное функциональное желудочно-кишечное расстройство с частыми сопутствующими психическими нарушениями, которое негативно влияет на качество жизни пациентов и оказывает значительное социально-экономическое воздействие. Патофизиология СРК не до конца изучена, но, скорее всего, это мультифакториальное заболевание, в развитии которого не последнюю роль играют нарушения взаимодействия между кишечником и головным мозгом. Микробиота кишечника, по-видимому, играет ключевую роль в развитии СРК, возможно, через взаимодействие с иммунной или нервной системой, хотя точные механизмы этого еще предстоит установить. Бактерии кишечника влияют на поведение и структуру мозга, поэтому некоторые пробиотики могут быть полезны как для лечения дисфункции кишечника, так и нарушений со стороны головного мозга.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016: 150: 1393-407.
2 Black CJ, Ford AC. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nat Rev Gastroenterol Hepatol 2020; 17: 473-86.
3 Barbara G, Grover M,Bercik P, et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology 2019; 156: 46-58.
4 Ford AC, Harris LA, Lacey BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
5 Pittayanon R, Lau JT, Yuan Y, et al. Gut microbiota in patients with irritable bowel syndrome - a systematic review. Gastroenterology 2019; 157: 97-108.
6 De Palma G, Lynch MD, Lu J, et al. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Sci Transl Med 2017; 9: eaaf6397.
7 Constante M, De Palma G, Lu J, et al. Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse model of irritable bowel syndrome. Neurogastroenterol Motil 2021; 33: e13985.
8 Morais LH, Schreiber HL, 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol 2021; 19: 241-55.
9 Acharya C, Bajaj JS. Chronic liver diseases and the microbiome-translating our knowledge of gut microbiota to management of chronic liver disease. Gastroenterology 2021; 160: 556-72.
10 Nikolova VL, Cleare AJ, Young AH, Stone JM. Updated review and meta-analysis of probiotics for the treatment of clinical depression: adjunctive vs. stand-alone treatment. J Clin Med 2021; 10: 647.
11 Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology 2017; 153: 448-59.








