L'axe microbiote-intestin-cerveau dans le Syndrome de l'Intestin Irritable
Synthèse
Par le Pr Premysl Bercik
Faculté des sciences de la santé, McMaster University, Institut de recherche sur la santé digestive, Hamilton, Canada
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Le syndrome de l’intestin irritable (SII), caractérisé par une douleur abdominale et des troubles du transit, représente le trouble fonctionnel intestinal le plus fréquent ; il est aussi souvent accompagné de comorbidités psychiatriques. Ses mécanismes physiopathologiques ne sont pas totalement élucidés, mais une altération de la communication intestin-cerveau semble être à la base de sa genèse, le microbiote jouant un rôle important dans ce processus. La composition du microbiote et son activité métabolique diffèrent entre les patients présentant un SII et les témoins sains, mais il n’a pas été identifié de profils spécifiques. Toutefois, la transplantation du microbiote fécal de patients atteints de SII dans des souris exemptes de germes induit un dysfonctionnement intestinal, une activation du système immunitaire et une modification du comportement de l’hôte murin similaires à ceux observés chez les patients, ce qui suggère un lien de causalité. En outre, le traitement par antibiotiques ou probiotiques améliore les symptômes chez certains patients atteints de SII. Une meilleure compréhension des interactions microbe-hôte conduisant aux symptômes intestinaux et aux comorbidités psychiatriques, ainsi que la découverte de nouveaux biomarqueurs identifiant les individus qui pourraient tirer des bénéfices de traitements dirigés vers le microbiote, sont nécessaires pour optimiser la prise en charge des patients atteints d’un SII.
62% des répondants ont assimilé la consommation de probiotiques comme favorable au maintien d’un équilibre et du bon fonctionnement des microbiotes
Syndrome de l’intestin irritable
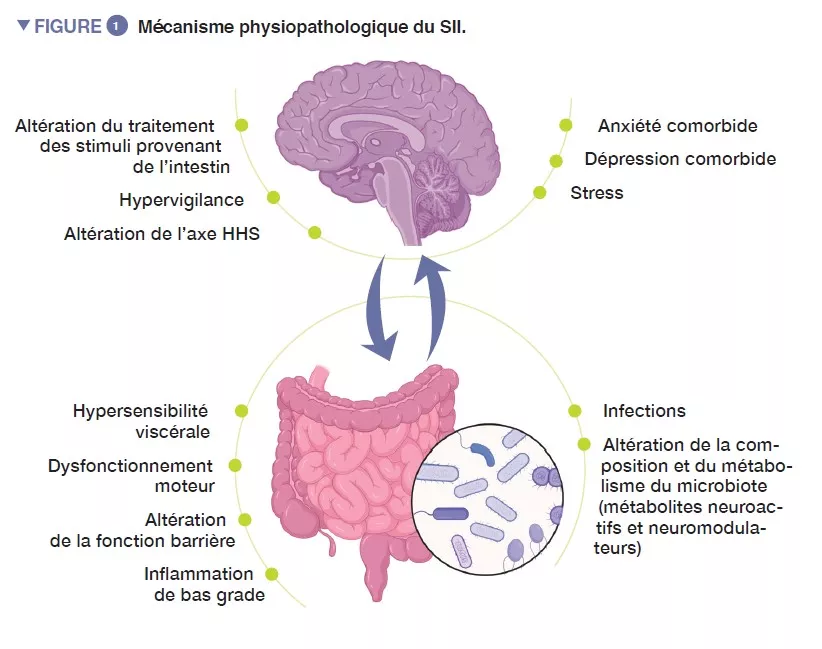
Le syndrome de l’intestin irritable (SII) est un trouble fonctionnel intestinal caractérisé par une douleur abdominale récurrente, associée à des modifications de la fréquence ou de la forme des selles, en l’absence de toute atteinte organique. En utilisant les critères ROME IV, le SII est classé en quatre sous-types : SII avec constipation prédominante (SII-C), SII avec diarrhée prédominante (SII-D), SII mixte avec une alternance de diarrhée et de constipation (SII-M) ou SII indéterminé (SII-I), qui ne répond pas aux critères de SII-C, D ou M [1]. Les comorbidités psychiatriques, comme l’anxiété, la dépression et la somatisation, sont fréquentes chez les patients atteints de SII (Figure 1).
Bien que les taux de prévalence du SII semblent varier d’un pays à un autre, on estime qu’il touche environ 1 personne sur 10 à travers le monde [2]. Le SII peut se développer à n’importe quel âge, mais il apparaît souvent entre 20 et 30 ans. La probabilité de présenter des symptômes de SII est près de deux fois plus élevée chez les femmes que chez les hommes et elles font également état d’une plus grande fatigue et de comorbidités psychiatriques plus nombreuses. La qualité de vie des patients atteints de SII est sévèrement affectée, la pathologie interférant avec leur vie quotidienne et conduisant souvent à un absentéisme scolaire ou professionnel. Le fardeau économique du SII sur les systèmes de santé et la collectivité est significatif, avec à la fois des coûts directs et indirects. Le coût direct annuel moyen des patients atteints de SII a été estimé à 1 363 euros, qui s’ajoute à un absentéisme professionnel de 8 à 22 jours par an en moyenne.
Les processus physiopathologiques du SII ne sont pas totalement élucidés, mais il a en général pour origine un dysfonctionnement de l’axe intestin-cerveau, une communication bidirectionnelle entre le tractus digestif et le système nerveux central. De nombreux mécanismes sous-jacents interviennent probablement, avec des facteurs périphériques, comme une hypersensibilité viscérale, des troubles de la motilité, une augmentation de la perméabilité intestinale et une inflammation de bas grade. Parmi les facteurs centraux, une altération du traitement des signaux provenant de l’intestin, l’hypervigilance, le stress et des comorbidités psychiatriques, comme l’anxiété et la dépression, semblent jouer un rôle important. Au cours des dix dernières années, une attention croissante a été portée au microbiote intestinal en tant qu’acteur clé dans le SII.
Faits essentiels
- Le SII est caractérisé par une douleur abdominale et des troubles du transit.
- Sa prévalence est d’environ 11 % ; il touche essentiellement les femmes et possède un impact socio-économique significatif.
- Ses mécanismes physiopathologiques ne sont pas totalement élucidés, il est considéré comme étant un trouble de l’interaction intestin-cerveau.
Le microbiome dans le syndrome de l’intestin irritable
Il existe plusieurs sources de données, provenant à la fois des études cliniques et des modèles animaux, qui impliquent le microbiote intestinal dans le SII. Tout d’abord, la gastro-entérite bactérienne constitue le plus puissant facteur de risque de SII, avec 11 à 14 % des patients développant des symptômes chroniques après une infection aiguë à Campylobacter, Salmonella, Shigella, Escherichia coli ou Clostridioides difficile [3]. Les données cliniques tendent à indiquer que le sexe féminin, le jeune âge, la sévérité de l’infection et une précédente morbidité psychiatrique constituent des facteurs de risque de SII. En outre, des variants des gènes liés à la perméabilité intestinale, à la reconnaissance des bactéries et aux réponses immunitaires innées ont été identifiés.
D’autres éléments de données proviennent d’études cliniques ayant démontré que certains antibiotiques pourraient améliorer les symptômes chez un certain nombre de patients atteints de SII [4]. D’un autre côté, les données cliniques suggèrent également que l’utilisation d’antibiotiques, et la dysbiose intestinale probable qui en résulte, peut être à l’origine de symptômes. Enfin, de nombreux essais cliniques ont suggéré que des probiotiques spécifiques améliorent les symptômes de SII, comme la douleur abdominale, la diarrhée ou les ballonnements.
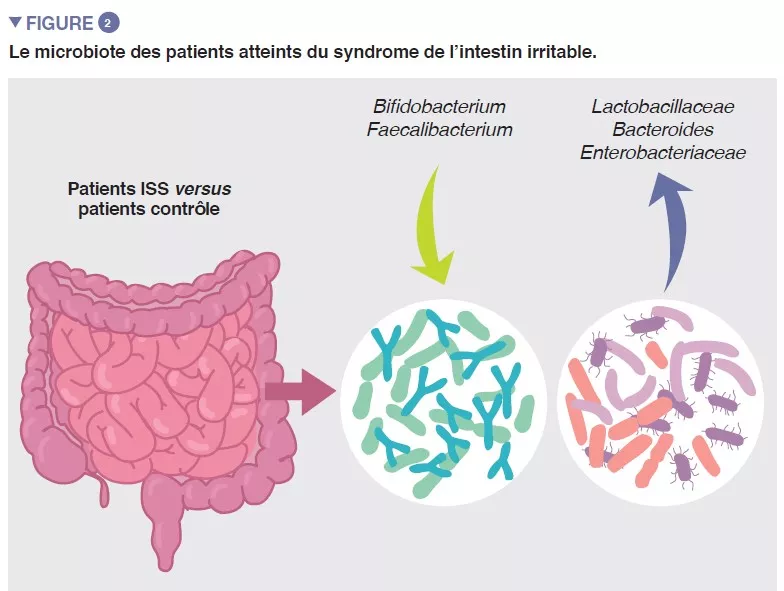
La population bactérienne prospérant dans l’intestin, collectivement désignée par microbiote intestinal, constitue l’un des principaux déterminants de l’homéostasie intestinale. Des données de plus en plus nombreuses montrent que la composition microbienne de l’intestin et son activité métabolique diffèrent entre les patients atteints de SII et les témoins sains, et qu’elles sont associées à des symptômes intestinaux, ainsi qu’à une anxiété et une dépression. Toutefois, les résultats des études individuelles sont très variables et il ne semble pas exister de profil microbien unique qui pourrait être attribué au SII . Malgré cela, une méta-analyse récente a identifié plusieurs caractéristiques microbiennes, notamment l’augmentation de la famille des Enterobacteriaceae, de la famille des Lactobacillaceae et du genre Bacteroides et la diminution de Clostridiales I non cultivées, du genre Faecalibacterium et du genre Bifidobacterium, chez les patients atteints de SII par rapport aux témoins sains (Figure 2) [5]. Il existe également de nombreux métabolites bactériens ou du microbiote de l’hôte qui sont altérés chez les patients atteints d’un SII , notamment des métabolites de la phosphatidylcholine, de la dopamine, de l’acide p-hydroxybenzoïque, des acides biliaires, de la tryptamine et de l’histamine. Toutefois, toutes ces observations suggèrent une association et non un lien de causalité.
Le modèle de microbiote humanisé chez la souris constitue un outil intéressant pour établir le rôle causal du microbiote intestinal dans le SII et pour étudier les mécanismes sous-jacents conduisant au dysfonctionnement intestinal. Nous avons utilisé le microbiote fécal de patients présentant un SII-D et de témoins sains du même âge et du même sexe pour coloniser des souris exemptes de germes et les avons étudiées 4 semaines plus tard. Les souris colonisées par le microbiote de SII-D ont développé un transit gastro-intestinal plus rapide, des modifications de la fonction barrière de l’intestin et une inflammation intestinale de bas grade, par rapport aux souris colonisées par le microbiote de témoins sains [6]. En outre, les souris colonisées par le microbiote de patients présentant une anxiété comorbide ont également développé un comportement de type anxieux, ce qui suggère que la transplantation du microbiome des patients atteints de SII dans l’hôte murin altère non seulement la fonction intestinale, mais aussi la communication intestin-cerveau. Ces anomalies fonctionnelles ont été associées à des modifications de nombreux réseaux neuro-immuns, ainsi qu’à des modifications de nombreux métabolites microbiens et de l’hôte. Il est intéressant de noter que le traitement par un probiotique a normalisé le transit gastro-intestinal et le comportement de type anxieux chez les souris avec microbiote de SII-D, ce qui a été associé à des modifications des profils du microbiote et à la production d’indole bactérien, réaffirmant le fait que le microbiome intestinal joue un rôle clé dans la communication intestin-cerveau [7].
Faits essentiels
- La gastro-entérite bactérienne est le facteur de risque de SII le plus important.
- Le traitement dirigé vers le microbiote (antibiotiques, probiotiques) peut améliorer les symptômes de SII.
- Les profils et le métabolisme du microbiote diffèrent entre les patients avec SII et les témoins sains.
- La transplantation du microbiote de patients atteints de SII dans des souris exemptes de germes peut induire un dysfonctionnement intestinal et cérébral.
Axe microbioteintestin- cerveau
L’axe intestin-cerveau est un système de communication bidirectionnelle entre l’intestin et le cerveau intégré via une signalisation neuronale, hormonale et immunologique. Des données de plus en plus nombreuses suggèrent que le microbiote intestinal joue un rôle clé dans la communication entre le tractus gastro-intestinal et le système nerveux central, la majorité des données provenant d’études animales [8]. Des souris exemptes de germes présentent un comportement anormal, associé à des modifications de l’expression de nombreux gènes et de la chimie du cerveau, une altération de la barrière hémato- encéphalique, des modifications de la morphologie de régions du cerveau impliquées dans le contrôle de l’humeur et de l’anxiété (amygdales et hippocampe), une altération du profil de myélinisation et de la plasticité, ainsi que des défauts généraux des microglies cérébrales. La plupart de ces anomalies sont normalisées après colonisation bactérienne. Le microbiote modifie également le comportement de souris conventionnelles, car l’administration d’antimicrobiens non absorbables peut accroître leur comportement exploratoire, conjointement à des modifications du facteur BDNF (Brain-Derived Neurotrophic Factor) dans l’hippocampe et les amygdales. Des modifications comportementales induites par les antibiotiques ont également été décrites chez des patients traités pour des infections aiguës ou pendant l’éradication d’une infection chronique à Helicobacter pylori ; cette affection a été qualifiée de psychose induite par les antibiotiques. Il est intéressant de noter qu’une vaste étude récente basée sur la population a montré que l’utilisation d’antibiotiques chez le très jeune enfant était associée à un risque accru de développement de troubles mentaux ultérieurs.
Toutefois, le cas le plus probant concernant l’axe microbiote-intestin-cerveau vient de patients présentant une encéphalopathie hépatique associée à une cirrhose, qui présentent des modifications du comportement, de l’humeur et des facultés cognitives [9]. Ces patients montrent une amélioration considérable de la fonction cérébrale après l’administration d’antibiotiques ou de laxatifs et des études récentes ont suggéré qu’une amélioration similaire pouvait également être obtenue par une transplantation de microbiote fécal.
Au cours de ces dernières années, de nombreuses études se sont intéressées au microbiome intestinal chez des patients présentant des troubles psychiatriques, comme une dépression majeure et une anxiété généralisée, et ont montré que les profils microbiens différaient entre les patients et les témoins sains. En outre, le transfert du microbiote des patients dans des rongeurs exempts de germes ou traités par antibiotiques a induit des comportements de type anxiété et dépression. Se pose alors la question de savoir si ces probiotiques, qui ont montré des effets bénéfiques sur le comportement et la chimie du cerveau dans des modèles animaux, pourraient être utilisés pour traiter des patients présentant des maladies psychiatriques. Les résultats des quelques études terminées jusqu’à présent suggèrent que les probiotiques, s’ils sont utilisés en tant que traitement adjuvant, pourraient améliorer les symptômes chez certains patients présentant un trouble dépressif majeur [10].
Nous avons conduit une étude clinique randomisée pilote auprès de patients présentant un SII et une dépression comorbide, afin d’évaluer les effets d’un probiotique ayant montré des effets bénéfiques sur le comportement et la chimie du cerveau dans plusieurs modèles murins [11]. Nous avons découvert que, comparativement à un placebo, un traitement probiotique de 6 semaines avait amélioré les scores de dépression et les symptômes globaux de SII. Cette amélioration était associée à des modifications de l’activation neuronale dans les amygdales et d’autres régions du cerveau intervenant dans le contrôle de l’humeur, comme évalué par imagerie par résonance magnétique fonctionnelle. Cela suggère que certains probiotiques peuvent produire des métabolites neuroactifs qui pourraient être exploités non seulement pour le traitement des patients ayant des troubles fonctionnels intestinaux, mais aussi pour ceux qui présentent des problèmes de santé mentale. Toutefois, des études cliniques plus rigoureuses sont nécessaires pour confirmer et valider ces observations.
Faits essentiels
- Le microbiote intestinal modifie le comportement ainsi que la chimie et la structure du cerveau, dans des modèles animaux.
- Les données cliniques suggèrent que le microbiome est impliqué dans les troubles cognitifs et de l’humeur, comme l’encéphalopathie hépatique, la dépression majeure et l’anxiété généralisée.
- Des probiotiques spécifiques pourraient améliorer le comportement dépressif chez les patients, mais des données cliniques supplémentaires sont nécessaires pour confirmer ces observations.
Conclusion
Le syndrome de l’intestin irritable est un trouble fonctionnel intestinal répandu, associé à de fréquentes comorbidités psychiatriques, qui nuit à la qualité de vie des patients et engendre un impact socio-économique considérable. Ses mécanismes physiopathologiques ne sont pas totalement élucidés, mais il est probablement plurifactoriel et on considère qu’il s’agit d’un trouble de l’interaction entre intestin et cerveau. Le microbiote intestinal semble jouer un rôle essentiel dans le SII, peut-être à travers des interactions avec le système immunitaire ou neuronal, bien que les mécanismes sous-jacents exacts restent à clarifier. Les bactéries intestinales ont la capacité d’agir sur le comportement et la structure cérébrale, et certains probiotiques pourraient être bénéfiques pour le traitement du dysfonctionnement à la fois intestinal et cérébral.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016: 150: 1393-407.
2 Black CJ, Ford AC. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nat Rev Gastroenterol Hepatol 2020; 17: 473-86.
3 Barbara G, Grover M,Bercik P, et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology 2019; 156: 46-58.
4 Ford AC, Harris LA, Lacey BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
5 Pittayanon R, Lau JT, Yuan Y, et al. Gut microbiota in patients with irritable bowel syndrome - a systematic review. Gastroenterology 2019; 157: 97-108.
6 De Palma G, Lynch MD, Lu J, et al. Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice. Sci Transl Med 2017; 9: eaaf6397.
7 Constante M, De Palma G, Lu J, et al. Saccharomyces boulardii CNCM I-745 modulates the microbiota-gut-brain axis in a humanized mouse model of irritable bowel syndrome. Neurogastroenterol Motil 2021; 33: e13985.
8 Morais LH, Schreiber HL, 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol 2021; 19: 241-55.
9 Acharya C, Bajaj JS. Chronic liver diseases and the microbiome-translating our knowledge of gut microbiota to management of chronic liver disease. Gastroenterology 2021; 160: 556-72.
10 Nikolova VL, Cleare AJ, Young AH, Stone JM. Updated review and meta-analysis of probiotics for the treatment of clinical depression: adjunctive vs. stand-alone treatment. J Clin Med 2021; 10: 647.
11 Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology 2017; 153: 448-59.






