Le microbiote intestinal en tant que déterminant d’une alimentation saine
Par Anissa M. Armet 1 , João F. Mota 2,3 et Jens Walter 3
1 Département des sciences agricoles, alimentaires et nutritionnelles, Université de l’Alberta, Edmonton, Alberta, Canada
2 Faculté de nutrition, Université fédérale de Goiás, Goiânia, Goiás, Brésil
3 APC Microbiome Ireland, Faculté de microbiologie, Département de médecine, et APC Microbiome Institute, University College Cork – National University of Ireland, Cork, Irlande
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Les maladies non transmissibles (MNT) chroniques ont atteint des proportions épidémiques dans les pays industrialisés, une évolution clairement liée à l’adoption d’un comportement alimentaire de type occidental. Les MNT sont également liées au microbiote intestinal, et la recherche sur des modèles animaux a établi l’importance des interactions alimentation-microbiote dans le développement des pathologies, ainsi que les mécanismes sous-jacents. Nous discutons ici de ce qui constitue une alimentation saine du point de vue de la science du microbiote et soutenons qu’une compréhension mécanistique des interactions alimentation microbiote peut éclairer les discussions sur les controverses concernant la nutrition et aider au développement de régimes plus sains.
Des données de plus en plus nombreuses montrent que le microbiote intestinal a un impact significatif sur la santé humaine. L’alimentation occupe une place centrale dans cette relation, et les habitudes alimentaires occidentales ont joué un rôle majeur dans l’exacerbation récente des maladies non transmissibles (MNT) chroniques dans les pays développés sur le plan socio-économique. Nous discutons ici de ce qui constitue une alimentation saine du point de vue de la science du microbiote et appliquons ces données pour éclairer les controverses actuelles dans le domaine de la nutrition et le développement de stratégies nutritionnelles ciblant le microbiote. Cet article se concentre sur les recommandations diététiques pour la population générale à des fins de prévention des maladies, et non pour les patients souffrant de pathologies qui ont souvent des besoins diététiques spécifiques et devraient consulter un nutritionniste ou un diététicien diplômé.
Alimentation saine du point de vue du microbiote
Aliments complets d’origine végétale versus aliments transformés
Selon toutes les recommandations que nous avons examinées [1], les aliments complets d’origine végétale (légumes, fruits, céréales complètes, légumineuses et noix) ayant subi une transformation limitée devraient constituer la majeure partie de l’alimentation quotidienne (figure 1). Les observations du microbiote confirment ces recommandations (figure 2 et 3). Les aliments complets d’origine végétale constituent la seule source naturelle de fibres alimentaires, dont certaines sont fermentescibles et fournissent des substrats de croissance pour les micro-organismes. La variété des végétaux peut maintenir la diversité du microbiote, et la fermentation des fibres produit des métabolites tels que les acides gras à chaîne courte (AGCC) qui entraînent de nombreux effets métaboliques (libération d’hormones liées à la satiété et amélioration de la sensibilité à l’insuline), physiologiques (augmentation de la production de mucus et de l’expression des jonctions serrées) et écologiques (inhibition des agents pathogènes) [2]. En outre, la fourniture de substrats pour les bactéries prévient la dégradation du mucus, l’inflammation et les infections consécutives chez les souris [3]. Les composés phytochimiques présents dans les aliments complets d’origine végétale, dont la plupart ne sont pas absorbés dans l’intestin grêle, font également l’objet d’une biotransformation par le microbiote intestinal qui augmente leur biodisponibilité, leur absorption et leurs effets antioxydants et immunomodulateurs [4], mais la signification de ces interactions sur le plan de la santé est moins bien comprise. Enfin, les caractéristiques fonctionnelles et la qualité nutritionnelle (par exemple, la composition en nutriments et l’accessibilité) de la plupart des aliments complets d’origine végétale sont largement supérieures à celles des aliments transformés, qui en outre contiennent souvent des additifs alimentaires altérant la composition du microbiote et la fonction barrière de l’intestin (figure 2).
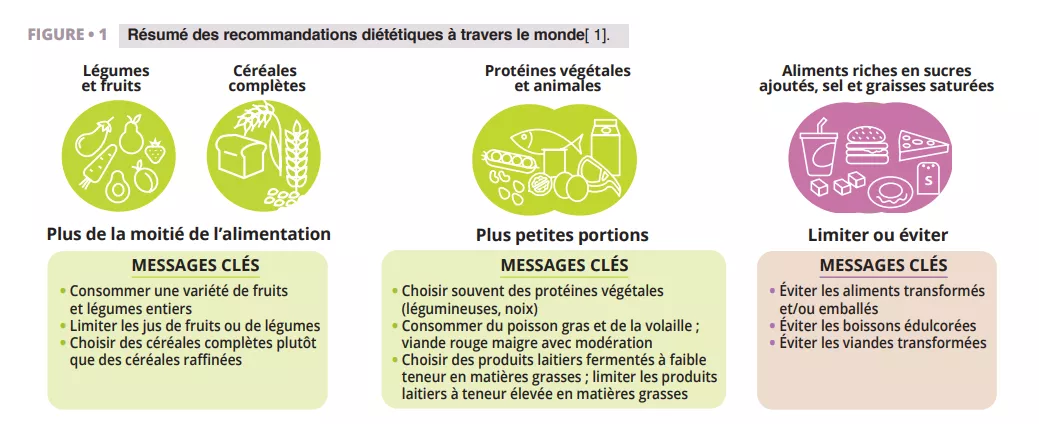
Résumé visuel des recommandations diététiques internationales : une alimentation saine repose principalement sur des fruits, légumes et céréales complètes, avec des portions modérées de protéines végétales et animales, tout en limitant les aliments transformés, riches en sucres, en sel et en graisses saturées. Ces conseils contribuent à la santé du microbiote intestinal.
Céréales complètes
Le rôle potentiel du microbiote intestinal dans les bénéfices métaboliques et immunologiques bien établis des céréales complètes est de plus en plus étudié. La couche de son des céréales complètes contient des fibres alimentaires telles que des arabinoxylanes et des β-glucanes qui sont métabolisées par le microbiote intestinal par un processus de fermentation. Les effets anti-inflammatoires des céréales complètes ont été liés à l’enrichissement des producteurs d’AGCC [5]. Kovatcheya-Datchary et al. ont démontré que des souris originellement axéniques colonisées par le microbiote fécal d’humains qui réagissent au pain complet à base de grains d’orge et qui contiennent des Prevotella, connaissent une amélioration de la tolérance au glucose qui reflète l’effet chez les humains [6]. En outre, des personnes en surpoids hébergeant la bactérie Prevotella à l’inclusion dans l’étude ont montré une perte de poids importante avec une alimentation riche en céréales complètes [7]. Ces études suggèrent qu’au moins une partie des bénéfices métaboliques des céréales complètes sont médiés par le microbiote intestinal (figure 3).

Sources de protéines
La plupart des recommandations diététiques préconisent de consommer des aliments contenant des protéines végétales (par exemple, légumineuses, noix), et du poisson (par exemple, poisson gras) et de la volaille plutôt que d’autres sources de protéines animales, en particulier la viande rouge (figure 1). Les légumineuses et les noix sont riches en fibres et contiennent des composés phytochimiques et des acides gras oméga-3 qui influencent les interactions hôte-micro-organismes (figure 3). La supplémentation quotidienne en noix et amandes a augmenté les abondances relatives des producteurs de butyrates, en particulier de Roseburia [8]. La supplémentation en haricots mungo a réduit la prise de poids et l’accumulation de graisses chez des souris recevant une alimentation riche en graisse mais pas chez les souris axéniques recevant la même alimentation, ce qui établit un rôle causal du microbiote [9]. Parmi tous les aliments contenant des protéines animales, il est probable que le poisson gras présente les plus grands bénéfices immunologiques et métaboliques liés au microbiote [1].
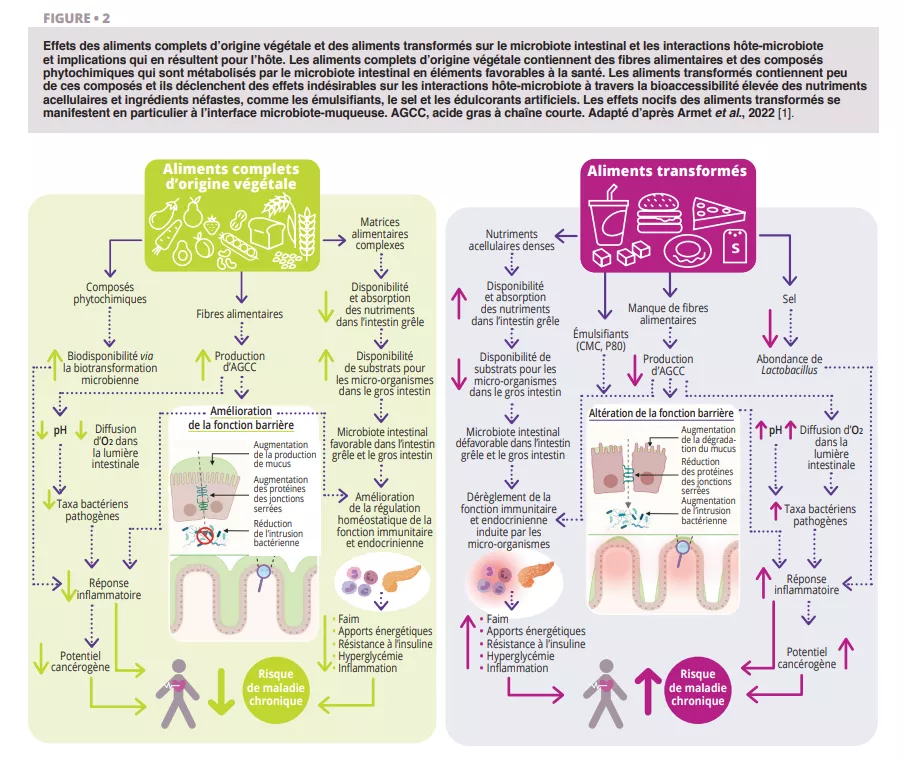
Comparaison des effets des aliments complets d’origine végétale et des aliments transformés sur la santé intestinale et le microbiote : les fibres et composés phytochimiques des aliments végétaux soutiennent le microbiote, améliorent la fonction barrière intestinale et réduisent les risques de maladies chroniques, tandis que les aliments transformés favorisent l’inflammation, perturbent le microbiote et augmentent le risque de pathologies métaboliques.
Habitudes alimentaires
La prise de conscience que la santé n’est pas principalement influencée par des aliments ou des nutriments individuels, mais par leur interconnexion et leurs effets synergiques, a conduit à souligner le rôle des régimes alimentaires dans plusieurs directives diététiques récemment mises à jour, telles que les Dietary Guidelines for Americans (directives diététiques pour les Américains) 2020-2025 et le guide alimentaire canadien. Le régime méditerranéen combine de nombreux groupes d’aliments qui ont des effets favorables sur les interactions hôte-micro-organismes. Plusieurs essais contrôlés randomisés ont été conduits pour explorer ces interactions et ont montré que les bénéfices métaboliques, immunologiques et cognitifs du régime méditerranéen étaient liés à une abondance accrue de Faecalibacterium prausnitzii et Roseburia [10].
De quelle manière le microbiote intestinal peut-il éclairer les controverses autour de l’alimentation saine ?
Viandes rouges et transformées
La plupart des recommandations diététiques et plusieurs sociétés savantes préconisent de réduire la consommation de viande rouge et d’éviter les viandes transformées, bien qu’une série d’études systématiques datant de 2019 ait conclu qu’il n’y avait que peu de preuves de leur lien avec des effets néfastes sur la santé [11]. Le microbiote intestinal apporte une perspective utile dans cette controverse. La fermentation protéolytique des protéines animales par les micro-organismes intestinaux augmente les métabolites toxiques tels que l’ammoniac, le p-crésol et le sulfure d’hydrogène [12]. Riches en graisses saturées, les viandes transformées stimulent davantage la sécrétion d’acides biliaires dans l’intestin grêle, qui sont ensuite transformés en acides biliaires secondaires par les micro-organismes. En outre, les agents de conservation utilisés dans les viandes transformées, les nitrates et les nitrites, sont des substrats pour la biotransformation microbienne en composés N-nitrosés. Les considérations toxicologiques soutiennent donc les recommandations diététiques actuelles (figure 3). Les métabolites résultant de la fermentation des protéines (par exemple, le sulfure d’hydrogène, l’ammoniac) sont moins toxiques et ne sont pas actuellement classés comme cancérogènes pour l’homme, ce qui permet de conclure qu’une consommation modérée de viande rouge maigre ne présente probablement qu’un risque limité. En revanche, les composés N-nitrosés et les acides biliaires secondaires qui résultent de la consommation de viandes transformées sont cancérogènes, ce qui va dans le sens des recommandations préconisant d’éviter ou de réduire le plus possible la consommation de viande transformée.

Recommandations centrées sur le microbiote pour une alimentation saine
- Suivre les recommandations diététiques (figure 1).
- Diversifier au maximum les sources végétales consommées et essayer d’aller au-delà des taux de fibres actuellement recommandés (25-38 grammes/jour).
- Réduire au minimum les aliments transformés contenant de grandes quantités de sucres ajoutés, de sel, de graisses saturées et trans, ainsi que les viandes transformées et les produits laitiers à forte teneur en matières grasses.
- Inclure des aliments fermentés avec des micro-organismes vivants (sans traitement thermique) à faible teneur en sucres, en graisses et en sel comme les yaourts, les légumes fermentés, le kéfir et le kombucha.
Produits laitiers
La plupart des recommandations diététiques préconisent la consommation de produits laitiers écrémés ou à faible teneur en matières grasses (0-2 %) et suggèrent d’éviter les produits laitiers à forte teneur en matières grasses (> 25%) (par exemple, certains fromages, produits à base de crème, beurre). Toutefois, il n’existe pas de consensus concernant les produits au lait entier (~ 3,5 %), qui sont déconseillés dans certaines recommandations diététiques, bien que leurs effets nocifs aient été contestés. Les interactions entre les graisses contenues dans les produits laitiers et le microbiote intestinal doivent faire partie de cette discussion. Les acides gras saturés dérivés du lait favorisent la présence de Bilophila wadsworthia, qui est pro-inflammatoire et a provoqué des maladies telles que la colite [13] chez des modèles de souris. Ces résultats mécanistiques soutiennent les recommandations diététiques visant à limiter les produits laitiers aux produits à faible teneur en matières grasses (figure 3).
Régimes pauvres en glucides
Les régimes pauvres en glucides sont populaires car ils peuvent permettre de perdre rapidement du poids et d’obtenir des bénéfices métaboliques remarquables à court terme, mais les résultats ne sont pas toujours durables. Ces régimes sont riches en matières grasses et/ou en protéines et souvent pauvres en fibres. Par conséquent, ils induisent un profil métabolique à risque, avec des concentrations accrues en composés N-nitrosés et des taux réduits de butyrates et de composés phénoliques anti-inflammatoires [14]. En raison de leurs effets sur le microbiote intestinal, les régimes pauvres en glucides pourraient donc être néfastes pour la santé lorsqu’ils sont consommés sur des périodes prolongées.

Une alimentation plus saine grâce au microbiote
Bien que les recommandations diététiques internationales soient très cohérentes et donnent d’excellentes orientations sur ce qui constitue une alimentation saine, des améliorations et des innovations restent possibles par une prise en compte plus systématique du microbiote.
Évolution et restauration du microbiote
La symbiose homme-microbiote évolue depuis des millions d’années dans des contextes environnementaux et nutritionnels très différents. L’industrialisation, qui a conduit à une augmentation importante des MNT, a appauvri la diversité du microbiote, réduit la capacité de ses enzymes à utiliser les glucides, entraîné un enrichissement en organismes et enzymes dégradant le mucus et conduit à une perte de symbiontes microbiens. Sur la base de cette évolution, il serait donc justifié d’augmenter l’apport en fibres au-delà des 25 à 38 grammes par jour actuelle ment recommandés, cet argument étant corroboré par des études tant observationnelles qu’interventionnelles [15]. Outre la promotion d’un apport accru en fibres issues d’aliments complets, il existe une puissante justification scientifique à la correction de l’impact de l’industrialisation sur le microbiote intestinal à travers des stratégies prébiotiques, probiotiques et synbiotiques. Des produits tentant de restaurer la diversité du microbiote sont déjà sur le marché, mais cette recherche et la validation clinique n’en sont qu’à leurs balbutiements (voir ci-dessous).
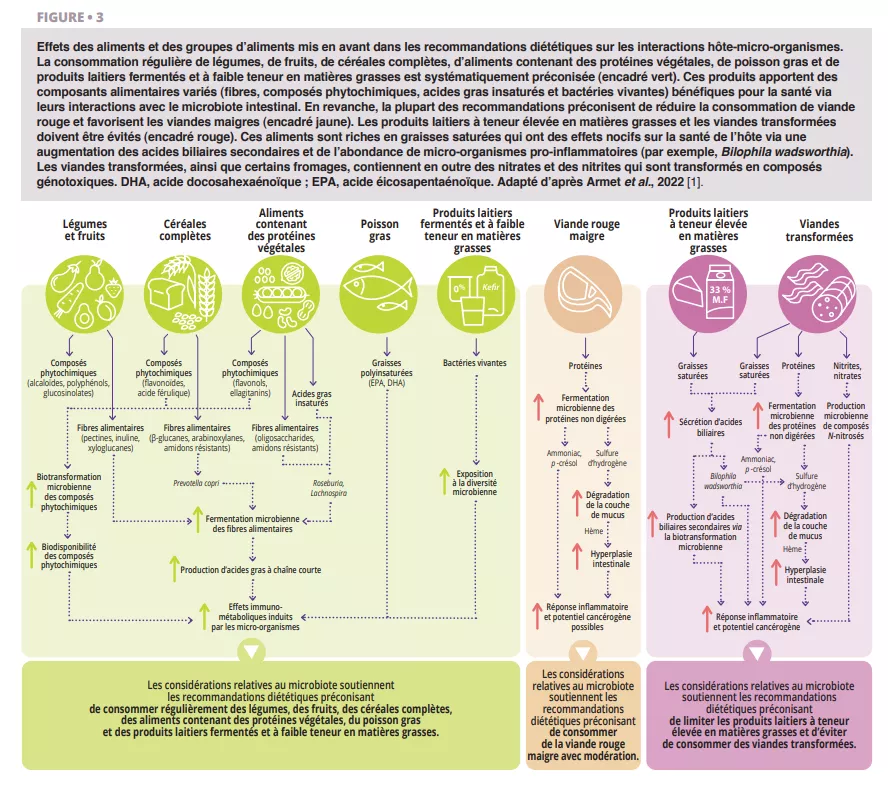
Effets différenciés des groupes d’aliments sur le microbiote intestinal : les aliments d’origine végétale, le poisson gras et les produits laitiers fermentés pauvres en matières grasses soutiennent un microbiote sain et réduisent les risques inflammatoires. Les produits transformés, riches en graisses saturées, protéines et composés nitrosés, altèrent l’équilibre microbien et augmentent les risques de maladies chroniques. Ce schéma illustre les mécanismes microbiotiques justifiant les recommandations diététiques.
Probiotiques et prébiotiques
Bien que de nombreuses études aient montré les bénéfices cliniques de l’utilisation des probiotiques et des prébiotiques pour des objectifs médicaux spécifiques, peu d’allégations de santé ont été approuvées par les agences réglementaires. En outre, il existe peu de preuves que leur consommation réduise le risque de MNT, et la grande majorité des recommandations diététiques nationales ne préconisent pas leur inclusion dans le cadre d’une alimentation saine. Il existe un fort potentiel de développement des probiotiques et des prébiotiques et leur combinaison (synbiotiques) assure une prévention plus systématique des maladies chroniques. La recherche en cours explore l’utilisation de ces stratégies pour corriger l’impact de l’industrialisation sur la diversité et la fonction du microbiote intestinal. Des produits ont été développés et commercialisés dans ce domaine, mais ils sont en attente d’une validation clinique dans le cadre d’essais cliniques randomisés bien contrôlés, et la recherche disponible est trop peu avancée pour formuler des recommandations générales.
Micro-organismes vivants
Une autre caractéristique de l’industrialisation est la réduction de l’exposition microbienne. Selon l’hypothèse de la biodiversité, un contact avec des environnements naturels est nécessaire pour enrichir le microbiote humain, favoriser l’équilibre immunitaire et assurer une protection contre les allergies et les maladies inflammatoires. Les probiotiques apportent des micro-organismes vivants et sont étudiés et commercialisés dans ce contexte depuis des décennies (voir encadré « Probiotiques et prébiotiques »). En outre, les aliments fermentés, comme le kéfir, le yaourt, le kombucha et la choucroute, peuvent, lorsqu’ils sont consommés crus, contenir un nombre important de micro-organismes vivants (bactéries et champignons). Bien que les micro-organismes présents dans les aliments fermentés ne colonisent pas l’intestin humain du fait de leur nature non native dans cet écosystème, ils restent détectables dans le microbiote fécal humain et pourraient interagir directement avec l’hôte.

Certaines recommandations diététiques intègrent les aliments fermentés, comme le yaourt et les laits fermentés, dans leurs préconisations. Leurs bénéfices sont de plus en plus fréquemment rapportés dans des études observationnelles et des essais contrôlés randomisés de plus petite taille, mais un plus grand nombre d’essais contrôlés dans l’espèce humaine sont nécessaires.
Nutrition de précision
Tout le monde ne réagit pas de la même manière aux interventions alimentaires, ce qui remet en cause l’approche universelle adoptée actuellement dans les recommandations diététiques. La nutrition de précision ou personnalisée vise à adapter les préconisations nutritionnelles à la biologie de la personne (gènes, métabolisme, etc.). Les analyses du microbiote pourraient devenir une composante clé des stratégies de nutrition de précision. Bien que plusieurs entreprises offrent déjà des conseils diététiques personnalisés basés sur le microbiote fécal, ces services ne sont validés par aucune autorité réglementaire, laissant planer un doute quant à la justesse des recommandations. Les directives diététiques nationales actuelles ne tiennent pas compte des approches de précision ou personnalisées, et leur mise en œuvre sera difficile à l’échelle d’une population. Bien qu’il existe une justification scientifique à la personnalisation de la nutrition, il est important de souligner que la plupart des individus tireront des bénéfices des recommandations diététiques discutées ci-dessus.
Conclusion
Le microbiote intestinal pourrait constituer la « boîte noire » de la recherche sur la nutrition, car de nombreux effets physiologiques de l’alimentation pourraient être influencés par les interactions entre alimentation, micro-organismes et hôte. Des recherches supplémentaires seront nécessaires pour déterminer dans quelle mesure le microbiote contribue aux effets physiologiques de l’alimentation et quels mécanismes détectés dans les modèles animaux s’appliquent à l’espèce humaine. Néanmoins, les preuves disponibles indiquent que le microbiote intestinal joue un rôle important dans les effets de l’alimentation, soulignant qu’une compréhension mécanistique des interactions alimentation-microbiote peut éclairer les controverses concernant la nutrition et aider au développement de régimes plus sains.
1. Armet AM, Deehan EC, O’Sullivan AF, et al. Rethinking healthy eating in light of the gut microbiome. Cell Host Microbe 2022; 30: 764-85.
2. Blaak EE, Canfora EE, Theis S, et al. Short chain fatty acids in human gut and metabolic health. Benef Microbes 2020; 11: 411-55.
3. Desai MS, Seekatz AM, Koropatkin NM, et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell 2016; 167: 1339-53 e21.
4. Chang SK, Alasalvar C, Shahidi F. Superfruits: phytochemicals, antioxidant efficacies, and health effects - a comprehensive review. Crit Rev Food Sci Nutr 2019; 59: 1580-604.
5. Martínez I, Lattimer JM, Hubach KL, et al. Gut microbiome composition is linked to whole grain-induced immunological improvements. ISME J 2013; 7: 269-80.
6. Kovatcheva-Datchary P, Nilsson A, Akrami R, et al. Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella. Cell Metab 2015; 22: 971-82.
7. Roager HM, Christensen LH. Personal diet-microbiota interactions and weight loss. Proc Nutr Soc 2022: 1-28.
8. Creedon AC, Hung ES, Berry SE, Whelan K. Nuts and their effect on gut microbiota, gut function and symptoms in adults: a systematic review and meta-analysis of randomised controlled trials. Nutrients 2020; 12: 2347.
9. Nakatani A, Li X, Miyamoto J, et al. Dietary mung bean protein reduces high-fat diet-induced weight gain by modulating host bile acid metabolism in a gut microbiota-dependent manner. Biochem Biophys Res Commun 2018; 501: 955-61.
10. Kimble R, Gouinguenet P, Ashor A, et al. Effects of a mediterranean diet on the gut microbiota and microbial metabolites: a systematic review of randomized controlled trials and observational studies. Crit Rev Food Sci Nutr 2023; 63: 8698-719.
11. Johnston BC, Zeraatkar D, Han MA, et al. Unprocessed red meat and processed meat consumption: dietary guideline recommendations from the Nutritional Recommendations (NutriRECS) Consortium. Ann Intern Med 2019; 171: 756-64.
12. Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nat Rev Microbiol 2014; 12: 661-72.
13. Devkota S, Wang Y, Musch MW, et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice. Nature 2012; 487: 104-8.
14. Russell WR, Gratz SW, Duncan SH, et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health. Am J Clin Nutr 2011; 93: 1062-72.
15. Reynolds A, Mann J, Cummings J, et al. Carbohydrate quality and human health: a series of systematic reviews and meta-analyses. Lancet 2019; 393: 434-45.

