El microbioma intestinal como factor determinante de una alimentación saludable
Por Anissa M. Armet 1 , João F. Mota 2,3 and Jens Walter 3
1 Departamento de Ciencias Agrícolas, Alimentarias y Nutricionales, Universidad de Alberta, Edmonton, Alberta, Canadá
2 Facultad de Nutrición, Universidad Federal de Goiás, Goiânia, Goiás, Brasil
3 APC Microbiome Ireland, Escuela de Microbiología, Departamento de Medicina e Instituto APC Microbiome, Escuela Universitaria de Cork – Universidad Nacional de Irlanda, Cork, Irlanda
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Las enfermedades crónicas no transmisibles (ENT) han alcanzado proporciones epidémicas en las sociedades industrializadas, una evolución claramente vinculada a cambios hacia hábitos alimentarios de estilo occidental. Las ENT también están relacionadas con el microbioma intestinal, y la investigación en modelos animales ha establecido la importancia causal de las interacciones entre la alimentación y el microbioma en el desarrollo de patologías, así como los mecanismos subyacentes. En este artículo analizamos lo que constituye una alimentación saludable desde la perspectiva de la ciencia del microbioma y argumentamos que una comprensión mecanicista de las interacciones entre la alimentación y el microbioma puede favorecer debates sobre temas controvertidos en materia de nutrición y avanzar en el desarrollo de dietas más saludables.
Cada vez hay más pruebas de que el microbioma intestinal influye significativamente en la salud humana. La alimentación es fundamental en esta relación, y los hábitos alimentarios de estilo occidental han desempeñado un papel importante en el reciente aumento de enfermedades crónicas no transmisibles (ENT) en las sociedades socioeconómicamente desarrolladas. En este artículo analizamos lo que constituye una alimentación saludable desde la perspectiva de la ciencia del microbioma y aplicamos estas pruebas para fundamentar los debates actuales en el campo de la nutrición y el desarrollo de estrategias nutricionales centradas en el microbioma. Este artículo se centra en as recomendaciones alimentarias para la población general con el objetivo de prevenir enfermedades, y no en pacientes con afecciones médicas, que a menudo tienen necesidades alimentarias específicas y deben consultar a un dietista titulado.
La alimentación saludable desde la perspectiva del microbioma
Alimentos vegetales integrales frente a alimentos procesados
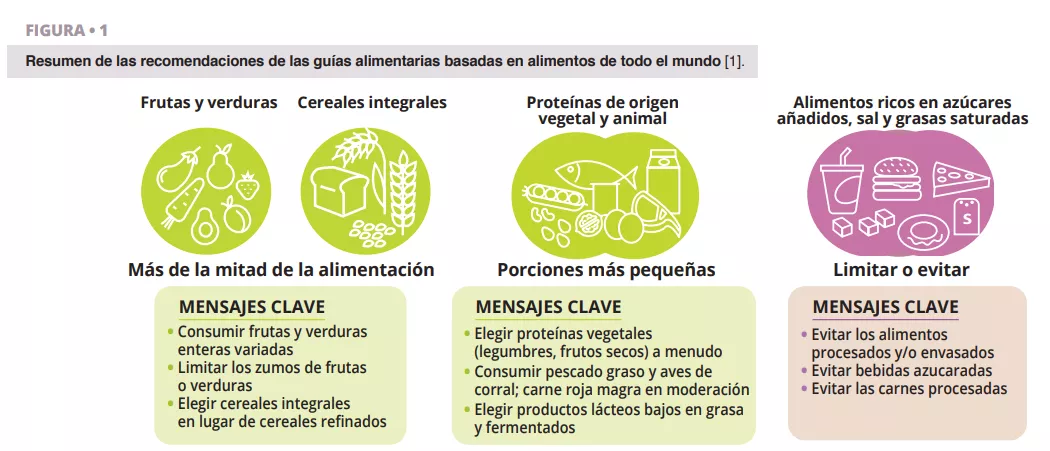
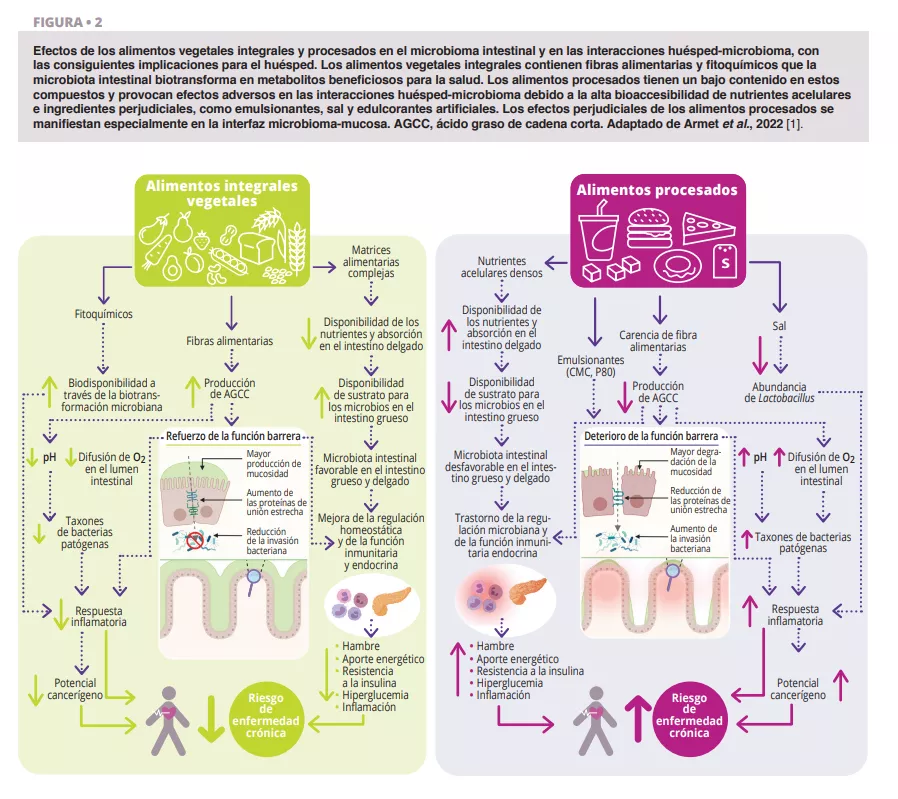
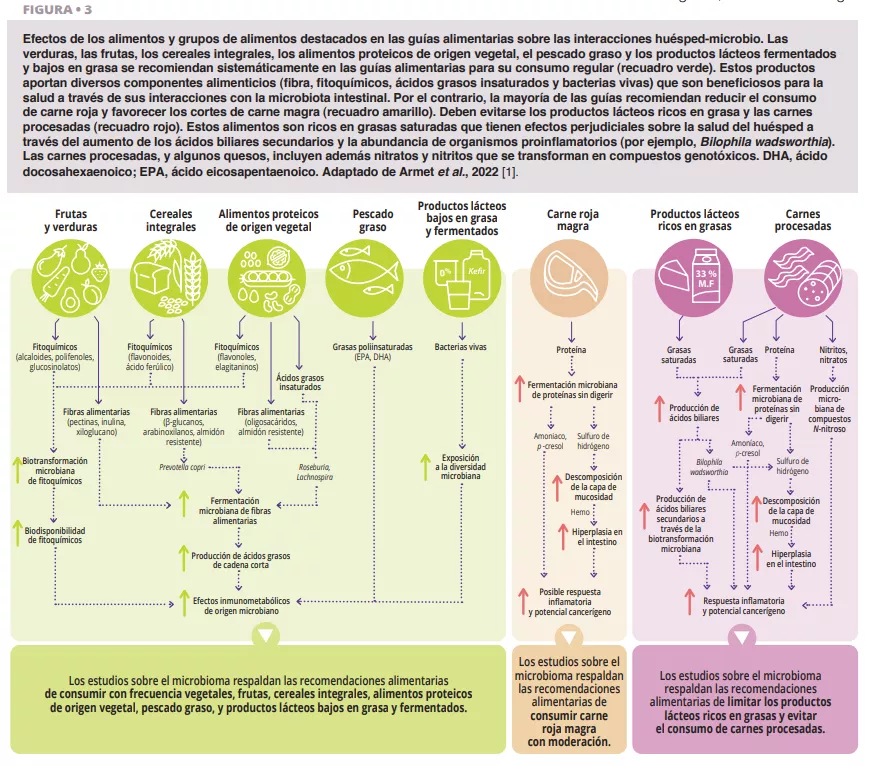
De acuerdo con todas las guías alimentarias que hemos revisado [1], los alimentos vegetales integrales (verduras, frutas, cereales integrales, legumbres y frutos secos) que han sido procesados de forma limitada deberían dominar la dieta diaria (figura 1). Esta recomendación está bien respaldada desde la perspectiva del microbioma (figura 2 y 3). Los alimentos vegetales integrales son la única fuente natural de fibras alimentarias, algunas de las cuales son fermentables y proporcionan sustratos de crecimiento para los microbios. La variedad de los vegetales puede ayudar a mantener la diversidad del microbioma, y la fermentación de la fibra da lugar a metabolitos como los ácidos grasos de cadena corta (AGCC) que generan una amplia variedad de efectos metabólicos (hormonas relacionadas con la saciedad y mejora de la sensibilidad a la insulina), fisiológicos (aumento de la producción de moco y expresión de uniones estrechas) y ecológicos (inhibición de patógenos) [2]. Además, la provisión de sustratos para las bacterias previene la degradación del moco y las inflamaciones e infecciones posteriores en ratones [3]. Los fitoquímicos presentes en los alimentos vegetales integrales, la mayoría de los cuales no se absorben en el intestino delgado, también sufren una biotransformación por parte de la microbiota intestinal que aumenta su biodisponibilidad, absorción y efectos antioxidantes e inmunomoduladores [4], aunque la importancia de estas interacciones para la salud no se conoce tan bien. Por último, las características funcionales y la calidad nutricional (por ejemplo, la composición de nutrientes y la accesibilidad) de la mayoría de alimentos vegetales integrales son muy superiores a las de los alimentos procesados, que suelen contener aditivos alimentarios que perjudican la composición del microbioma y la función de la barrera intestinal (figura 2).
Cereales integrales
Cada vez se investiga más el posible papel del microbioma intestinal en los beneficios metabólicos e inmunológicos de los cereales integrales. La capa de salvado de los cereales integrales contiene fibras alimentarias como arabinoxilanos y β-glucanos que la microbiota intestinal fermenta formando metabolitos beneficiosos. Los efectos antiinflamatorios de los cereales integrales se han relacionado con un enriquecimiento de productores de AGCC [5]. Kovatcheya-Datchary et al. demostraron que ratones previamente libres de gérmenes, colonizados con microbiota fecal de humanos que respondían al pan integral de semillas de cebada y contenían Prevotella, mostraban mejoras en la tolerancia a la glucosa, reflejando los efectos en humanos [6]. Además, personas con exceso de peso corporal que al principio albergan Prevotella, muestran una pérdida de peso elevada con una dieta rica en cereales integrales [7]. Estos estudios sugieren que al menos algunos de los beneficios metabólicos de los cereales integrales están mediados por el microbioma intestinal (figura 3).

Fuentes de proteínas
La mayoría de guías alimentarias recomiendan consumir alimentos proteicos de origen vegetal (por ejemplo, legumbres, frutos secos), pescado (por ejemplo, pescado graso) y aves de corral, en detrimento de otras fuentes animales de proteínas, concretamente la carne roja (figura 1). Las legumbres y los frutos secos son ricos en fibra y contienen fitoquímicos y ácidos grasos omega-3 que influyen en las interacciones huésped-microbio (figura 3). La suplementación diaria de nueces y almendras aumentó la abundancia relativa de productores de butirato, especialmente de Roseburia [8]. La suplementación con judías mungo redujo el aumento de peso y la acumulación de grasa en ratones alimentados con dietas ricas en grasas, pero no en ratones libres de gérmenes alimentados con las mismas dietas, lo que establece un papel causal del microbioma [9]. Entre todos los alimentos proteicos de origen animal, el pescado graso es probablemente el que presenta mayores beneficios inmunológicos y metabólicos mediados por el microbioma [1].
Hábitos alimentarios
La constatación de que la salud no se ve influida principalmente por alimentos o nutrientes individuales, sino por su interconexión y sus efectos sinérgicos, ha llevado a hacer hincapié en los hábitos de alimentación en varias guías alimentarias actualizadas recientemente, como las Guías Alimentarias para los Estadounidenses 2020-2025 y la guía alimentaria de Canadá. La dieta mediterránea combina muchos de los grupos de alimentos que tienen efectos favorables sobre las interacciones huésped-microbio. Se realizaron varios ensayos controlados aleatorizados para investigar estas interacciones y se demostró que los beneficios metabólicos, inmunológicos y cognitivos de una dieta mediterránea estaban relacionados con el aumento de la abundancia de Faecalibacterium prausnitzii y de Roseburia [10].
¿Cómo influye el microbioma intestinal en las controversias sobre la alimentación saludable?
Carnes rojas y procesadas
La mayoría de guías alimentarias y varias sociedades médicas recomiendan reducir el consumo de carne roja y evitar las carnes procesadas, aunque una serie de revisiones sistemáticas de 2019 concluyeron que las pruebas existentes de su relación con resultados adversos para la salud son débiles [11]. El microbioma intestinal ofrece una perspectiva útil en esta controversia. La fermentación proteolítica de la proteína de la carne por parte de los microbios intestinales aumenta metabolitos tóxicos como el amoníaco, el p-cresol y el sulfuro de hidrógeno [12]. Al tener un alto contenido en grasas saturadas, las carnes procesadas estimulan aún más la secreción de ácidos biliares en el intestino delgado, que los microbios transforman en ácidos biliares secundarios. Además, los agentes de curado utilizados en las carnes procesadas, nitratos y nitritos, son sustratos para la biotransformación microbiana en compuestos N-nitroso. Por tanto, las consideraciones toxicológicas respaldan las recomendaciones alimentarias actuales (figura 3).
Los metabolitos resultantes de la fermentación de proteínas (por ejemplo, sulfuro de hidrógeno, amoníaco) son de menor toxicidad y no están clasificados actualmente como carcinógenos humanos, lo que apoya la conclusión de que el consumo moderado de carne roja magra tiene probablemente un riesgo limitado. Por el contrario, los compuestos N-nitroso y los ácidos biliares secundarios que resultan del consumo de carnes procesadas son carcinógenos, lo que apoya las recomendaciones de evitar o minimizar el consumo de carne procesada.

Recomendaciones centradas en el microbioma para una dieta saludable
- Seguir las recomendaciones de las guías alimentarias (figura 1).
- Aumentar la diversidad de los vegetales consumidos e intentar aumentar los niveles de fibra por encima de lo recomendado actualmente (25-38 gramos/día).
- Reducir al mínimo los alimentos procesados con grandes cantidades de azúcar, sal y grasas saturadas, así como las carnes procesadas y los lácteos ricos en grasa.
- Incluir alimentos fermentados con microbios vivos (sin tratamiento térmico) bajos en azúcar, grasa y sal, como el yogur, las verduras fermentadas, el kéfir y la kombucha.
Lácteos
La mayoría de las guías alimentarias recomiendan los productos lácteos desnatados y bajos en grasa (0-2 %) y sugieren evitar los productos lácteos ricos en grasa (> 25 %) (por ejemplo, determinados quesos, productos a base de nata, mantequilla). Sin embargo, no hay consenso sobre los lácteos con un contenido total de grasa (~ 3,5 %), que se desaconsejan en algunas guías alimentarias, aunque se han cuestionado sus efectos perjudiciales. Las interacciones entre la grasa láctea y el microbioma intestinal son relevantes para este debate. Las grasas saturadas derivadas de la leche inducen a Bilophila wadsworthia, que desencadena enfermedades como la colitis [13] en modelos con ratones. Estos hallazgos mecanicistas apoyan las recomendaciones alimentarias de limitar los lácteos a variedades bajas en grasa (figura 3).
Dietas bajas en carbohidratos
Las dietas bajas en hidratos de carbono son populares porque pueden conseguir notables beneficios metabólicos y de pérdida de peso a corto plazo, aunque los resultados pueden no ser sostenibles a largo plazo. Estas dietas son ricas en grasas y/o proteínas y a menudo pobres en fibra. En consecuencia, dan lugar a un perfil metabólico perjudicial con mayores concentraciones de compuestos N-nitroso y menores niveles de butirato y compuestos fenólicos antiinflamatorios [14]. Debido a sus efectos sobre la microbiota intestinal, las dietas bajas en carbohidratos podrían ser perjudiciales para la salud cuando se consumen durante periodos prolongados.

Avanzar en la alimentación saludable a través del microbioma
Aunque las guías alimentarias internacionales son muy coherentes y proporcionan una orientación excelente sobre lo que constituye una alimentación saludable, aún hay margen para introducir mejoras e innovaciones a través de una consideración más sistemática del microbioma.
Consideraciones evolutivas y restauración del microbioma
La simbiosis microbioma-humano ha evolucionado a lo largo de millones de años en un contexto medioambiental y nutricional muy diferente. La industrialización, que condujo a un aumento sustancial de las ENT, mermó la diversidad del microbioma, disminuyó su capacidad enzimática para usar los carbohidratos, enriqueció a los organismos y enzimas que degradan las mucosas y condujo a una pérdida de simbiontes microbianos. Por lo tanto, existe un argumento de base evolutiva para aumentar la ingesta de fibra más allá de los 25-38 gramos diarios que se recomiendan actualmente en las guías alimentarias, y esto está respaldado tanto por estudios observacionales como de intervención [15]. Además de fomentar una mayor ingesta de fibra procedente de alimentos integrales, existen sólidos argumentos científicos que respaldan corregir el impacto de la industrialización en el microbioma intestinal mediante estrategias prebióticas, probióticas y simbióticas. Ya hay en el mercado productos que intentan restaurar y diversificar el microbioma, pero esta investigación y validación clínica está aún en sus inicios (véase más adelante).
Probióticos y prebióticos
Aunque muchos estudios han demostrado beneficios clínicos cuando se utilizan probióticos y prebióticos para objetivos médicos específicos, son pocas las indicaciones de salud que aprueban las agencias reguladoras. Además, hay pocas pruebas de que su consumo reduzca el riesgo de ENT, y la gran mayoría de las guías alimentarias nacionales no han hecho recomendaciones para incluirlos como parte de una dieta saludable. Existe un gran potencial para desarrollar probióticos, prebióticos y su combinación (simbióticos) que prevengan las enfermedades crónicas de forma más sistemática. La investigación en curso explora el uso de estas estrategias para corregir el impacto de la industrialización en la diversidad y función del microbioma intestinal. Se han desarrollado y comercializado productos en este ámbito, pero están pendientes de validación clínica en ensayos aleatorizados bien controlados, y la investigación disponible es demasiado preliminar para hacer recomendaciones generales.
Microbios vivos
Otro rasgo distintivo de la industrialización es la reducción de la exposición microbiana. La hipótesis de la biodiversidad afirma que el contacto con entornos naturales es necesario para enriquecer el microbioma humano, favorecer el equilibrio inmunitario y evitar alergias y trastornos inflamatorios. Los probióticos proporcionan microbios vivos y llevan décadas estudiándose y comercializándose en este contexto (véase el recuadro “Probióticos y prébióticos”). Además, los alimentos fermentados, como el kéfir, el yogur, la kombucha y el chucrut pueden, si se consumen crudos, contener un elevado número de microbios vivos (bacterias y hongos). Aunque los microbios presentes en los alimentos fermentados no colonizan el intestino humano debido a su naturaleza no nativa en el ecosistema intestinal humano, siguen siendo detectables en la microbiota fecal humana y podrían interactuar directamente con el huésped.

Algunas guías alimentarias incluyen los alimentos fermentados, como el yogur y las leches fermentadas, en sus recomendaciones, y cada vez se informa más de sus beneficios en estudios observacionales y ensayos controlados aleatorizados más pequeños, pero es necesario realizar más ensayos humanos bien controlados.
Nutrición de precisión
Los seres humanos responden de forma diferente a las intervenciones alimentarias, lo que cuestiona el enfoque único que se aplica actualmente en las guías alimentarias. La nutrición de precisión o personalizada pretende adaptar las recomendaciones nutricionales a la biología del individuo (genes, metabolismo, etc.). Las mediciones del microbioma podrían convertirse en un componente clave de las estrategias de nutrición de precisión. Aunque varias empresas ya ofrecen asesoramiento dietético personalizado basado en el microbioma fecal, estos servicios no están validados por ninguna autoridad reguladora, lo que deja dudas sobre la exactitud de las recomendaciones. En la actualidad, las guías alimentarias nacionales no tienen en cuenta los enfoques de precisión o personalizados, y su aplicación a escala poblacional será todo un reto. Aunque existen razones científicas para personalizar la nutrición, es importante destacar que la mayoría de las personas se beneficiarán de las recomendaciones alimentarias comentadas anteriormente.
Conclusión
El microbioma intestinal podría considerarse como la «caja negra» de la investigación sobre nutrición, ya que muchos efectos fisiológicos de la alimentación pueden estar influidos por las interacciones dieta-microbio-huésped. Es necesario realizar más investigaciones para determinar hasta qué punto el microbioma contribuye de forma causal a los efectos fisiológicos de la dieta y qué mecanismos detectados en modelos animales son aplicables en humanos. No obstante, las pruebas disponibles apoyan firmemente el importante papel que desempeña el microbioma intestinal en los efectos de la alimentación, y ponen de relieve que una comprensión mecanicista de las interacciones entre la alimentación y el microbioma puede aportar información a las discusiones sobre nutrición y avanzar en el desarrollo de dietas más saludables.
1. Armet AM, Deehan EC, O’Sullivan AF, et al. Rethinking healthy eating in light of the gut microbiome. Cell Host Microbe 2022; 30: 764-85.
2. Blaak EE, Canfora EE, Theis S, et al. Short chain fatty acids in human gut and metabolic health. Benef Microbes 2020; 11: 411-55.
3. Desai MS, Seekatz AM, Koropatkin NM, et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell 2016; 167: 1339-53 e21.
4. Chang SK, Alasalvar C, Shahidi F. Superfruits: phytochemicals, antioxidant efficacies, and health effects - a comprehensive review. Crit Rev Food Sci Nutr 2019; 59: 1580-604.
5. Martínez I, Lattimer JM, Hubach KL, et al. Gut microbiome composition is linked to whole grain-induced immunological improvements. ISME J 2013; 7: 269-80.
6. Kovatcheva-Datchary P, Nilsson A, Akrami R, et al. Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella. Cell Metab 2015; 22: 971-82.
7. Roager HM, Christensen LH. Personal diet-microbiota interactions and weight loss. Proc Nutr Soc 2022: 1-28.
8. Creedon AC, Hung ES, Berry SE, Whelan K. Nuts and their effect on gut microbiota, gut function and symptoms in adults: a systematic review and meta-analysis of randomised controlled trials. Nutrients 2020; 12: 2347.
9. Nakatani A, Li X, Miyamoto J, et al. Dietary mung bean protein reduces high-fat diet-induced weight gain by modulating host bile acid metabolism in a gut microbiota-dependent manner. Biochem Biophys Res Commun 2018; 501: 955-61.
10. Kimble R, Gouinguenet P, Ashor A, et al. Effects of a mediterranean diet on the gut microbiota and microbial metabolites: a systematic review of randomized controlled trials and observational studies. Crit Rev Food Sci Nutr 2023; 63: 8698-719.
11. Johnston BC, Zeraatkar D, Han MA, et al. Unprocessed red meat and processed meat consumption: dietary guideline recommendations from the Nutritional Recommendations (NutriRECS) Consortium. Ann Intern Med 2019; 171: 756-64.
12. Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer. Nat Rev Microbiol 2014; 12: 661-72.
13. Devkota S, Wang Y, Musch MW, et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice. Nature 2012; 487: 104-8.
14. Russell WR, Gratz SW, Duncan SH, et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health. Am J Clin Nutr 2011; 93: 1062-72.
15. Reynolds A, Mann J, Cummings J, et al. Carbohydrate quality and human health: a series of systematic reviews and meta-analyses. Lancet 2019; 393: 434-45.

