La composition du microbiote intestinal est associée à l’apparition future de la maladie de Crohn chez des sujets sains apparentés au premier degré de malades
ARTICLE COMMENTÉ - Rubrique adulte
Par le Pr. Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
Commentaire de l’article de Raygoza Garay et al. Gastroenterology 2023 [1]
Contexte et objectifs : la cause de la maladie de Crohn (MC) est inconnue, mais l’hypothèse actuelle est que des facteurs microbiens ou environnementaux induisent une inflammation de l’intestin chez des individus génétiquement susceptibles, conduisant à une inflammation intestinale chronique. Les études cas-témoins de patients atteints de MC ont catalogué les altérations de la composition du microbiome intestinal ; cependant, ces études ne parviennent pas à distinguer si l’altération de la composition du microbiome intestinal est associée à l’initiation de la MC ou est le résultat de l’inflammation ou d’un traitement médicamenteux. Méthodes : Dans cette étude de cohorte prospective, 3 483 parents sains au premier degré de patients atteints de MC ont été recrutés pour identifier la composition du microbiome intestinal qui précède l’apparition de la maladie et pour déterminer dans quelle mesure cette composition prédit le risque de la développer. Une approche d’apprentissage automatique à l’analyse de la composition du microbiome intestinal (basée sur le séquençage du gène de l’ARN ribosomal 16S) a été utilisée pour définir une signature microbienne associée au développement futur de la MC. La performance du modèle a été évaluée dans une cohorte de validation indépendante. Conclusion : Cette étude est la première à démontrer que la composition du microbiome intestinal est associée à l’apparition future de la MC et suggère que le microbiome intestinal contribue à la pathogenèse de la maladie de Crohn.
Que sait-on déjà à ce sujet ?
La maladie de Crohn (MC) est une maladie inflammatoire de l’intestin (MICI) caractérisée par une inflammation chronique et récidivante de l’intestin. La cause de la MC est inconnue, mais l’hypothèse actuelle est que des facteurs microbiens ou environnementaux induisent une inflammation de l’intestin chez les individus génétiquement prédisposés, entraînant une inflammation et des lésions intestinales chroniques. Des études cas-témoins de patients atteints de la maladie de Crohn ont répertorié des altérations de la composition du microbiome intestinal [1]. Toutefois, ces études ne permettent pas de déterminer si l’altération de la composition du microbiome intestinal est associée à l’apparition de la maladie de Crohn ou si elle est le résultat d’une inflammation ou d’un traitement médicamenteux. Pour répondre à ces questions, le projet Canadien GEM (Genetic Environmental Microbial), une étude de cohorte prospective de parents au premier degré en bonne santé de personnes atteintes de la maladie de Crohn, a été conçu pour identifier les paramètres associés au développement de la maladie de Crohn. Parmi ces paramètres, les auteurs se sont intéressés au profilage de la composition du microbiome intestinal qui précède l’apparition de la MC et à la mesure dans laquelle cette composition prédit le risque de développer la MC. Les auteurs ont appliqué une approche d’apprentissage automatique à l’analyse de la composition du microbiome intestinal dans une vaste cohorte de sujets sains parents au premier degré de personnes atteintes de la maladie de Crohn (N = 3483) afin de définir une signature microbienne associée au risque de développer la MC.
Quels sont les principaux résultats apportés par cette étude ?
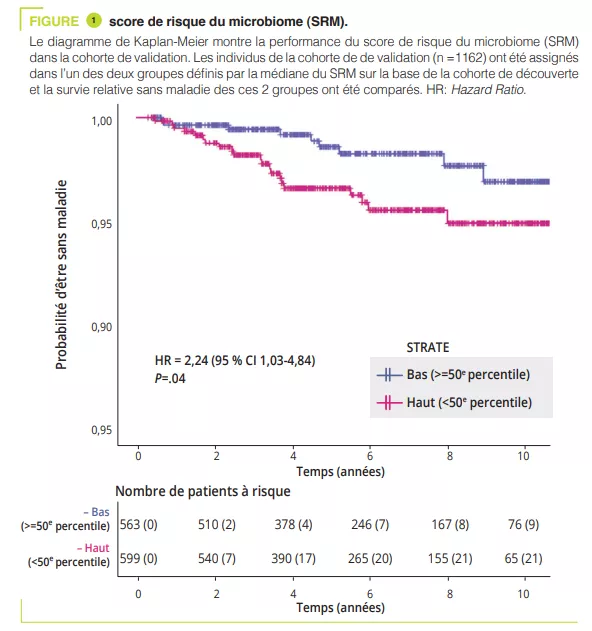
En utilisant les données collectées dans la cohorte GEM, les auteurs ont développé et validé un score de risque du microbiome (SRM) capable de classer les individus qui développeront plus tard la MC. Parmi les taxons contribuant le plus au SRM, l’abondance accrue des Ruminoccus torques et de Blautia était positivement corrélée au SRM (suggérant un effet délétère de ces taxa), alors que l’abondance du genre Roseburia était corrélée négativement avec le SRM (suggérant un effet protecteur de ce genre). Enfin, les auteurs ont constaté qu’une augmentation de l’abondance du genre Faecalibacterium était inversement associée à une augmentation du SRM. Cette étude est la première à montrer que la diminution de l’abondance de Faecalibacterium peut être une signature préclinique de la MC qui peut être observée de nombreuses années avant l’apparition de la maladie, suggérant un rôle causal de la diminution de cette bactérie anti-inflammatoire (2). De manière importante, les altérations du microbiome précédant l’apparition de la MC étaient observées indépendamment de l’existence d’une inflammation intestinale (mesurée par la calprotectine fécale).
Les auteurs ont également réalisé une analyse métabolomique des selles dans un sous-ensemble de la cohorte. La cytosine et son dérivé, la cytidine avaient la plus forte corrélation négative avec la SRM.
En outre, la signature pré-CD de la SRM était associée à une réduction des métabolites ayant une activité anti-inflammatoire ou antioxydante comme le gentisate et le nicotinate. Ces métabolites protecteurs étaient également positivement corrélés à l’abondance de Faecalibacterium et de Lachnospira, ce qui indique une interaction biologique potentielle entre l’abondance de ces métabolites et la composition microbienne.
- Le microbiote intestinal s’altère plusieurs années avant le diagnostic de maladie de Crohn, indépendamment de l’existence d’une inflammation intestinale, suggérant un rôle causal du microbiome dans la maladie de Crohn
- Un Score de risque du microbiome pourrait permettre d’identifier les sujets les plus à risque de développer une maladie de Crohn
- Une intervention précoce ciblant le microbiome pourrait être proposée chez les patients identifiés comme à risque de développer une maladie de Crohn
Quelles sont les conséquences en pratique ?
Cette étude suggère que l’analyse du microbiome des individus sains à risque de développer une maladie de Crohn pourrait permettre d’identifier les sujets à plus haut risque et donc d’initier une surveillance rapprochée et potentiellement d’initier des interventions visant à modifier le déséquilibre microbien pour réduire le risque de développer la maladie.
CONCLUSION
Cette étude est la première à démontrer que des altérations de la composition du microbiome intestinal précèdent de plusieurs années le diagnostic de la maladie de Crohn. Cela suggère que le microbiome intestinal contribue à la pathogenèse de la maladie de Crohn et qu’il pourrait constituer une cible pour la prévention et/ou la thérapie.
Crohn : le microbiote ideal, facteur prédictif de récidive ?
Maladie de Crohn : une dysbiose intestinale précèderait la crise
1. Sartor RB, Wu GD. Roles for Intestinal Bacteria, Viruses, and Fungi in Pathogenesis of Inflammatory Bowel Diseases and Therapeutic. Approaches. Gastroenterology 2017; 152: 327-39.e4.
2. Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci USA 2008; 105: 16731-6.


