Axe cerveau-intestin et TDAH chez les adolescents
Certaines altérations systémiques liées aux dysbioses intestinales pourraient se manifester sous forme de troubles du déficit de l’attention avec hyperactivité. Des précurseurs de la dopamine synthétisés au niveau de l’intestin pourraient atteindre le système nerveux central (SNC) et accentuer le risque de développer ce type de pathologies.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
NEUROTRANSMISSION TROUBLÉE
Autre classe de neuropathies impliquant possiblement le microbiote humain : les troubles du déficit de l’attention avec hyperactivité (TDAH), associés à des anomalies de neurotransmission dopaminergique et des déficits dans les processus de récompense via les circuits neuraux sous-jacents, en particulier au niveau du striatum ventral. Des altérations auxquelles pourrait contribuer le microbiote par l’intermédiaire de l’axe intestin-cerveau10. L’hypothèse est explorée à travers la caractérisation du microbiote intestinal d’adolescents et de jeunes adultes souffrant de troubles du déficit de l’attention avec hyperactivité, en complément d’une analyse des réponses cérébrales à la stimulation émotionnelle12.
PRÉCURSEUR DE LA DOPAMINE EN HAUSSE
L’analyse du microbiote intestinal par séquençage de l’ARNr 16S a permis d’identifier les populations bactériennes des adolescents atteints de TDAH. L’imagerie fonctionnelle a été utilisée pour comparer les populations microbiennes intestinales et les réactions cérébrales à une stimulation des processus de récompense chez certains participants, indépendamment du diagnostic initial. La caractérisation des microbiotes a mis en exergue des variations, en particulier une augmentation des Bifidobacterium chez les sujets TDAH. Prédominantes dans leur intestin, ces bactéries possèdent un gène codant pour la cyclohexadienyl dehydratase, une enzyme impliquée dans la synthèse de la phénylalanine, un précurseur de la dopamine capable de franchir la barrière hémato-encéphalique. Conséquence : une augmentation des concentrations cérébrales en dopamine entraînant un risque accentué de perturbations neurologiques.
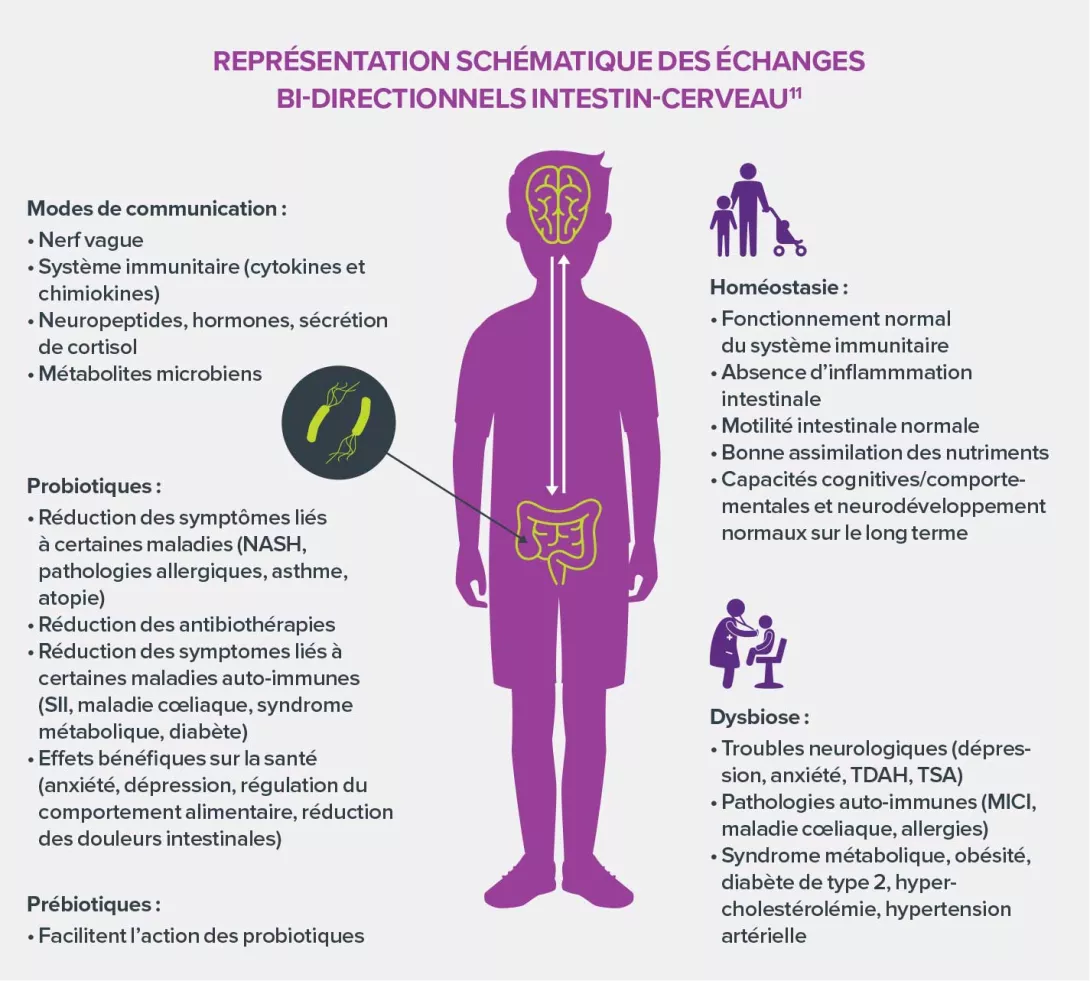
L’AXE INTESTIN-CERVEAU
- Le microbiote intestinal participe à la communication entre l’intestin et le cerveau via de nombreuses molécules et par des voies multiples.
- Son rôle dans la maturation de l’axe neuro-endocrinien du stress et dans la régulation des émotions est clairement établi.
- Plusieurs études suggèrent que les dysbioses pourraient contribuer à la physiopathologie de maladies du SNC, telles les troubles anxieux et dépressifs, les troubles du spectre de l’autisme et certaines maladies neurodégénératives (Parkinson, Alzheimer, SEP).
CARENCE MOTIVATIONNELLE
Cette augmentation de production de monoamines impulsée par le microbiote intestinal est corrélée à une décroissance des mécanismes neuronaux d’anticipation de la récompense au niveau du striatum ventral, autre marqueur de TDAH. Un lien confirmé par l’imagerie : les sujets présentant une dysbiose intestinale présentent une « intolérance au délai de récompense » (incapacité à supporter de différer une récompense), considérée par de nombreux experts comme le mécanisme fondamental de la pathologie. Le microbiote intestinal apparaît donc comme un nouveau facteur dans l’étiologie des troubles du déficit de l’attention avec hyperactivité, sa composition impactant directement la synthèse de la cyclohexadienyl dehydratase. Une possibilité de dysbiose liée à la présence d’un TDAH n’étant pas exclue, de plus amples explorations sont toutefois requises pour préciser le niveau d’interactions, mais également les effets fonctionnels des microbiotes sur les troubles psychiatriques en général (T.O.C., phobies, troubles anxieux…).
10 The gut-brain axis includes the means used by the intestine to communicate with the brain (especially the NCS), and conversely
11 Cerdó T, Ruíz A, Suárez A, et al. Probiotic, Prebiotic, and Brain Development. Nutrients. 2017;9(11):1247.
12 Aarts E, Ederveen THA, Naaijen J, et al. Gut microbiome in ADHD and its relation to neural reward anticipation. PLoS One. 2017;12(9):e0183509.








