Focus sur les risques de MICI
Le risque de MICI est accentué chez le jeune enfant en cas d’exposition intrapartum à des antibiotiques. Les perturbations physiologiques entraînées par la dysbiose, en particulier au niveau de la muqueuse intestinale et du système immunitaire, facilitent le développement de ce type de pathologies inflammatoires rares.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
EXPOSITION ANTIBIOTIQUE ET MICI PRÉCOCE
Le cas de la surcharge pondérale souligne la complexité à expliciter les répercussions des dysbioses dans certains domaines médicaux. Les liens de causalité sont plus étayés en gastro-entérologie, où le rapport entre composition du microbiote intestinal et Maladies Inflammatoires Chroniques de l’Intestin (MICI) est établi. Un rapprochement qui conduit de plus en plus de chercheurs à prendre en compte les dysbioses pour tenter de décrypter les troubles aux étiologies mal identifiées, notamment les rectocolites hémorragiques (RCH) et la maladie de Crohn chez le jeune enfant (moins de 6 ans), dont l’incidence mondiale croit régulièrement. Cette progression ne pouvant trouver sa cause dans les facteurs génétiques et environnementaux connus, une fragilisation intestinale liée à des altérations de son microbiote est évoquée.
UN RISQUE DE MICI MULTIPLIÉ PAR DEUX APRÈS ANTIBIOTHÉRAPIE INTRAPARTUM
Des chercheurs suédois3 ont exploré cette hypothèse en étudiant une cohorte de 827 239 enfants nés entre 2006 et 2013. Une analyse de grande ampleur fondée sur le recoupement des registres nationaux suédois des naissances, des patients et des prescriptions médicamenteuses. Au total, 17 % des sujets ont été exposés intrapartum à des antibiotiques (5 % à plusieurs reprises) et 65 % après la naissance, majoritairement plus d’une fois (7 sur 10). La maladie de Crohn et les RCH ont pour leur part concerné 51 enfants. Par comparaison à la population contrôle, les enfants exposés aux antibiotiques pendant la grossesse ont un risque élevé (aHR4 1,93) de développer une MICI précoce.
IMPACT FŒTAL
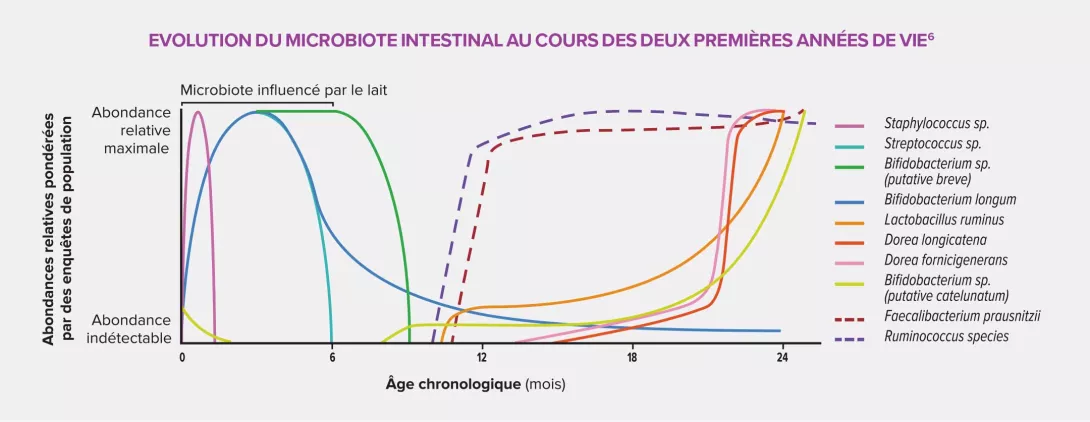
L’exposition intra-utérine aux antibiotiques provoquerait une perturbation de la colonisation bactérienne précoce de l’enfant, caractérisée par une faible concentration des bactéries commensales, en particulier les Faecalibacterium prausnitzii et les Ruminococcaceae, et une augmentation des bactéries pathogènes. Cette dysbiose entraînerait d’importantes modifications physiologiques, le microbiote interagissant avec l’hôte via la production d’AGCC5 (notamment le butyrate), l’induction du système immunitaire de la muqueuse intestinale, la stimulation du système nerveux local et le maintien de la fonction « barrière » de l’intestin. Autant de dysfonctionnements susceptibles de provoquer des troubles inflammatoires.
MIEUX PRESCRIRE LES ANTIBIOTIQUES POUR PRÉSERVER LE MICROBIOTE
Les données évoquées ainsi que celles issues d’un nombre croissant d’études et de publications montrent qu’un microbiote diversifié et présentant un ratio élevé bactéries commensales/bactéries pathogènes participe au bon développement de l’enfant en limitant le risque d’apparition de certaines pathologies, notamment métaboliques ou inflammatoires. Un constat qui ne doit pas être associé à un rejet de l’antibiothérapie, dont l’efficacité et les bénéfices s’avèrent irremplaçables dans de nombreux cas, ainsi que le soulignent l’ensemble des acteurs de santé. Une optimisation des prescriptions, du spectre d’action des molécules employées, de la durée de traitement et des modes d’administration représentent en revanche un bon moyen de limiter l’impact des antibiotiques et le transfert de résistance sur le microbiote intestinal afin de préserver la santé à court et long termes de l’enfant.
4 Ajusted Hazard Ratio
5 Short-chain fatty acids. They are products of carbohydrate fermentation (organic anions and saturated fatty acids) carried out by anaerobic bacteria in the colon.
6 Rasmussen SH, Shrestha S, Bjerregaard LG, et al. Antibiotic exposure in early life and childhood overweight and obesity: A systematic review and meta-analysis. Diabetes Obes Metab. 2018;20(6):1508-1514.








