МОЖЕТ ЛИ КИШЕЧНЫЙ МИКРОБИОМ ПРИМЕНЯТЬСЯ С ЦЕЛЬЮ ОПТИМИЗАЦИИ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ SARS-COV-2?
ОБЗОРНАЯ СТАТЬЯ
Джинелл Хили (Genelle Healey)
Научно-исследовательский институт при детской больнице Университета Британской Колумбии Ванкувер, Канада
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Основная цель вакцинации против SARS-CoV-2, которая остается главной надеждой человечества в борьбе с пандемией Covid-19, заключается в том, чтобы обеспечить надежный и долговременный иммунитет как можно большему числу вакцинированных людей. Несмотря на появление новых вакцин для борьбы с коронавирусом, вспышки Covid-19 показывают, что пандемия еще далека от завершения. Разработка новых стратегий, помогающих контролировать распространение вируса и/или повышающих эффективность вакцин против SARS-CoV-2, может оказать ощутимую пользу в борьбе с Covid-19.
ЭФФЕКТИВНОСТЬ ВАКЦИНЫ ПРОТИВ SARS-COV-2
Вакцины применяют для усиления врожденного и адаптивного иммунитета. Одним из популярных биомаркеров стойкого иммунитета и защиты от SARS-CoV-2 является уровень антител. По непонятным причинам ответ со стороны антител на вакцинацию против SARS-CoV-2 сильно варьируется от человека к человеку [1]. Согласно результатам клинических исследований, эффективность одобренных вакцин для профилактики SARS-CoV-2 колеблется от 60 до 92% в отношении первоначальных штаммов SARS-CoV-2 и снижается по отношению к новым вариантам SARS-CoV-2 (альфа, бета, дельта и гамма) [2]. Различия в ответах на вакцинацию, снижение эффективности вакцин в отношении новых вариантов вируса и общее снижение эффективности защиты с течением времени осложняют контроль распространения SARS-CoV-2. Поэтому возрастает важность понимания факторов, приводящих к изменению эффективности вакцин против SARS-CoV-2 в краткосрочной и долгосрочной перспективе.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ИММУНОГЕННОСТЬ ВАКЦИНЫ
Учитывая, что каждый человек получает одну и ту же стандартизированную дозу вакцины, но при этом иммунные ответы сильно разнятся, весьма вероятно, что на эффективность вакцины влияет не только ее тип. Все больше данных указывает на то, что на способность иммунной системы реагировать на вакцины оказывают влияние такие факторы как возраст, хронические заболевания, нездоровый образ жизни, депрессия и стресс (рисунок 1) [3-5]. Эти результаты были продемонстрированы для нескольких типов вакцин, поэтому, вероятно, их можно распространить и на вакцины против SARS-CoV-2. Интересно, что большинство факторов, описанных выше, также влияют на состав и функциональную способность микробиома кишечника. Поэтому вполне вероятно, что дисбиоз микробиома кишечника может быть связан с наблюдаемыми различиями эффективности вакцин.
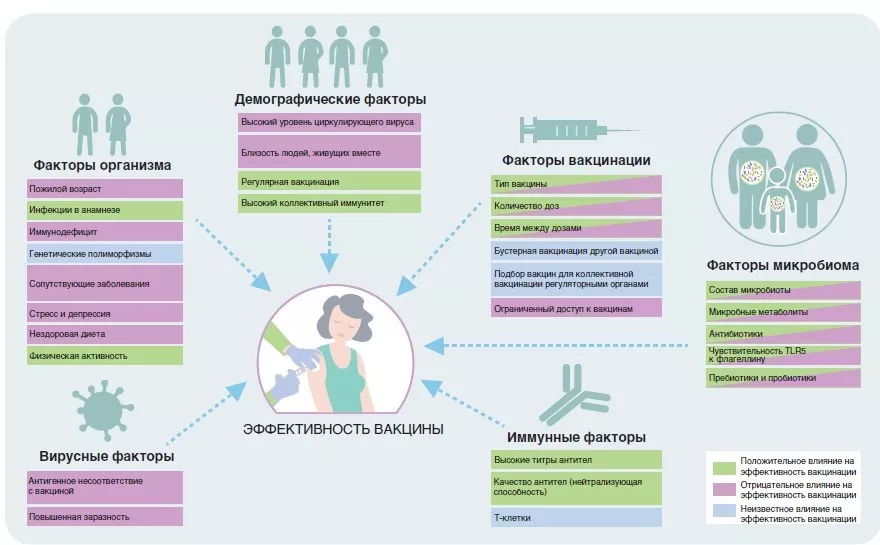
РИСУНОК 1.
Факторы, влияющие на эффективность вакцин. По материалам [14].
КИШЕЧНЫЙ МИКРОБИОМ ПОМОЖЕТ УВЕЛИЧИТЬ ЭФФЕКТИВНОСТЬ ВАКЦИН?
Микробиота кишечника — это все бактерии, грибки, вирусы и археи, которые обитают в желудочно-кишечном тракте. Они растут и развиваются вместе со своим хозяином. Эти микроорганизмы выполняют множество важных функций, одной из которых является регуляция локальных и системных иммунных реакций. Интересно, что некоторые профили микробиоты кишечника (т. е. более высокое содержание Actinobacteria, Clostridium кластера XI и Proteobacteria) ассоциируются с более высокой иммуногенностью вакцин для профилактики вирусных инфекций, таких как ВИЧ, грипп и ротавирус [6-8]. Недавнее исследование показало, что вызванное антибиотиками нарушение микробиома кишечника (т. е. дисбиоз) приводило к снижению нейтрализующей активности и концентраций антител после вакцинации против гриппа [9]. Другое исследование, проведенное на стерильных мышах, которым вводили антибиотики, показало, что для стимулирования надежного ответа на вакцину необходима нормальная функция рецепторов иммунных клеток (толл-подобный рецептор 5 [TLR5]), связывающих бактериальный белок подвижности флагеллин [8]. Это и другие подобные исследования [10] доказывают важную роль микробиоты кишечника в усилении эффективности вакцин (рисунок 1). Однако, на сегодняшний день не было проведено исследований влияния микробиоты кишечника на эффективность вакцин против SARS-CoV-2. Таким образом, крайне важно изучить влияние различных характеристик кишечной микробиоты на эффективность вакцин для профилактики SARS-CoV-2. Кроме того, методы лечения, направленные на микробиоту, такие как пребиотики и пробиотики [11], можно использовать в качестве адъюванта к вакцинам (средство, используемое для ускорения наступления, усиления и/или продления специфического иммунного ответа) для повышения их иммуногенности против SARS-CoV-2. В частности, было показано, что интраназальное введение молочнокислых бактерий (например, Bifidobacterium и Lactobacillus) повышает устойчивость к вирусным инфекциям и повышает эффективность вакцин против гриппа [12, 13], поэтому пероральное введение живых бактерий (пробиотиков) до и после вакцинации может усилить специфический иммунный ответ на вакцины против SARS-CoV-2.
ЗАКЛЮЧЕНИЕ
Несмотря на глобальную вакцинацию и действия со стороны системы здравоохранения, пандемия Covid-19 продолжается. Вакцины остаются главной надеждой человечества в борьбе с SARS-CoV-2, однако их неодинаковая эффективность существенно осложняет борьбу с Covid-19. Некоторые характеристики микробиома кишечника влияют на иммуногенность вакцин. Следовательно, использование микробиома кишечника в качестве адъюванта к вакцине может повысить эффективность вакцинации против SARS-CoV-2.
1 Amodio E, Capra G, Casuccio A, et al. Antibodies responses to SARS-CoV-2 in a large cohort of vaccinated subjects and seropositive patients. Vaccines 2021; 9(7): 714.
2 Gupta RK. Will SARS-CoV-2 variants of concern affect the promise of vaccines? Nat Rev Immunol 2021; 21(6): 340-1.
3 Collier DA, Ferreira IATM, Kotagiri P, et al. Age-related immune response heterogeneity to SARS-CoV-2 vaccine BNT162b2. Nature 2021; 596(7872): 417-22.
4 Grupper A, Rabinowich L, Schwartz D, et al. Reduced humoral response to mRNA SARSCoV-2 BNT162b2 vaccine in kidney transplant recipients without prior exposure to the virus. Am J Transplant 2021; 21: 2719-26.
5 Madison AA, Shrout MR, Renna ME, et al. Psychological and behavioural predictors of vaccine efficacy: Considerations for Covid-19. Perspect Psychol Sci 2021; 16(2): 191-203.
6 Harris VC, Armah G, Fuentes S et al. Significant correlation between the infant gut microbiome and rotavirus vaccine response in rural Ghana. J Infect Dis 2017; 215(1): 34-41.
7 Cram JA, Fiore-Gartland AJ, Srinivasan S, et al. Human gut microbiota is associated with HIV-reactive immunoglobulin at baseline and following HIV vaccination. PLoS One 2019; 14(12): e0225622.
8 Oh JZ, Ravindran R, Chassaing B, et al. TLR5-mediated sensing of gut microbiota is necessary for antibody responses to seasonal influenza vaccination. Immunity 2014; 41(3): 478-92.
9 Hagan T, Cortese M, Rouphael N, et al. Antibiotics-driven gut microbiome perturbation alters immunity to vaccines in humans. Cell 2019; 178(6): 1313-28.e13.
10 Harris VC, Haak BW, Handley SA, et al. Effect of antibiotic-mediated microbiome modulation on rotavirus vaccine immunogenicity: A human, randomized-control proof-of-concept trial. Cell Host Microbe 2018; 24(2): 197-207.e4.
11 Lei WT, Shih PC, Liu SJ, et al. Effect of probiotics and prebiotics on immune response to influenza vaccination in adults: a systematic review and meta-analysis of randomized controlled trials. Nutrients 2017; 9(11): 1175.
12 Belkina TV, Averina OV, Savenkova EV, Danilenko VN. Human intestinal microbiome and the immune system: The role of probiotics in shaping an immune system unsusceptible to Covid-19 infection. Bio Bull Rev 2021, 11(4): 329-43.
13 Taghinezhad S, Mohseni AH, Bermúdez-Humarán LG, et al. Probiotic-based vaccines may provide effective protection against Covid-19 acute respiratory disease. Vaccine 2021; 9(5): 466.
14 Tregoning JS, Flight KE, Higham SL, et al. Progress of the Covid-19 vaccine effort: viruses, vaccines and variants versus efficacy, effectiveness and escape. Nat Rev Immunol 2021; 21(10): 626-36.








