ВОЗМОЖНАЯ ПАТОФИЗИОЛОГИЧЕСКАЯ РОЛЬ ИЗМЕНЕННОЙ МИКРОБИОТЫ КИШЕЧНИКА ПРИ СРК
ОБЗОРНАЯ СТАТЬЯ
Проф. Ян Так (Jan Tack)
TARGID, Университет Лёвена, отделение гастроэнтерологии и гепатологии, Университетская клиника Лёвена, Лёвен, Бельгия
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
52% 1 из 2 человек, страдавших расстройством пищеварения, связанным с микробиотой, был осведомлен о наличии этой связи
Синдром раздраженного кишечника (СРК) представляет собой распространенное функциональное расстройство кишечника, характеризующееся болью в животе в сочетании с изменениями частоты опорожнения кишечника и/или консистенции стула. Хотя патогенез этого состояния окончательно не установлен, для его объяснения были предложены разные патофизиологические механизмы, такие как нарушение моторики, висцеральная гиперчувствительность, слабо выраженное воспаление, изменения микробиоты, иммунная активация, нежелательные реакции на продукты питания, дисфункция центральной нервной системы и т. д. В 2017 году в журнале Gut были опубликованы пять предполагаемых критериев механизмов, влияющих на развитие функциональных расстройств желудочно кишечного тракта. В этой статье мы обсудим, в какой степени измененная микробиота кишечника подходит под указанные критерии в контексте СРК, и рассмотрим доступную литературу.
ВВЕДЕНИЕ
Наиболее распространенное функциональное расстройство кишечника, синдром раздраженного кишечника (СРК), характеризуется болью или дискомфортом в животе в сочетании с изменениями частоты опорожнения кишечника и/или консистенции стула в отсутствие каких-либо определяемых структурных или биохимических аномалий, указывающих на органическое заболевание желудочно-кишечного тракта [1, 2]. Помимо боли в животе, пациенты отмечают такие симптомы, как вздутие живота и метеоризм. СРК можно разделить на подтипы в зависимости от консистенции стула: СРК-З (с преобладанием запора), СРК-Д (с преобладанием диареи) и СРК-С (смешанный вариант). С точки зрения патофизиологии СРК считается гетерогенным расстройством, в развитии которого задействовано множество механизмов, включая нарушение моторики желудочно-кишечного тракта, висцеральную гиперчувствительность, дисфункцию оси «головной мозг – кишечник». Также недавно было установлено, что к числу механизмов, участвующих в развитии СРК, относятся изменения состава и метаболизма солей желчных кислот, слабо выраженное воспаление, активация иммунной системы слизистых оболочек и изменения кишечной микробиоты [3].
В последнее десятилетие наблюдается значительный всплеск интереса к роли кишечной микробиоты в патогенезе СРК. Микробное сообщество кишечника выполняет ряд функций, включая метаболизм неперевариваемых полисахаридов, всасывание определенных питательных веществ и ионов, всасывание и запасание липидов, регуляцию метаболизма желчных кислот и выработку витаминов, таких как фолиевая кислота, биотин и витамин К [3, 4]. Конкурируя с микробными патогенами, микробное сообщество кишечника усиливает защитные характеристики желудочно-кишечного барьера. Интенсивно взаимодействуя со слизистой оболочкой, микробиота кишечника также влияет на иммунную систему и сигнальную ось «кишечник – головной мозг» [5]. Эти разнообразные свойства позволяют рассматривать микробиоту кишечника как один из ведущих потенциальных факторов развития СРК, а также как привлекательную мишень для терапии этого состояния.
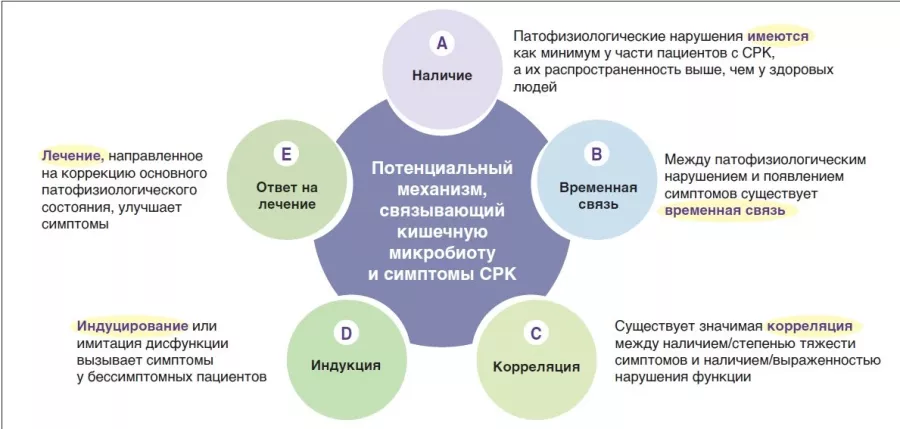
Действительно, в исследованиях патофизиологии СРК было выявлено множество механизмов, связанных с микробной экосистемой кишечника. Для многих из них получены доказательства связи с развитием СРК. Чтобы лучше разобраться в вопросе, нужно определить уровень значимости каждого предполагаемого патофизиологического процесса — это позволит расширить наши знания и начать поиск возможных терапевтических мишеней. Несколько лет назад группа международных экспертов разработала пять критериев оценки важности механизмов, лежащих в основе функциональных нарушений со стороны желудочно-кишечного тракта, таких как СРК [6]. Они основаны на таких аспектах, как наличие, временная связь, корреляция между уровнем нарушения и тяжестью симптомов, индукция у здоровых лиц и ответ на лечение (или соответствующее естественное течение, если лечение невозможно) (рисунок 1). В следующих разделах рассматривается предполагаемая гипотеза, которая учитывает факторы изменения микробиоты кишечника в качестве механизма формирования и проявления симптомов СРК. С учетом текущих знаний о кишечной микробиоте в контексте СРК это позволяет определить направления дальнейших исследований.
РИСУНОК 1
Возможные патофизиологические механизмы, связывающие СРК и микробиоту кишечника [6].
ВОЗМОЖНАЯ ПАТОФИЗИОЛОГИЧЕСКАЯ РОЛЬ МИКРОБИОТЫ КИШЕЧНИКА ПРИ СРК
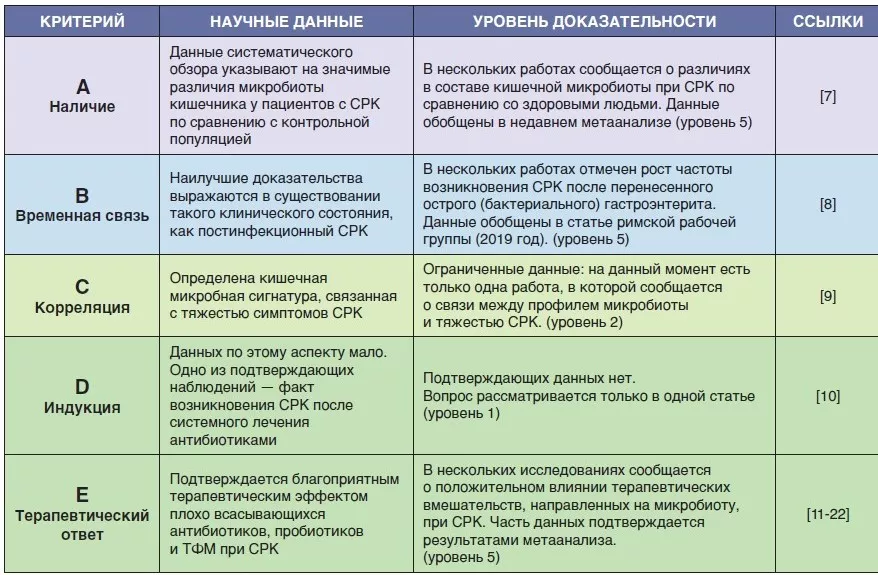
НАЛИЧИЕ ИЗМЕНЕННОЙ КИШЕЧНОЙ МИКРОБИОТЫ ПРИ СРК (A)
Первый критерий заключается в том, что изменения микробиоты кишечника обнаруживаются как минимум у части пациентов с СРК [6]. В нескольких исследованиях изучали наличие и типы изменений кишечной микробиоты при СРК по сравнению со здоровыми людьми. Pittayanon и соавт. опубликовали в 2019 году систематический обзор 24 исследований из 22 публикаций, в которых кишечную микробиоту пациентов с СРК (в основном взрослых) сравнивали с микробиотой здоровых людей [7]. Они пришли к выводу, что у пациентов с СРК представители семейства Enterobacteriaceae, семейства Lactobacillaceae и рода Bacteroides были представлены сильнее, а представители Clostridiales I, рода Faecalibacterium и рода Bifidobacterium — слабее по сравнению с контрольной группой [7]. Хотя эти наблюдения указывают на возможную связь между изменениями микробиоты и СРК, между результатами разных исследований наблюдалась значительная неоднородность, объемы выборок в основном были невелики, а большинство исследований проводилось в специализированных медицинских учреждениях. Кроме того, во многих исследованиях статистические данные не были скорректированы с учетом множественных анализов, не учитывались диетические факторы и предшествующее использование пробиотиков или антибиотиков. Также авторы не выявили различий между пациентами с разными подтипами стула [7]. Точно установить долю пациентов с СРК, у которых выявляются изменения состава микробиоты кишечника, оказалось невозможно.
ВРЕМЕННАЯ СВЯЗЬ МЕЖДУ ИЗМЕНЕНИЯМИ МИКРОБИОТЫ КИШЕЧНИКА И СИМПТОМАМИ СРК (B)
Наилучшие доказательства временной связи между изменениями микробиоты кишечника и возникновением симптомов СРК можно получить из клинических наблюдений, когда СРК развивается после перенесенной инфекции (ПИ-СРК) [8]. Приблизительно у 10% пациентов, перенесших инфекционный энтерит, развивается ПИ-СРК, при этом факторами риска являются женский пол, более молодой возраст, психологический дистресс во время гастроэнтерита и степень тяжести острой инфекции. Развитие ПИ-СРК связано с изменениями микробиома кишечника и нарушениями со стороны слизистой оболочки (слабая степень выраженности воспаления, гиперплазия энтероэндокринных клеток) [8]. В то же время изменения микробиоты при ПИ-СРК, по-видимому, отличаются от тех, которые описаны у пациентов с СРК в целом.
КОРРЕЛЯЦИЯ МЕЖДУ ВЫРАЖЕННОСТЬЮ ИЗМЕНЕНИЙ МИКРОБИОТЫ КИШЕЧНИКА И ТЯЖЕСТЬЮ СИМПТОМОВ СРК (C)
Очень немногие исследователи пытались соотнести тяжесть симптомов СРК со степенью изменения состава микробиоты кишечника, также известного как «дисбиоз». Большинство из них не выявили значимых корреляций между различиями в численности или составе фекальной микробиоты и тяжестью симптомов СРК [7, 9]. Гётеборгская группа ученых использовала метод машинного обучения на большом наборе данных пациентов с СРК, что дало возможность выявить микробные сигнатуры кишечника, позволяющие прогнозировать тяжесть симптомов СРК [9], т. е. была установлена количественная связь между изменениями микробиоты кишечника и тяжестью СРК. Однако полученные результаты требуют подтверждения в других исследованиях, в том числе на материале образцов пациентов, не получающих лечения, вариации тяжести симптомов которых могут быть еще более выраженными.
ИНДУКЦИЯ СИМПТОМОВ СРК У ЗДОРОВЫХ ДОБРОВОЛЬЦЕВ ЧЕРЕЗ ИЗМЕНЕНИЯ КИШЕЧНОЙ МИКРОБИОТЫ (D)
Четвертый критерий, описанный в оригинальной статье [6], является одним из наиболее сложных для проверки. У нас есть совсем немного данных для проверки возможных патофизиологических механизмов, лежащих в основе СРК, в том числе изменений микробиоты кишечника. Наибольшую доказательную ценность имеет наблюдение, когда СРК развивается после системной антибиотикотерапии инфекций, не затрагивающих желудочно-кишечный тракт [10]. Характер нарушений кишечной микробиоты после применения антибиотиков и их сходство с нарушениями при СРК до сих пор не изучены.
ОТВЕТ НА ЛЕЧЕНИЕ, НАПРАВЛЕННОЕ НА МОДУЛЯЦИЮ СОСТАВА КИШЕЧНОЙ МИКРОБИОТЫ (E)
У нас есть достаточный объем данных, чтобы предположить, что изменения состава микробиоты кишечника могут выступать в роли патофизиологического механизма возникновения СРК.
Об этом говорит хороший терапевтический эффект плохо всасывающихся антибиотиков, которые главным образом воздействуют на микробиоту кишечника [11, 12]. Результаты двух исследований с применением неомицина и пяти исследований с применением рифаксимина показали хорошую эффективность этих местных препаратов широкого спектра у пациентов с СРК без запора [11-14]. Кроме того, в исследовании по оценке безопасности и эффективности повторного лечения рифаксимином была показана эффективность такой терапии при рецидиве симптомов СРК [15].
Пробиотики определяются как препараты, содержащие живые микроорганизмы, которые приносят пользу человеку при приеме в достаточных количествах. Несколько метаанализов подтвердили эффективность различных пробиотиков в отношении улучшения симптомов СРК [11, 16]. Однако, неоднородность дизайнов и конечных точек, а также малое число исследований, посвященных конкретным типам пробиотиков, не позволяют сделать достоверные выводы об эффективности отдельных препаратов. Напротив, по данным недавних метаанализов пребиотики, т. е. субстраты, которые избирательно используются микроорганизмами, приносящими пользу для здоровья, не показали эффективности в улучшении симптомов СРК [11, 17].
Трансплантация фекальной микробиоты (ТФМ) — вероятно, самый прямой способ воздействия на микробиоту кишечника для контроля симптомов СРК [18]. Проведенные исследования показали крайне разнообразные результаты, от отсутствия эффекта и облегчения симптомов до их ухудшения, что привело к противоречивым выводам авторов метаанализов [19, 20]. Тем не менее, недавние исследования показали, что ТФМ-индуцированные изменения в составе микробиоты кишечника приносят как минимум временное облегчение симптомов, выраженность которого зависит от характеристик доноров [21, 22].
ТАБЛИЦА 1
Доказательства связи между измененной кишечной микробиотой и СРК.
НЕРЕШЕННЫЕ ВОПРОСЫ И БУДУЩИЕ ИССЛЕДОВАНИЯ
В целом изменения состава микробиоты кишечника соответствуют критериям того, чтобы их можно было рассматривать в качестве одного из патофизиологических механизмов, лежащих в основе СРК [6]. Эти данные обобщены на рисунке 2. Однако, налицо явная потребность в дополнительной информации и научных исследованиях. Необходимо проведение большего числа количественных и хорошо контролируемых исследований по изучению микробиоты кишечника при СРК у здоровых людей (контроль), с большим количеством участников, включая пациентов из неспециализированных лечебно-профилактических учреждений широкого профиля. Это позволит лучше понять изменения микробиоты кишечника при СРК на всех уровнях лечения, а также установить более точные связи между степенью изменений в составе микробиоты кишечника и тяжестью симптомов СРК. Кроме того, нужны продольные исследования для установления временной связи между изменениями микробиоты кишечника, характером и степенью тяжести симптомов во время и после рассматриваемого медицинского вмешательства.
Необходимы более качественные исследования пробиотиков при СРК с использованием стандартизированных протоколов лечения и валидированных конечных точек, аналогичных тем, которые используются в классической фармакологии. Наконец, ожидается, что будет получено много новых данных о ТФМ при СРК, что позволит определить наилучшие методики и эффективность процедуры.
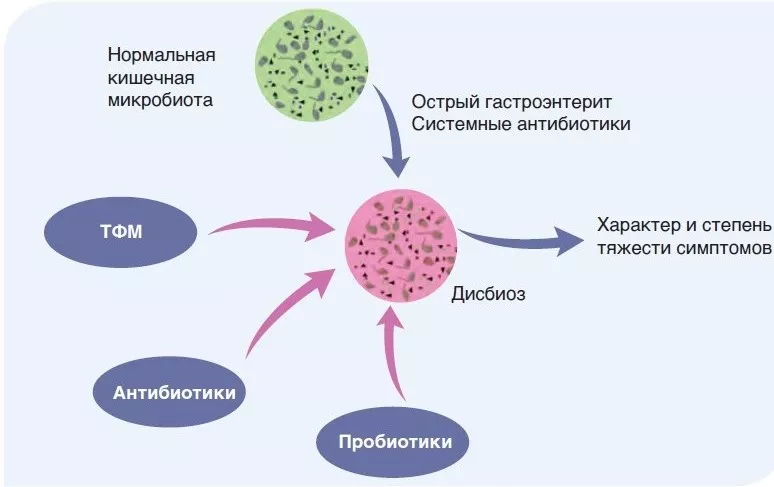
РИСУНОК 2
Патофизиологическая значимость изменений микробиоты кишечника при СРК.
Нормальный состав микробиоты кишечника отражает состояние здоровья и не связан с симптомами СРК. Острые состояния, такие как гастроэнтерит или системное применение антибиотиков, могут изменить состав микробиоты кишечника, что приводит к возникновению симптомов СРК. Состояние поддается лечению с помощью невсасывающихся антибиотиков, пробиотиков или трансплантации фекальной микробиоты.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016; 150: 1393-407.e5.
2 Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006; 130:1480-91.
3 Bonfrate L, Tack J, Grattagliano I, et al. Microbiota in health and irritable bowel syndrome: current knowledge, perspectives and therapeutic options. Scand J Gastroenterol 2013; 48: 995-1009.
4 Bajaj JS, Barbara G, DuPont HL, et al. New concepts on intestinal microbiota and the role of the non-absorbable antibiotics with special reference to rifaximin in digestive diseases. Dig Liver Dis 2018; 50: 741-9.
5 Margolis KG, Cryan JF, Mayer EA. The microbiota-gut-brain axis: from motility to mood. Gastroenterology 2021; 160: 1486-501.
6 Tack J, Corsetti M, Camilleri M, et al. Plausibility criteria for putative pathophysiological mechanisms in functional gastrointestinal disorders: a consensus of experts. Gut 2018; 67: 1425-33.
7 Pittayanon R, Lau JT, Yuan Y, et al. Microbiota in patients with irritable bowel syndrome-a systematic review. Gastroenterology 2019; 157: 97-108.
8 Barbara G, Grover M, Bercik P, et al. Rome Foundation Working Team Report on post-infection irritable bowel syndrome. Gastroenterology 2019; 156:46-58.e7.
9 Tap J, Derrien M, Törnblom H, et al. Identification of an intestinal microbiota signature associated with severity of irritable bowel syndrome. Gastroenterology 2017; 152: 111-123 e8.
10 Paula H, Grover M, Halder SL, et al. Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders. Neurogastroenterol Motil 2015; 27: 1580-6.
11 Ford AC, Harris LA, Lacy BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
12 Fodor AA, Pimentel M, Chey WD, et al. Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome. Gut Microbes 2019;10: 22-33.
13 Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol 2000; 95: 3503-6.
14 Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2003; 98, 412-9.
15 Lembo A, Pimentel M, Rao SS, et al. Repeat treatment with rifaximin is safe and effective in patients with diarrhea-predominant irritable bowel syndrome. Gastroenterology 2016; 151: 1113-21.
16 Li B, Liang L, Deng H, et al. Efficacy and safety of probiotics in irritable bowel syndrome: a systematic review and meta-analysis. Front Pharmacol 2020; 11: 332.
17 Wilson B, Rossi M, Dimidi E, et al. Prebiotics in irritable bowel syndrome and other functional bowel disorders in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2019; 109: 1098-111.
18 Goll R, Johnsen PH, Hjerde E, Diab J, Valle PC, Hilpusch F, Cavanagh JP. Effects of fecal microbiota transplantation in subjects with irritable bowel syndrome are mirrored by changes in gut microbiome. Gut Microbes 2020; 12: 1794263.
19 Myneedu K, Deoker A, Schmulson MJ, Bashashati M. Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J 2019; 7: 1033-41.
20 Ianiro G, Eusebi LH, Black CJ, Gasbarrini A, Cammarota G, Ford AC. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2019; 50: 240-8.
21 El-Salhy M, Hatlebakk JG, Gilja OH, et al. Efficacy of faecal microbiota transplantation for patients with irritable bowel syndrome in a randomised, double-blind, placebo-controlled study. Gut 2020; 69: 859-67.
22 Holvoet T, Joossens M, Vázquez-Castellanos JF, et al. Fecal Microbiota transplantation reduces symptoms in some patients with irritable bowel syndrome with predominant abdominal bloating: short- and long-term results from a placebo-controlled randomized trial. Gastroenterology 2021; 160: 145-57.e8.