Le microbiome pourrait-il être ciblé pour optimiser l'efficacité du vaccin contre le SARS-CoV-2 ?
Synthèse
Par la Dr. Genelle Healey
BC Children's Hospital Research Institute Université de Colombie-Britannique, Vancouver, Canada
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
L’objectif principal d’un vaccin efficace contre le SARS-CoV-2, qui est le principal espoir pour contrôler la pandémie de Covid-19, est de conférer une immunité robuste et durable au plus grand nombre possible de personnes vaccinées. Malgré le déploiement en cours de plusieurs vaccins à travers le monde pour gérer la pandémie de SARS-CoV-2, les flambées de Covid-19 démontrent que la pandémie est loin d’être derrière nous. Le développement de nouvelles stratégies pour aider à contrôler la propagation du virus et/ou accroître l’efficacité des vaccins contre le SARS-CoV-2 pourrait s’avérer utile dans la lutte contre le Covid-19.
Efficacité vaccinale contre le SARS-CoV-2
Les vaccins sont administrés dans le but de stimuler à la fois le système immunitaire inné et le système immunitaire adaptatif. Un biomarqueur fréquent d’immunité et de protection durables contre le SARSCoV- 2 est la réponse anticorps. Pour des raisons encore mal comprises, les réponses anticorps à la vaccination contre le SARS-CoV-2 sont très variables entre les différentes personnes [1]. Sur la base des résultats des essais cliniques, l’efficacité des vaccins autorisés est comprise entre 60 et 92 % contre les souches originales de SARS-CoV-2, mais la protection induite par le vaccin contre les variants préoccupants du SARS-CoV-2 (c’est-à-dire, alpha, bêta, delta et gamma) semble inférieure [2]. L’hétérogénéité des réponses vaccinales entre les personnes, la réduction de l’efficacité du vaccin avec les variants préoccupants et la décroissance potentielle de l’efficacité vaccinale avec le temps mettent tous en péril les efforts continus déployés pour contrôler la propagation du SARS-CoV-2. Par conséquent, mieux comprendre les facteurs déterminant les variations d’efficacité du vaccin contre le SARS-CoV-2 à court et à long terme est fondamental.
Facteurs impactant l'immunogénicité du vaccin
Les réponses immunitaires variant considérablement alors que chacun reçoit la même dose normalisée de vaccin, il est très probable que des facteurs autres que le type de vaccin influent sur l’efficacité vaccinale. Des données de plus en plus nombreuses tendent à indiquer que des facteurs comme l’âge, les maladies chroniques, les comportements inadaptés sur le plan de la santé, la dépression et le stress ont un impact sur la capacité du système immunitaire à répondre aux vaccins (Figure 1) [3-5]. Ces constatations ont été faites à travers plusieurs types de vaccins et il est donc probable qu’elles soient applicables aux vaccins contre le SARS-CoV-2. Il est intéressant de noter qu’il a également été montré que la plupart des facteurs mentionnés ci-dessus ont un impact sur la composition et la capacité fonctionnelle du microbiome intestinal. Il est donc plausible qu’une dysbiose du microbiome intestinal déterminée par des facteurs liés à l’hôte soit impliquée dans les divergences de réponses vaccinales observées.
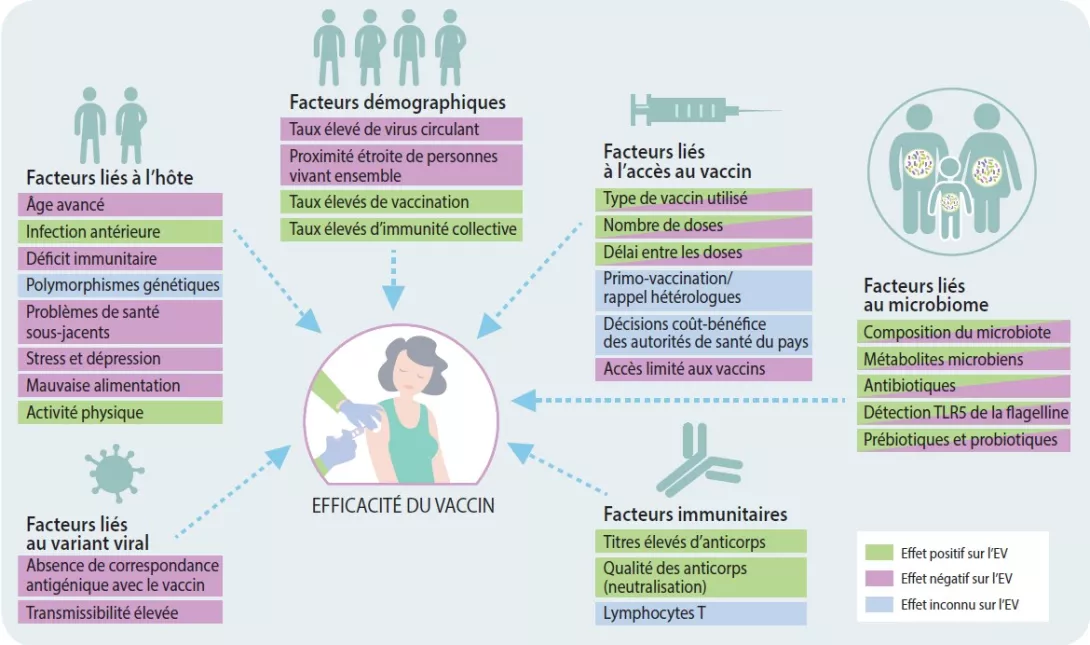
FIGURE 1
Facteurs influençant l’efficacité du vaccin.
Adapté de [14].
Cibler le microbiome intestinal pour accroître l'efficacité vaccinale ?
Le microbiote intestinal est un ensemble de bactéries, de champignons, de virus et d’archées qui résident dans le tractus gastro-intestinal et ont évolué conjointement avec leur hôte au fil du temps. Ces microbes accomplissent de nombreuses fonctions importantes, dont l’une est de réguler les réponses immunitaires locales et systémiques. Il est intéressant de souligner que certains profils du microbiote intestinal (c’est-à-dire, abondance supérieure d’actinobactéries, de Clostridium cluster XI et de protéobactéries) ont été associés à une immunogénicité vaccinale supérieure contre des infections virales telles que le VIH, la grippe et le rotavirus [6-8]. Une étude récente a indiqué qu’une perturbation spécifique des antibiotiques du microbiome intestinal (c’est-à-dire, dysbiose) conduisait à une altération de la neutralisation des anticorps induits par le vaccin antigrippal, ainsi qu’à des concentrations plus faibles de réponses anticorps induites par le vaccin [9]. Une autre étude utilisant un traitement antibiotique et des souris exemptes de germes a démontré que la détection d’un composant de motilité bactérienne (la flagelline) par un récepteur situé sur les cellules immunitaires (toll-like receptor 5 [TLR5]) était nécessaire pour déclencher une réponse vaccinale robuste [8]. Cette étude, ainsi que d’autres études similaires [10], démontrent le rôle important joué par le microbiote intestinal dans l’efficacité vaccinale (Figure 1). Toutefois, aucune étude menée jusqu’à maintenant n’a évalué l’impact du microbiote intestinal sur l’efficacité du vaccin contre le SARS-CoV-2. Par conséquent, de futures recherches déterminant si des signatures spécifiques du microbiote intestinal ont un impact sur l’efficacité du vaccin contre le SARS-CoV-2, sont essentielles. En outre, des traitements ciblant le microbiome, c’est-à-dire par prébiotiques et probiotiques [11], pourraient être utilisés en tant qu’adjuvant vaccinal (un agent utilisé pour accélérer, stimuler et/ou prolonger des réponses immunitaires spécifiques d’un anticorps) afin d’accroître l’immunogénicité du vaccin contre le SARS-CoV-2. Spécifiquement, il a été montré que l’administration intra-nasale de bactéries à acide lactique (par exemple, Bifidobacterium et Lactobacillus) accroît la résistance aux infections virales et améliore l’efficacité du vaccin antigrippal [12, 13] ; par conséquent, des bactéries vivantes (probiotiques) pourraient stimuler les réponses immunitaires spécifiques du vaccin de rappel lorsqu’elles sont administrées simultanément avec les vaccins contre le SARS-CoV-2.
Conclusion
Indépendamment du déploiement mondial du vaccin et des mesures ciblées de santé publique, la pandémie de COVID-19 persiste. Les vaccins constituent le principal espoir pour le contrôle du SARSCoV- 2, mais l’hétérogénéité des réponses vaccinales compromet la lutte contre le Covid-19. Plusieurs facteurs liés au microbiome intestinal ont été impliqués dans la modification de l’immunogénicité vaccinale. Par conséquent, l’utilisation du microbiome intestinal en tant qu’adjuvant vaccinal a le potentiel d’améliorer l’efficacité du vaccin contre le SARS-CoV-2.
1 Amodio E, Capra G, Casuccio A, et al. Antibodies responses to SARS-CoV-2 in a large cohort of vaccinated subjects and seropositive patients. Vaccines 2021; 9(7): 714.
2 Gupta RK. Will SARS-CoV-2 variants of concern affect the promise of vaccines? Nat Rev Immunol 2021; 21(6): 340-1.
3 Collier DA, Ferreira IATM, Kotagiri P, et al. Age-related immune response heterogeneity to SARS-CoV-2 vaccine BNT162b2. Nature 2021; 596(7872): 417-22.
4 Grupper A, Rabinowich L, Schwartz D, et al. Reduced humoral response to mRNA SARSCoV-2 BNT162b2 vaccine in kidney transplant recipients without prior exposure to the virus. Am J Transplant 2021; 21: 2719-26.
5 Madison AA, Shrout MR, Renna ME, et al. Psychological and behavioural predictors of vaccine efficacy: Considerations for Covid-19. Perspect Psychol Sci 2021; 16(2): 191-203.
6 Harris VC, Armah G, Fuentes S et al. Significant correlation between the infant gut microbiome and rotavirus vaccine response in rural Ghana. J Infect Dis 2017; 215(1): 34-41.
7 Cram JA, Fiore-Gartland AJ, Srinivasan S, et al. Human gut microbiota is associated with HIV-reactive immunoglobulin at baseline and following HIV vaccination. PLoS One 2019; 14(12): e0225622.
8 Oh JZ, Ravindran R, Chassaing B, et al. TLR5-mediated sensing of gut microbiota is necessary for antibody responses to seasonal influenza vaccination. Immunity 2014; 41(3): 478-92.
9 Hagan T, Cortese M, Rouphael N, et al. Antibiotics-driven gut microbiome perturbation alters immunity to vaccines in humans. Cell 2019; 178(6): 1313-28.e13.
10 Harris VC, Haak BW, Handley SA, et al. Effect of antibiotic-mediated microbiome modulation on rotavirus vaccine immunogenicity: A human, randomized-control proof-of-concept trial. Cell Host Microbe 2018; 24(2): 197-207.e4.
11 Lei WT, Shih PC, Liu SJ, et al. Effect of probiotics and prebiotics on immune response to influenza vaccination in adults: a systematic review and meta-analysis of randomized controlled trials. Nutrients 2017; 9(11): 1175.
12 Belkina TV, Averina OV, Savenkova EV, Danilenko VN. Human intestinal microbiome and the immune system: The role of probiotics in shaping an immune system unsusceptible to Covid-19 infection. Bio Bull Rev 2021, 11(4): 329-43.
13 Taghinezhad S, Mohseni AH, Bermúdez-Humarán LG, et al. Probiotic-based vaccines may provide effective protection against Covid-19 acute respiratory disease. Vaccine 2021; 9(5): 466.
14 Tregoning JS, Flight KE, Higham SL, et al. Progress of the Covid-19 vaccine effort: viruses, vaccines and variants versus efficacy, effectiveness and escape. Nat Rev Immunol 2021; 21(10): 626-36.





