Les associations entre ethnicité et sensibilisation alimentaire sont médiées par le développement du microbiote intestinal au cours de la première année de vie
Article commenté - Rubrique enfant
Par le Pr. Emmanuel Mas
Gastro-entérologie et nutrition, Hôpital des enfants, Toulouse, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Commentaire de l'article original de Tun HM et al. Gastroenterology 2021 [1]
L’implication du microbiote intestinal, au début de la vie, dans le développement des maladies atopiques, est de plus en plus soulignée, mais pendant la petite enfance, les changements écologiques du microbiote intestinal en lien avec la sensibilisation alimentaire restent peu clairs. Les auteurs ont cherché à caractériser et à associer ces changements au développement de la sensibilisation alimentaire chez les enfants. Dans cette étude observationnelle, en utilisant le séquençage de l’ARNr 16S, les auteurs ont caractérisé la composition de 2 844 microbiotes fécaux chez 1 422 enfants canadiens nés à terme. L’évaluation de sensibilisation atopique a été mesurée par des tests cutanés à l’âge de 1 an et de 3 ans. Quatre trajectoires du développement du microbiote intestinal ont été identifiées, elles seraient façonnées par le mode d’accouchement et l’origine ethnique. Cette étude a permis d’établir un lien entre la persistance d’une faible abondance de Bacteroides dans l’intestin tout au long de la petite enfance et la sensibilisation aux arachides pendant l’enfance. Elle est la première à montrer un rôle de médiation du microbiote intestinal du nourrisson dans le développement de la sensibilisation alimentaire associée à l’ethnicité.
Que sait-on déjà à ce sujet ?
Le nombre d'enfants ayant une allergie alimentaire est en forte augmentation, représentant actuellement 28% des enfants américains âgés de 1 à 5 ans. La mise en place du microbiote intestinal (MI) au cours des premiers mois de vie pourrait être impliquée dans cette sensibilisation aux allergènes alimentaires [2]. De nombreux facteurs influencent l'établissement du MI, comme le mode d'accouchement (césarienne vs voie vaginale), le type d’allaitement (maternel ou formules infantiles) et l’utilisation d’antibiotiques [3, 4]. Une étude récente a montré que la structure du MI variait aussi significativement entre différents groupes ethniques [5].
Par ailleurs, le transfert de MI d’enfants sains à des souris protège celles-ci de l’allergie aux protéines du lait de vache. Un MI pauvre chez le jeune nourrisson et un taux élevé d’Enterobacteriaceae/Bacteroidaceae (E/B) chez les nourrissons jeunes et âgés sont des facteurs prédicitifs de sensiblisation aux allergènes alimentaires [6].
Quels sont les principaux résultats apportés par cette étude ?
L’étude a inclus 1 422 enfants de la cohorte CHILD (Canadian Healthy Infant Longitudinal Development), et des des prick-tests ont été réalisés (pneumallergènes et allergènes alimentaires) à l’âge de 1 et 3 ans. Des échantillons de selles ont été prélevés précocement (3,5 ± 0,9 mois) et tardivement (12,2 ± 0,3 mois).
La prévalence d’atopie était de 12 % à 1 an et de 12,8 % à 3 ans, avec 9,5 et 5,8 % de sensibilisation alimentaire et 3,3 et 10,1 % de sensibilisation aux pneumallergènes à 1 et 3 ans respectivement.
Le MI tardif avait une diversité béta et une variabilité intra-individuelle plus faibles que le MI précoce (p < 0,001). Le MI tardif était enrichi en Bacteroides, Faecalibacterium, Lachnospira, Prevotella, Lachnospiraceae non-classés et Clostridiales non classés, mais pauvre en Clostridium, Veillonella, Bifidobacterium et Enterobacteriaceae non classés. L’analyse en composantes principales avait permis d’individualiser 2 clusters (C1 et C2, Figure 1). C1 était composé à 75,5 % d’échantillons précoces et C2 à 63,7 % d’échantillons tardifs ; les échantillons précoces et tardifs des enfants nés par voie basse sans antibioprophylaxie intrapartum étaient de type C2, dominés par le genre Bacteroides (Figure 2).
Les auteurs ont déterminé 4 trajectoires en fonction du type de cluster précoce et tardif : C1-C1, C1-C2, C2-C1 et C2-C2. La trajectoire C1-C1 est plus fréquente chez les nourrissons asiatiques que caucasiens (p < 0,05), de même que chez les enfants à risque atopique vs la trajectoire C2-C2 (OR 1,9 ; IC 95 % 1,15-3,14) ou C1-C2 (OR 2,38 ; IC 95 % 1,43-3,96). Les nourrissons de la trajectoire C1-C1 avaient 2 fois plus de risques de sensibilisation alimentaire à 3 ans que ceux des trajectoires C2-C2 (OR 2,34 ; IC 95 % 1,20-4,56) et C1-C2 (OR 2,60 ; IC 95 % 1,33-5,09), notamment à la cacahuète (vs C2-C2 = OR 2,82 ; IC 95% 1,13-6,01 et vs C1-C2 = OR 2,01 ; IC 95% 0,85-4,78) (Figure 3). Les enfants qui n’acquéraient pas de sensibilisation à la cacahuète à 3 ans avaient, de manière persistante, au cours de l’enfance, un taux plus élevé de Bacteroides (p = 0,044), plus bas d’Enterobacteriaceae non classés (p = 0,001) et un ratio E/B plus bas (p = 0,013).
La trajectoire C1-C1 du MI jouait le rôle de médiateur du risque de sensibilisation alimentaire et à la cacahuète chez les enfants d’origine asiatiques. L’association était même forte pour la cacahuète (OR 7,87 ; IC 95 % 2,75-22,55). Les nourrissons de la trajectoire C1-C1 étaient plus souvent colonisés avec C. difficile ; ces mêmes enfants, à la double caractéristique C1-C1 et colonisés à C. difficile, avaient un risque supérieur de sensibilisation alimentaire (OR 5,69 ; IC 95 % 1,62-19,99) et à la cacahuète (OR 5,89 ; IC 95% 1,16-29,87).
Enfin, le microbiote de la trajectoire C1-C1 avait un déficit dans le métabolisme des sphingolipides et de fonctions liées à la biosynthèse des glycosphingolipides.
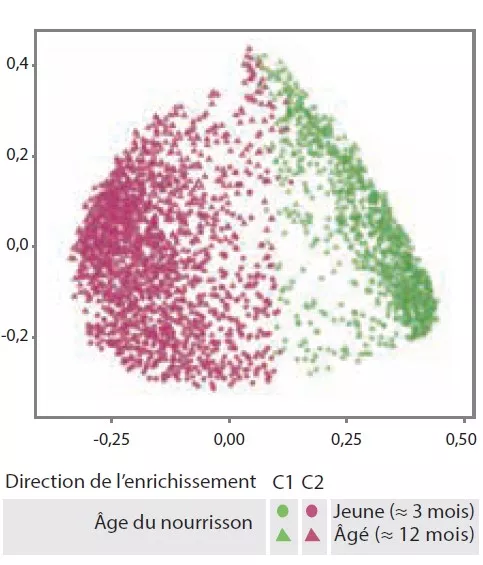
FIGURE 1
Clusters du microbiote intestinal C1 et C2
(analyse en composantes principales).
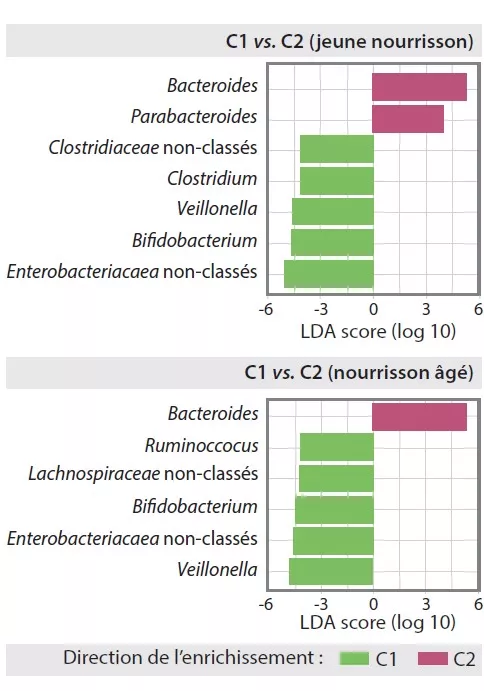
FIGURE 2
Composition du microbiote intestinal dans les clusters C1 et C2 précocement ou tardivement chez les nourrissons.
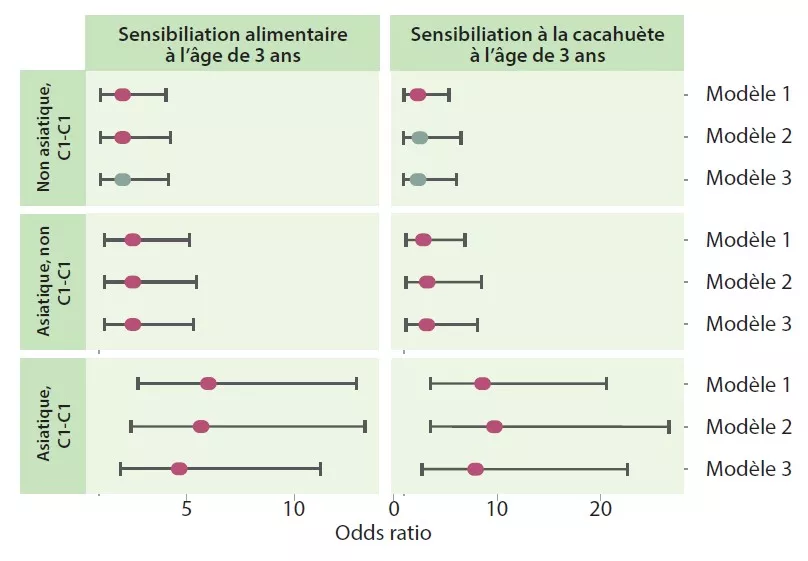
FIGURE 3
Sensibilisation alimentaire et à la cacahuète à 3 ans en fonction de la trajectoire C1-C1 et de l’origine asiatique de la mère.
Quelles sont les conséquences en pratique ?
Cette étude permet d’envisager des perspectives thérapeutiques ciblant le MI dans l’allergie alimentaire des nourrissons, soit en préventif, soit en thérapeutique.
Points clés
- Lors de la mise en place du microbiote intestinal au cours de la 1re année de vie, la persistance de taux faibles de Bacteroides augmente le risque de sensibilisation alimentaire,notamment à la cacahuète.
- Ce risque est majoré chez les nouveau-nés de mères asiatiques
Conclusion
Cette étude a montré différentes trajectoires de développement du MI au cours de la 1re année de vie. Elle confirme l’impact du mode d’accouchement sur le MI. La persistance de taux faibles de Bacteroides était associée à un risque de sensibilisation alimentaire, notamment chez les nouveau-nés de mères asiatiques ou ceux colonisés à C. difficile.
1 Tun HM, Peng Y, Chen B, et al. Ethnicity associations with food sensitization are mediated by gut microbiota development in the first year of life. Gastroenterology 2021 ; 161 : 94-106.
2 Zhao W, Ho HE, Bunyavanich S. The gut microbiome in food allergy. Ann Allergy Asthma Immunol 2019 ; 122 : 276–82.
3 Dominguez-Bello MG, Costello EK, Contreras M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A 2010 ; 107 : 11971–5.
4. Bokulich NA, Chung J, Battaglia T, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life. Sci Transl Med 2016 ; 8 : 343ra82.
5 Gupta VK, Paul S, Dutta C. Geography, ethnicity or subsistence specific variations in human microbiome composition and diversity. Front Microbiol 2017 ; 8 : 1162
6 Feehley T, Plunkett CH, Bao RY, et al. Healthy infants harbor intestinal bacteria that protect against food allergy. Nature Medicine 2019 ; 25 : 448.