Las asociaciones entre etnicidad y sensibilización alimentaria están mediadas por el desarrollo de la microbiota intestinal durante el primer año de vida
Artículo comentado - Niño
Por el Prof. Emmanuel Mas
Gastroenterología y nutrición, Hospital de Niños, Toulouse, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Comentario sobre el artículo original de Tun HM et al. Gastroenterology 2021 [1]
Cada vez se pone más énfasis en la implicación de la microbiota intestinal, durante las etapas tempranas de la vida, en la aparición de enfermedades atópicas. Sin embargo, los cambios ecológicos de la microbiota intestinal relacionados con la sensibilización alimentaria durante la primera infancia siguen sin dilucidarse. Los autores trataron de caracterizar y relacionar estos cambios con el desarrollo de la sensibilización alimentaria en niños. En este estudio observacional, sirviéndose de la secuenciación del ARNr 16S, los autores caracterizaron la composición de 2844 microbiotas fecales en 1422 niños canadienses nacidos a término. La evaluación de la sensibilización atópica se midió mediante pruebas cutáneas a la edad de 1 y 3 años. Se identificaron cuatro trayectorias del desarrollo de la microbiota intestinal, configuradas por el tipo de parto y por el origen étnico. Este estudio ha permitido establecer una relación entre la persistencia de una baja abundancia de Bacteroides en el intestino durante la primera infancia y la sensibilización a los cacahuetes en la niñez. Es el primero que ha demostrado que la microbiota intestinal del lactante desempeña una función mediadora en la aparición de la sensibilización alimentaria relacionada con la etnicidad.
¿Qué se sabe ya sobre este tema?
El número de niños con alergias alimentarias aumenta con rapidez, y actualmente representa el 28% de los niños americanos de entre 1 y 5 años. Es posible que el desarrollo de la microbiota intestinal (MI) durante los primeros meses de vida esté implicada en esta sensibilización a los alérgenos alimentarios [2]. Numerosos factores influyen en el establecimiento de la MI, como el tipo de parto (por cesárea o vaginal), el tipo de lactancia (materna o de fórmula) y la utilización de antibióticos [3, 4]. Un estudio reciente ha demostrado que la estructura de la MI varía también significativamente entre distintos grupos étnicos [5].
Además, la transferencia de MI de niños sanos a ratones protege a estos últimos de la alergia a proteínas de la leche de vaca. Una MI deficiente en lactantes jóvenes y un alto nivel de Enterobacteriaceae/Bacteroidaceae (E/B) en lactantes jóvenes y mayores son factores predictivos de sensibilización a los alérgenos alimentarios [6].
¿Cuáles son los principales resultados aportados por este estudio?
El estudio incluyó a 1422 niños de la cohorte Canadian Healthy Infant Longitudinal Development (CHILD por sus siglas en inglés), a quienes se realizaron pruebas intraepidérmicas (neumoalérgenos y alérgenos alimentarios) a la edad de 1 y 3 años. Se tomaron muestras de heces tempranas (3,5 ± 0,9 meses) y tardías (12,2 ± 0,3 meses).
La prevalencia de la atopia fue del 12% al año y del 12,8% a los 3 años, con un 9,5% y un 5,8% de sensibilización alimentaria y un 3,3% y un 10,1% de sensibilización a los neumoalérgenos al año y a los 3 años respectivamente.
La MI tardía presentaba una diversidad beta y una variabilidad entre individuos inferiores a las de la MI temprana (p < 0,001). La MI tardía era rica en Bacteroides, Faecalibacterium, Lachnospira, Prevotella, Lachnospiraceae sin clasificar y Clostridiales sin clasificar, pero pobre en Clostridium, Veillonella, Bifidobacterium y Enterobacteriaceae sin clasificar. El análisis de los componentes principales permitió individualizar 2 agrupaciones (C1 et C2, Figura 1). C1 estaba compuesta por un 75,5% de muestras tempranas y C2 por un 63,7% de muestras tardías, las muestras tempranas y tardías de los niños nacidos por parto vaginal sin profilaxis antibiótica durante el parto eran de tipo C2, dominadas por el género Bacteroides (Figura 2).
Los autores determinaron 4 trayectorias en función del tipo de agrupación temprana y tardía: C1-C1, C1-C2, C2-C1 y C2-C2. La trayectoria C1-C1 es más frecuente en lactantes asiáticos que en caucásicos (p < 0,05), así como en niños con riesgo atópico, frente a la trayectoria C2-C2 (OR 1,9; IC 95% 1,15-3,14) o C1-C2 (OR 2,38; IC 95% 1,43-3,96). Los lactantes con trayectoria C1-C1 tenían el doble de riesgo de sensibilización alimentaria a los 3 años que los de la trayectoria C2-C2 (OR 2,34; IC 95% 1,20-4,56) y C1-C2 (OR 2,60; IC 95% 1,33-5,09), en concreto a los cacahuetes (frente a C2-C2 = OR 2,82; IC 95% 1,13-6,01 y frente a C1-C2 = OR 2,01; IC 95% 0,85-4,78) (Figura 3). Los niños que no adquirieron sensibilización a los cacahuetes a los 3 años tenían un nivel más elevado de Bacteroides (p = 0,044), más bajo de Enterobacteriaceae sin clasificar (p = 0,001) y una relación E/B más baja (p = 0,013) de forma persistente a lo largo de la infancia.
La trayectoria C1-C1 de la MI actuó como mediadora del riesgo de sensibilización alimentaria y a los cacahuetes en niños de origen asiático. La asociación era fuerte incluso para los cacahuetes (OR 7,87; IC 95%: 2,75-22,55). Los lactantes de trayectoria C1-C1 presentaban colonización de C. difficile más a menudo; estos mismos niños, con la doble característica C1-C1 y colonizados con C. difficile, tenían un mayor riesgo de sensibilización alimentaria (OR 5,69; IC 95% 1,62-19,99) y a los cacahuetes (OR 5,89; IC 95% 1,16-29,87).
Por último, la microbiota de la trayectoria C1-C1 presentaba un déficit en el metabolismo de los esfingolípidos y de las funciones relacionadas con la biosíntesis de los glucoesfingolípidos.
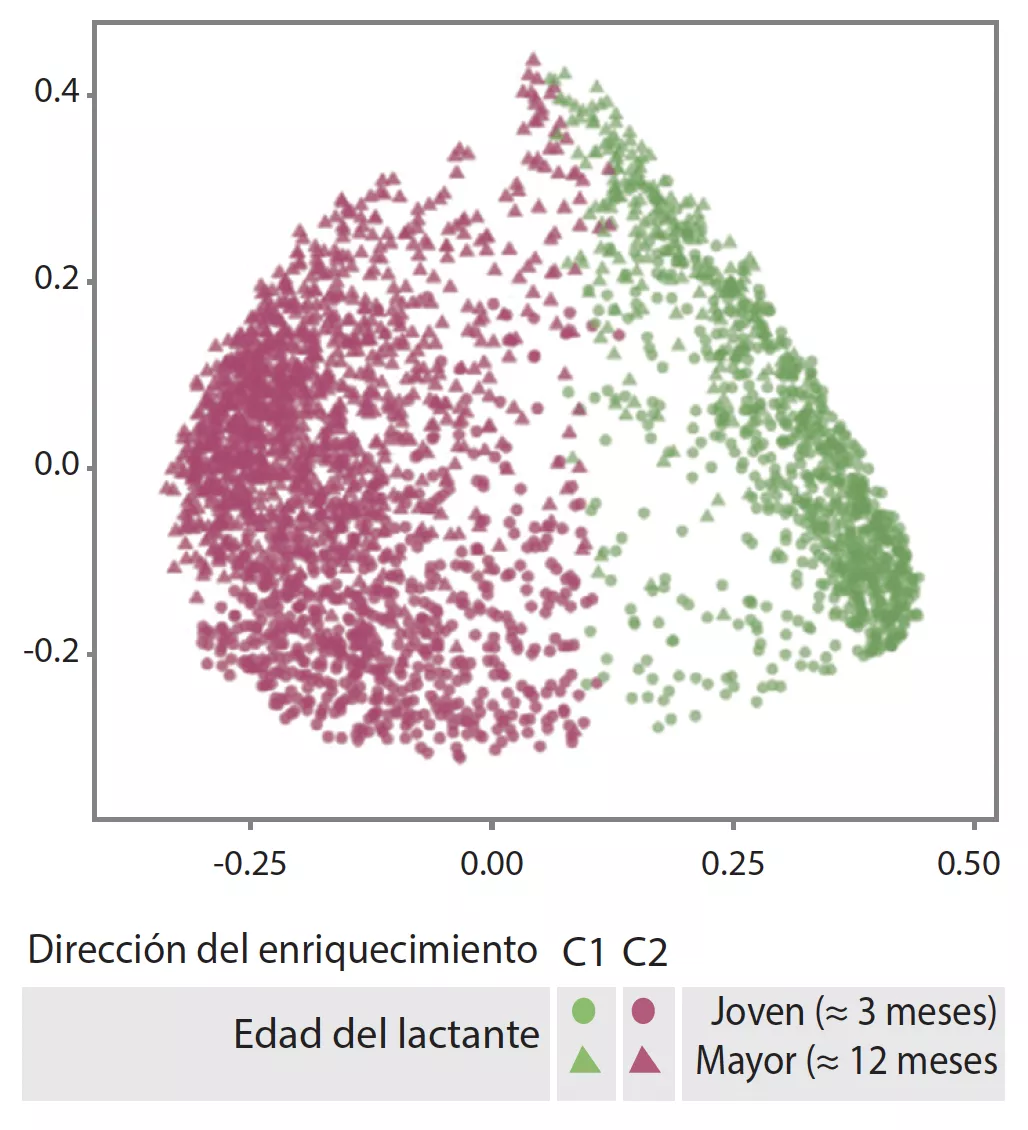
Agrupaciones de la microbiota intestinal C1 y C2 (análisis de los componentes principales).
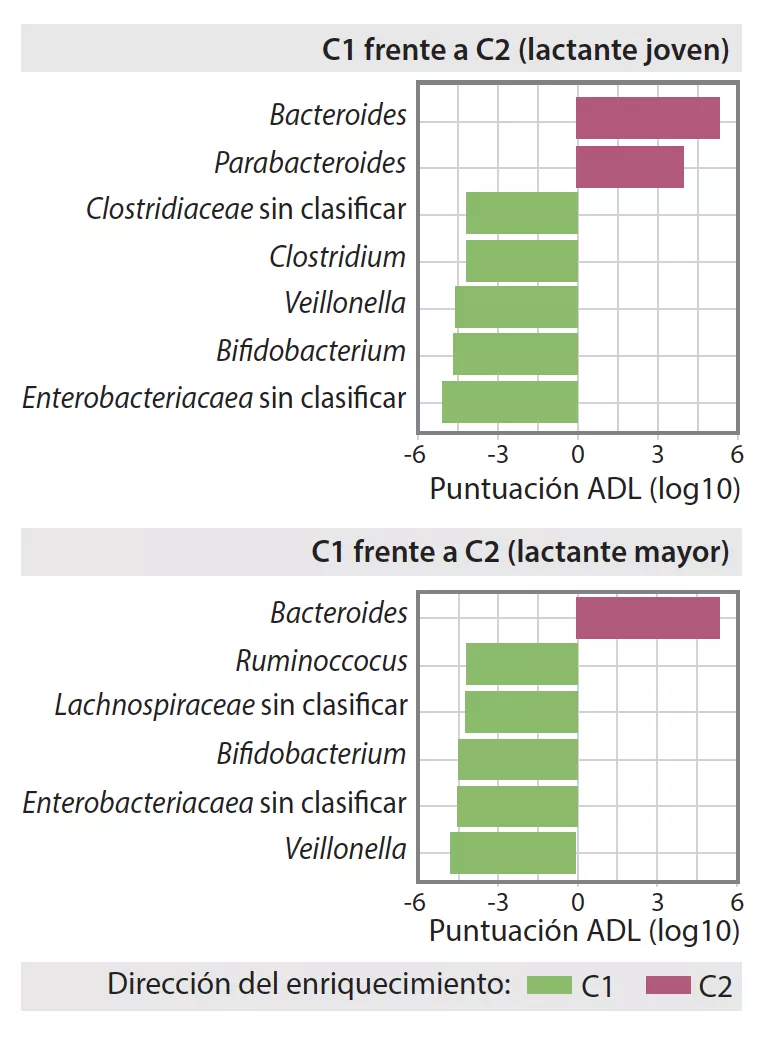
Composición de la microbiota intestinal en las agrupaciones C1 y C2 tempranas o tardías en los lactantes.
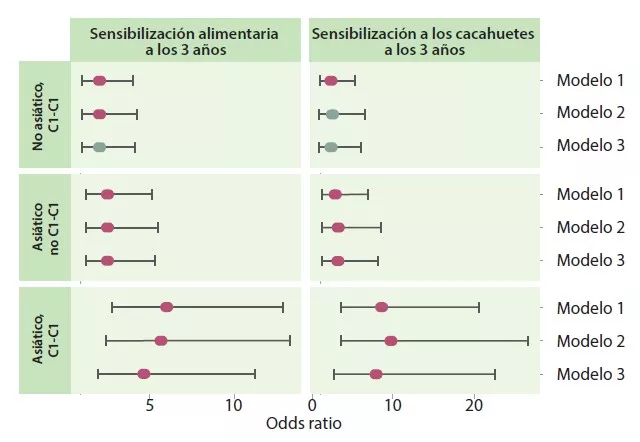
Figura 3
Sensibilización alimentaria y a los cacahuetes a los 3 años en función de la trayectoria C1-C1 y del origen asiático de la madre.
¿Cuáles son las consecuencias en la práctica?
Este estudio permite plantearse perspectivas terapéuticas dirigidas a la MI en la alergia alimentaria de los lactantes, bien como medida preventiva, bien como medida terapéutica.
Puntos clave
- Durante la implantación de la microbiota intestinal en el primer año de vida, la persistencia de niveles bajos de Bacteroides aumenta el riesgo de sensibilización alimentaria, especialmente a los cacahuetes
- Este riesgo aumenta en recién nacidos de madres asiáticas
Conclusión
Este estudio demostró distintas trayectorias de desarrollo de la MI durante el primer año de vida. Además, confirmó la influencia del tipo de parto en la MI. La persistencia de niveles bajos de Bacteroides se asoció a un riesgo de sensibilización alimentaria, en concreto en recién nacidos de madres asiáticas o que estaban colonizados con C.difficile.
1 Tun HM, Peng Y, Chen B, et al. Ethnicity associations with food sensitization are mediated by gut microbiota development in the first year of life. Gastroenterology 2021 ; 161 : 94-106.
2 Zhao W, Ho HE, Bunyavanich S. The gut microbiome in food allergy. Ann Allergy Asthma Immunol 2019 ; 122 : 276–82.
3 Dominguez-Bello MG, Costello EK, Contreras M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A 2010 ; 107 : 11971–5.
4. Bokulich NA, Chung J, Battaglia T, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life. Sci Transl Med 2016 ; 8 : 343ra82.
5 Gupta VK, Paul S, Dutta C. Geography, ethnicity or subsistence specific variations in human microbiome composition and diversity. Front Microbiol 2017 ; 8 : 1162
6 Feehley T, Plunkett CH, Bao RY, et al. Healthy infants harbor intestinal bacteria that protect against food allergy. Nature Medicine 2019 ; 25 : 448.