Comment les analgésiques peuvent favoriser le développement de superbactéries
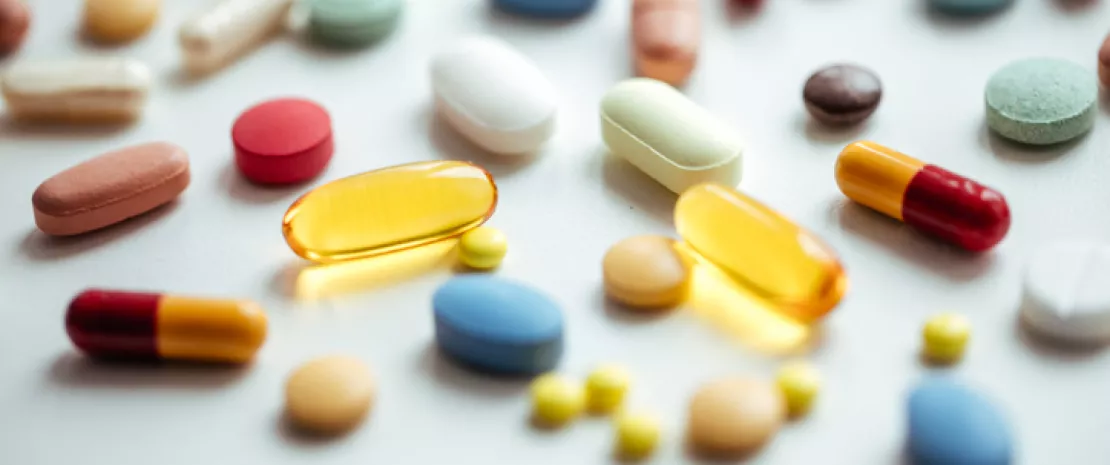
Nous supposons que les antibiotiques favorisent la résistance. Pourtant, de nouvelles données révèlent que des médicaments courants non antibiotiques, comme l'ibuprofène, déclenchent la mutagenèse d'E. coli. Au niveau intestinal, ils activent les pompes d'efflux, créant ainsi une résistance élevée. Ce mécanisme caché modifie radicalement notre compréhension de la polypharmacie et des soins aux patients.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
A propos de cet article
Nous considérons souvent la résistance aux antimicrobiens (RAM) comme une conséquence directe de la surutilisation des antibiotiques. Cependant, une nouvelle étude convaincante publiée dans npj Antimicrobials & Resistance bouleverse ce paradigme en révélant que les médicaments « non antibiotiques » courants, que vos patients prennent probablement tous les jours, pourraient être les moteurs silencieux de cette crise sanitaire mondiale, en particulier dans les établissements de soins pour personnes âgées 1.
Les facteurs cachés dans l'armoire à pharmacie
Nous savons que le microbiome intestinal est un écosystème complexe. Des chercheurs ont examiné comment Escherichia coli, un micro-organisme communément présent dans l'intestin et pathogène, réagit à neuf médicaments non antibiotiques (MNA) largement utilisés et couramment prescrits dans les établissements résidentiels pour personnes âgées (RACF), notamment l'ibuprofène, l'acétaminophène (paracétamol) et l'atorvastatine. Les scientifiques de l'Université d'Australie du Sud ne se sont pas contentés de verser des médicaments dans une boîte de Pétri ; ils ont modélisé des « concentrations spécifiques pertinentes pour l'intestin » afin d'imiter l'environnement physiologique réel d'un patient prenant ces médicaments par voie orale.
Il semble que ces médicaments ne soient pas biologiquement inertes en ce qui concerne l'évolution bactérienne. Bien qu'ils ne tuent pas les bactéries comme le font les antibiotiques, ils exercent un stress qui modifie fondamentalement le comportement bactérien. Plus précisément, l'étude s'est concentrée sur la question de savoir si ces médicaments courants pouvaient renforcer la (sidenote: Mutagenèse Processus biologique par lequel l'information génétique d'un organisme est modifiée, entraînant une mutation. ) lorsque les bactéries étaient également exposées à la ciprofloxacine, un antibiotique de la famille des fluoroquinolones fréquemment utilisé pour traiter les infections urinaires chez les personnes âgées.
Quand les analgésiques imitent les antibiotiques
Les facteurs les plus puissants de résistance n'étaient pas les médicaments obscurs, mais les analgésiques courants. Les données ont montré que l'ibuprofène et l'acétaminophène augmentaient considérablement la fréquence des mutations chez E. coli. Lorsqu'elles étaient exposées à ces analgésiques en même temps que la ciprofloxacine, les bactéries développaient une résistance élevée beaucoup plus rapidement qu'avec l'antibiotique seul.
Le mécanisme découvert est à la fois sophistiqué et alarmant. Les chercheurs ont utilisé le (sidenote: Séquençage complet du génome Méthode de laboratoire complète utilisée pour déterminer la séquence ADN complète du génome d'un organisme. Les chercheurs ont utilisé cette technique pour identifier des mutations spécifiques dans des gènes de résistance tels que GyrA, MarR et AcrR. ) pour identifier les mutations clés : non seulement dans la cible de l'antibiotique, le (sidenote: Gène GyrA Gène qui code une sous-unité spécifique de l'enzyme ADN gyrase, qui agit comme cible biologique principale des antibiotiques fluoroquinolones tels que la ciprofloxacine. Des mutations dans ce gène peuvent empêcher l'antibiotique de se lier efficacement, entraînant une résistance. ) , mais aussi, et surtout, dans les gènes MarR et AcrR, qui régulent les (sidenote: Pompes d'efflux Protéines de transport cellulaire (plus précisément AcrAB-TolC dans ce contexte) utilisées par les bactéries pour expulser activement les substances toxiques de l'intérieur de la cellule. Le texte les décrit comme agissant comme une « pompe de cale » interne pour évacuer à la fois le médicament et l'antibiotique. ) . Il est important de noter que la présence d'analgésiques courants tels que l'ibuprofène ou l'acétaminophène induit une surexpression de la pompe d'efflux AcrAB-TolC par les bactéries. Cette action s'apparente à l'activation par les bactéries d'une « pompe de cale » interne pour expulser le médicament, ce qui élimine simultanément l'antibiotique et, de manière inquiétante, renforce la résistance génétique.
Le multiplicateur de la polypharmacie
L'étude est allée plus loin en simulant la « (sidenote: Polypharmacie Utilisation simultanée de plusieurs médicaments par un même patient. Cette pratique est courante dans les établissements de soins aux personnes âgées et s'est avérée augmenter considérablement le niveau de résistance aux antibiotiques chez les bactéries exposées à des combinaisons de médicaments. ) », c'est-à-dire l'utilisation de plusieurs médicaments, qui est courante chez de nombreux patients âgés. Lorsque E. coli a été exposée simultanément à deux NAM (comme l'ibuprofène et le diclofénac), les résultats ont été frappants. Si la fréquence des mutations n'a pas nécessairement explosé, le niveau de résistance, lui, a augmenté de manière spectaculaire. Certaines mutations ont présenté une augmentation stupéfiante de 64 fois la résistance à la ciprofloxacine par rapport au type sauvage. Cela suggère que le « cocktail » de médicaments couramment utilisé dans les soins aux personnes âgées pourrait créer un terrain propice à l'évolution de « superbactéries ». La conclusion à tirer n'est pas d'arrêter de prescrire des analgésiques, mais de considérer ces médicaments avec un nouveau respect. Ils participent activement à l'environnement microbien et sont capables d'accélérer les mécanismes de résistance qui menacent la santé publique.