Helicobacter pylori et microbiote gastro-intestinal
Par le Pr. Juozas Kupcinskas
Département de gastro-entérologie et Institut de recherche digestive, université lituanienne des sciences de la santé, Kaunas, Lituanie
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
L’infection par Helicobacter pylori (H. pylori) touche environ 50 % de la population mondiale et il s’agit de l’infection bactérienne la plus fréquente au monde. D’après l’Organisation mondiale de la Santé (OMS), H. pylori est classée agent cancérigène du groupe 1, pouvant être à l’origine d’affections précancéreuses et cancéreuses de l’estomac, dont l’adénocarcinome gastrique. On pensait auparavant que H. pylori était le seul micro-organisme à vivre dans l’estomac humain, mais les récentes avancées technologiques ont permis de mieux comprendre le microbiote gastrique. H. pylori joue un rôle pivot dans le façonnage de l’environnement microbien de l’estomac. Cependant, un microbiote gastrique « non-Helicobacter » a également été décrit et fait actuellement l’objet de nombreuses recherches. Il est clair que H. pylori est un facteur modulateur majeur du microbiote gastrique, mais d’autres espèces pourraient également contribuer à des mécanismes cancérigènes. Les effets exercés par les inhibiteurs de la pompe à protons (IPP) et les traitements visant à éradiquer H. pylori sur les altérations du microbiote ont aussi été étudiés. Dans cet article de synthèse, nous allons résumer les dernières découvertes réalisées sur le microbiote gastrique et le rôle joué par H. pylori dans son façonnage, ainsi que concernant l’impact de l’éradication de H. pylori et des IPP sur le microbiote humain.
H. pylori est la principale bactérie qui façonne la composition du microbiote gastrique
Le microbiote gastrique fait l’objet de plus en plus d’attention, un intérêt croissant étant porté à ses facteurs déterminants. Vilchez-Vargas et al. ont étudié la composition microbienne dans différents compartiments gastro-intestinaux (GI). Lors de cette étude qui a porté sur une cohorte de 108 paires de jumeaux, des biopsies de microbiote gastrique provenant de la muqueuse de l’estomac ont été analysées. La diversité microbienne a été évaluée par amplification et séquençage des régions V1-V2 du gène de l’ARNr 16S. Les résultats ont concordé avec ceux précédemment rapportés, montrant que H. pylori est un facteur clé de la composition du microbiote gastrique 1.
Hua et al. ont conduit une étude sur une cohorte de 193 patients afin d’examiner l’impact de H. pylori sur la richesse et la diversité du microbiote gastrique chez des personnes atteintes de gastrique chronique. Ils ont procédé à un profilage de la région V3-V4 du gène de l’ARNr 16S et ont observé des altérations significatives du microbiote gastrique causées par l’infection à H. pylori. En effet, H. pylori a inhibé les genres dominants du microbiote gastrique, à savoir Aliidiomarina, Reyranella, Halomonas, Pseudomonas et Acidovorax. Leurs résultats ont indiqué que les souches virulentes de H. pylori étaient significativement associées à la gastrite atrophique chronique et qu’elles réduisaient la richesse du microbiote gastrique 2.
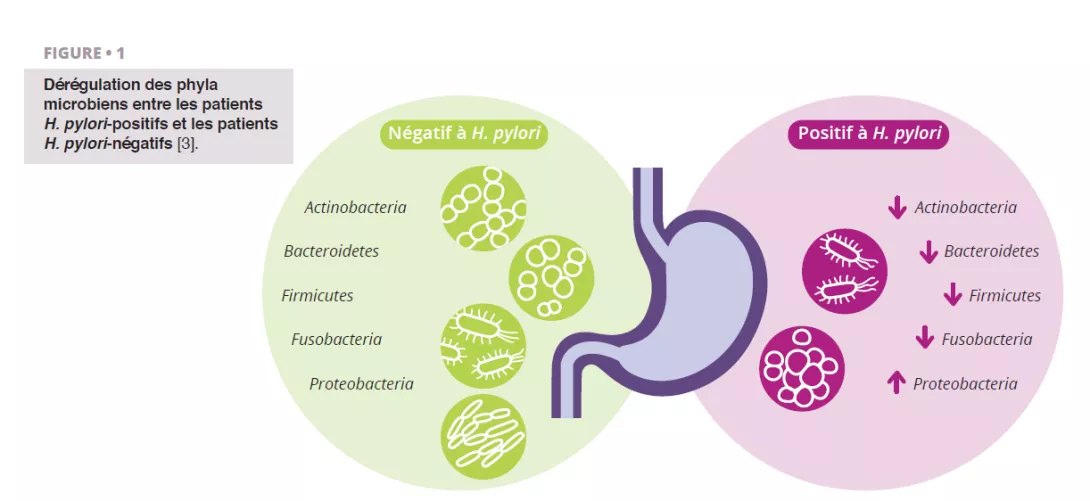
Schulz et al. ont analysé les différences de composition microbienne entre des patients infectés par H. pylori et des patients H. pylori-négatifs. Ils ont observé une différence significative au niveau de l’abondance relative des Proteobacteria, qui étaient davantage présentes dans les aspirations des patients infectés par H.pylori. Les autres phyla ont montré une abondance relative plus faible (figure 1) 3.
Miftahussurur et al. ont étudié la variabilité microbienne gastrique entre des patients H. pylori-positifs et des patients H. pylori- négatifs dans une cohorte de 137 Indonésiens. Ils ont observé que la richesse et la diversité β étaient significativement plus élevées dans les échantillons H. pylori- positifs que dans les échantillons H.pylori-négatifs. En outre, leurs résultats ont suggéré que H. pylori jouerait un rôle de premier plan dans le façonnage de la communauté microbienne gastrique de ce groupe ethnique 4.
Ces études montrent collectivement que H. pylori est un facteur crucial qui influence la diversité et la richesse du microbiote gastrique dans l’environnement hostile de l’estomac.
Qu’est-ce que le véritable microbiote gastrique ?
L’estomac possèdes des conditions extrêmes pour les micro-organismes vivants. Il y a quelques décennies, on a observé que la bactérie H. pylori était capable de supporter ces conditions hostiles. Cette découverte a éveillé la curiosité et a conduit à mener davantage de recherches sur le microbiote gastrique. On ne sait toujours pas clairement si les bactéries non-Helicobacter de l’estomac représentent des contaminants transitoires ou si elles constituent un microbiote persistant. Spiegelhauer et al. ont mené une étude portant sur 22 patients atteints de dyspepsie et 12 patients atteints d’adénocarcinome gastrique 5. Ils ont prélevé des biopsies sur la muqueuse de l’estomac et ont analysé la région V3-V4 du gène de l’ARNr 16S, en plus de la mise en culture des micro-organismes. Les auteurs ont émis l’hypothèse selon laquelle H. pylori serait la seule bactérie résidant véritablement dans l’estomac et qu’elle persisterait dans les biopsies lavées. Leurs résultats ont indiqué que la charge bactérienne diminuait dans les biopsies lavées, suggérant une contamination transitoire depuis la cavité buccale. Toutefois, la diversité des micro-organismes n’était pas différente entre les biopsies lavées et non lavées.
On ne sait toujours pas clairement si les micro-organismes non-H. pylori présents dans l’estomac sont des contaminants transitoires ou de véritables résidents.
Il est possible que les micro-organismes vivants contenus dans la salive avalée continuellement survivent dans des conditions acides pendant un certain temps. Une contamination depuis la région oropharyngée supérieure lors de la gastroscopie et du prélèvement des échantillons doit également être envisagée 6. Ces résultats montrent qu’il est nécessaire de poursuivre les investigations afin de déterminer la nature du véritable microbiote gastrique.
Effet de l’éradication de H. pylori sur le microbiote gastrique et intestinal
L’infection à H. pylori est l’une des plus répandues dans le monde, touchant plus de la moitié de la population humaine. La plupart des schémas thérapeutiques visant H. pylori impliquent au moins deux antibiotiques, ce qui peut avoir un impact sur le microbiote gastro-intestinal. Liou et al. ont étudié les modifications à long terme du microbiote intestinal après éradication de H. pylori. Leur essai multicentrique randomisé a inclus 1 620 participants répartis de manière aléatoire dans trois groupes de traitement. Les auteurs ont évalué la diversité bactérienne en analysant des échantillons fécaux recueillis à différentes échéances après l’éradication. Les résultats ont montré que les diversités alpha et bêta avaient diminué dans les deux semaines suivant l’éradication mais étaient revenues à leur niveau initial à la semaine 8 et un an plus tard. Ces résultats ne mettent en évidence qu’une perturbation à court terme du microbiote gastro-intestinal et suggèrent que le traitement d’éradication de H. pylori est globalement sûr à long terme 7.
He et al. ont rapporté des altérations du microbiote gastro-intestinal suite à l’éradication de H. pylori, après analyse du gène de l’ARNr 16S dans des échantillons de muqueuse gastrique et de selles. Ils ont observé que la diversité alpha du microbiote gastrique avait augmenté et que la diversité bêta du microbiote intestinal était significativement modifiée par rapport aux niveaux avant traitement mais ressemblait à celle des témoins sains 24 semaines après l’éradication 8.
Guo et al. ont résumé les données disponibles sur les modifications du microbiote gastrique après l’éradication réussie de H. pylori. Leur revue systématique avec méta-analyse incluait neuf études portant sur 546 patients. Cette méta-analyse est la première à détailler les modifications de la diversité alpha après éradication de H. pylori. Les résultats n’ont pas mis en évidence de différences significatives au niveau de la diversité microbienne entre les différentes options thérapeutiques utilisées, à savoir quadri- ou trithérapie. Les auteurs ont observé une augmentation de la diversité alpha à court terme, qui a persisté au cours du suivi à long terme, avec une déplétion en taxa liés à H. pylori et un enrichissement en bactéries gastriques commensales fréquentes 9. Afin d’évaluer l’effet de l’éradication de H. pylori sur le microbiote intestinal, Yap et al. ont mené une étude sur 17 jeunes adultes. Ils ont séquencé la région V3-V4 du gène de l’ARNr 16S et ont analysé le microbiote intestinal avant et 18 mois après éradication de H. pylori avec un traitement par clarithromycine et métronidazole. Aucune modification significative de la diversité microbienne n’a été observée entre l’évaluation initiale et 18 mois après l’éradication 10.
Les IPP sont des facteurs modulateurs majeurs du microbiote intestinal
La consommation mondiale d’inhibiteurs de la pompe à protons (IPP) est en augmentation et ils font désormais partie des 10 médicaments les plus utilisés dans le monde 11. Ils sont utilisés en traitement de première ligne dans des affections telles que le reflux gastro-oesophagien, l’ulcère gastroduodénal, la dyspepsie et, en association avec des antibiotiques, dans le traitement des infections à H. pylori 12. Les IPP sont souvent utilisés hors des indications basées sur les preuves ou pendant une durée plus longue que celle prescrite, et leur utilisation a été associée à un risque accru d’infections dues notamment à Clostridium difficile, Salmonella spp., Shigella spp., Campylobacter spp. et d’autres agents pathogènes entériques 11.
Imhann et al. ont analysé le microbiote de 211 sujets utilisant des IPP en séquençant la région V4 du gène de l’ARNr 16S. Ils ont observé une diminution significative de la diversité alpha chez les utilisateurs d’IPP et une augmentation de l’abondance de bactéries des genres Enterococcus, Streptococcus, Staphylococcus et Veillonella (figure 2). Les genres Enterococcus et Veillonella ont été reliés à une plus grande sensibilité aux infections à Clostridium difficile 11. Si les IPP sont globalement considérés comme sûrs avec des effets indésirables relativement rares, des données suggèrent qu’ils exerceraient un impact négatif sur le microbiote intestinal.
Zhang et al. ont réalisé une méta-analyse des effets des IPP sur le microbiote intestinal humain, en analysant les données de quatre études avec séquençage d’amplicons du gène de l’ARNr 16S. Leurs résultats ont démontré un impact significatif de l’utilisation des IPP sur la diversité microbienne, une diversité alpha plus faible ayant été observée chez les utilisateurs d’IPP que chez les témoins. Ils ont mis en évidence une diminution des genres Parabacteroides, Veillonella, Bacteroides et Prevotella, ainsi que des familles Ruminococcaceae et Lachnospiraceae (figure 2) 13.
Weitsman et al. ont mené une étude sur 177 sujets utilisateurs d’IPP et témoins non-utilisateurs, appariés selon un rapport de 1/2. Ils ont analysé des échantillons de selles et, pour la première fois, des microbiotes duodénaux. Aucune différence significative de diversité alpha ou bêta n’a été retrouvée entre les utilisateurs d’IPP et les témoins. Cependant, au niveau des familles, ils ont observé chez les utilisateurs d’IPP une abondance relative plus élevée de Campylobacteraceae (phylum Proteobacteria) et une abondance relative plus faible de Clostridiaceae (phylum Firmicutes). L’analyse des selles a également révélé une réduction de Clostridiaceae et une augmentation de Streptococcaceae 14.
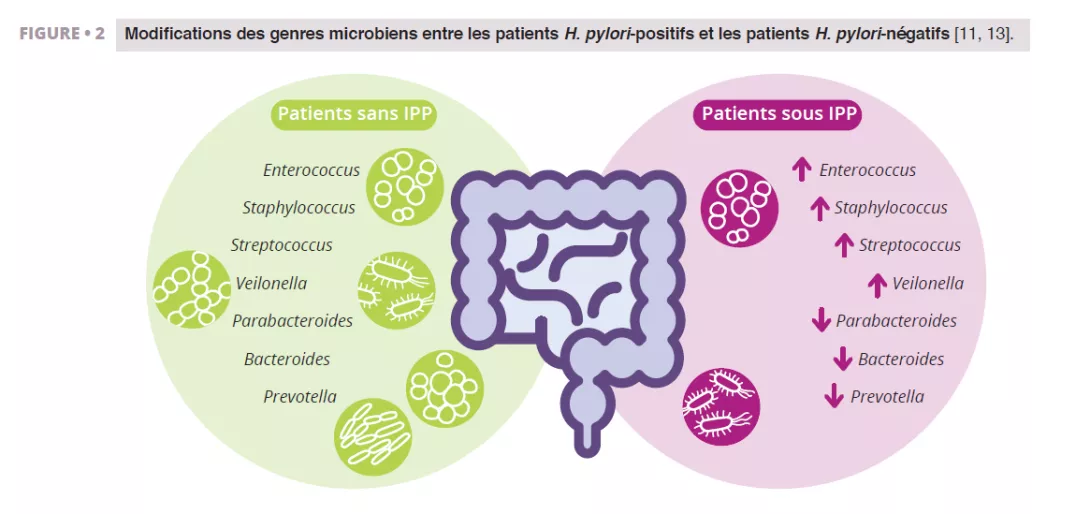
Dans l’ensemble, ces études indiquent que les IPP affectent le microbiote humain. Il conviendra de poursuivre les investigations pour confirmer la pertinence clinique de ces résultats.

Conclusion
L’estomac possèdes des conditions extrêmes pour les microorganismes vivants, et des équipes cherchent toujours à déterminer si le microbiote gastrique est persistant ou s’il s’agit simplement de micro-organismes transitoires. Malgré ses répercussions sur le plan clinique, H. pylori joue un rôle notable dans le façonnage du microbiote de l’estomac. L’éradication de H. pylori semble n’avoir qu’un impact temporaire et réversible sur la composition des microbiotes gastrique et intestinal. Les inhibiteurs de la pompe à protons (IPP) figurent parmi les médicaments les plus consommés. Des études scientifiques indiquent que les IPP altèrent la structure du microbiote intestinal ; toutefois, la pertinence clinique de ces modifications doit faire l’objet d’investigations plus poussées.

