Helicobacter pylori y microbiota gastrointestinal
Por el Pr. Juozas Kupcinskas
Departamento de Gastroenterología e Instituto de Investigación Digestiva, Universidad de Ciencias de la Salud de Lituania, Kaunas, Lituania
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Helicobacter pylori (H. pylori) afecta aproximadamente al 50 % de la población mundial y es la infección bacteriana más común en todo el mundo. Según la Organización Mundial de la Salud (OMS), H. pylori está clasificada como un carcinógeno del grupo 1, que puede causar enfermedades estomacales precancerosas y cancerosas, como el adenocarcinoma gástrico. Anteriormente se creía que H. pylori era el único microorganismo que vivía en el estómago humano, pero avances recientes en tecnologías de investigación han proporcionado una mejor comprensión del microbioma gástrico. H. pylori desempeña una función determinante en la configuración del entorno microbiano del estómago. Sin embargo, el microbioma «no-Helicobacter» del estómago también se ha descrito y es un tema candente en la investigación actual. Está claro que H. pylori es un importante modificador del microbioma gástrico, pero hay otras especies que también pueden contribuir a las vías carcinógenas. También se han estudiado los efectos de los inhibidores de la bomba de protones (IBP) y los tratamientos de erradicación de H. pylori en las alteraciones del microbioma. En este artículo de revisión, nuestro objetivo es resumir los hallazgos recientes sobre el microbioma gástrico y la función de H. pylori en su configuración, así como la repercusión de la erradicación de H. pylori y los IBP en el microbioma humano.
H. pylori es la principal bacteria que conforma la composición del microbioma gástrico
El microbioma gástrico recibe cada vez más atención, con un creciente interés en sus factores determinantes. Vílchez-Vargas et al. han investigado la composición microbiana en varios compartimentos gastrointestinales (GI). Su estudio incluyó una cohorte de 108 pares de gemelos, de los que se analizaron biopsias del microbioma gástrico procedente de la mucosa gástrica. La diversidad del microbioma se evaluó utilizando las regiones V1-V2 del gen 16S del rARN ribosomal mediante amplificación y secuenciación. Los resultados coincidieron con hallazgos anteriores, y señalaron a H. pylori como un factor clave en la composición de la microbiota del estómago 1.
Hua et al. hicieron un estudio con una cohorte de 193 pacientes para examinar el efecto de H. pylori en la riqueza y la diversidad de la microbiota gástrica en pacientes con gastritis crónica. Analizaron la región V3-V4 del gen ARN ribosomal 16S y encontraron alteraciones notables en la microbiota gástrica debido a una infección por H. pylori. En concreto, H. pylori suprimió la microbiota gástrica dominante a nivel de género, incluyendo Aliidiomarina, Reyranella, Halomonas, Pseudomonas y Acidovorax. Sus hallazgos indicaron que las cepas virulentas de H. pylori estaban asociadas significativamente con la gastritis crónica atrófica y la disminución de la riqueza de la microbiota gástrica 2.
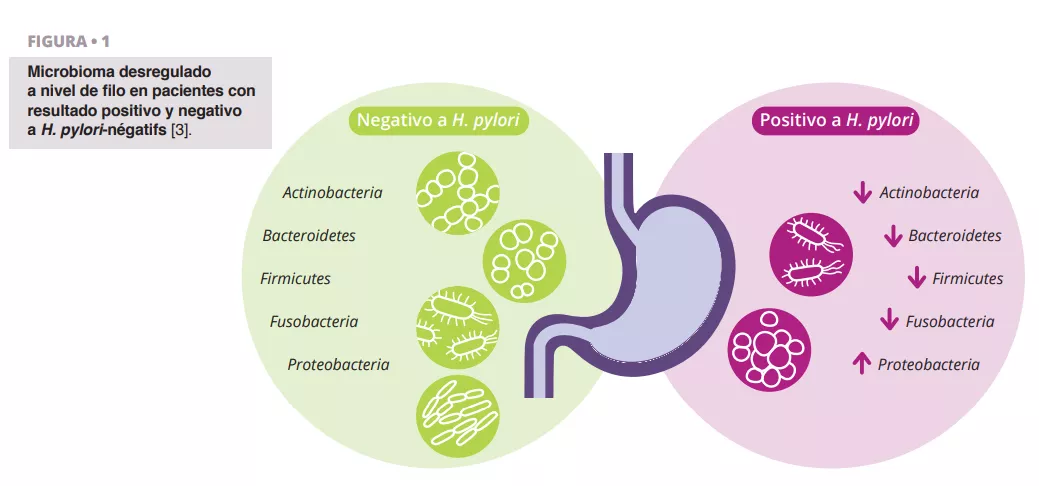
Schulz et al. analizaron las diferencias en composición de la microbiota entre pacientes infectados con H. pylori y pacientes H. pylori negativo. Observaron una diferencia significativa en la abundancia relativa de Proteobacteria, que era más prevalente en los aspirados de los pacientes infectados con H. pylori. De otros filos se observó una menor abundancia relativa (figura 1) 3.
Miftahussurur et al. investigaron la variabilidad de la microbiota gástrica entre pacientes H. pylori positivo y negativo en una cohorte de 137 personas de Indonesia. Descubrieron que la diversidad microbiana β y la riqueza eran significativamente mayores en muestras positivas a H. pylori en comparación con muestras negativas a H. pylori. Además, sus hallazgos sugirieron que H. pylori desempeña una función principal en la conformación de la comunidad microbiana gástrica en este grupo étnico 4.
Estos estudios señalan colectivamente a H. pylori como un factor fundamental que influye en la diversidad y la riqueza del microbioma gástrico en el entorno hostil del estómago.
¿Qué es un auténtico microbioma gástrico?
El estómago presenta condiciones extremas para los microrganismos vivos. Hace unas décadas, H. pylori se identificó como una bacteria que podía soportar estas condiciones hostiles del estómago. Este descubrimiento despertó la curiosidad y dio lugar a nuevas investigaciones sobre el microbioma gástrico. Sigue sin estar claro si las bacterias del estómago otras que Helicobacter son una mera contaminación temporal o forman parte de una microbiota persistente. Spiegelhauer et al. hicieron un estudio que incluyó a 22 pacientes con dispepsia y 12 con adenocarcinoma gástrico 5. Tomaron biopsias de la mucosa del estómago y analizaron la región V3-V4 del gen ARN ribosomal 16S, además de hacer cultivos de microorganismos. Los autores plantearon la hipótesis de que H. pylori es la única bacteria residente verdadera del estómago y que podría persistir en biopsias lavadas. Sus hallazgos indicaron que la carga bacteriana se reducía en las biopsias lavadas, lo que sugería una contaminación temporal desde la cavidad oral. Sin embargo, la diversidad de microrganismos no difirió entre las biopsias lavadas y las biopsias sin lavar.
No está claro si los microrganismos del estómago que no son H. pylori son contaminantes temporales o residentes verdaderos.
Es posible que la saliva, deglutida continuamente y que contiene organismos vivos, pueda sobrevivir en condiciones ácidas durante un tiempo. También se debería tener en cuenta una contaminación de la región orofaríngea superior durante la gastroscopia y el muestreo 6. Estos hallazgos ponen de manifiesto la necesidad de seguir investigando el verdadero microbioma gástrico.
Efecto de la erradicación de H. pylori en el microbioma gástrico e intestinal
H. pylori es una de las infecciones más extendidas en todo el mundo, y afecta a más de la mitad de la población humana. La mayoría de tratamientos frente a H. pylori incluyen dos o más antibióticos, lo que puede afectar al microbioma gastrointestinal. Liou et al. investigaron los cambios a largo plazo en la microbiota intestinal tras la erradicación de H. pylori. Su ensayo aleatorizado multicéntrico incluyó a 1620 participantes que se asignaron aleatoriamente a tres grupos de tratamiento. Los autores evaluaron la diversidad bacteriana en distintos momentos tras la erradicación mediante el análisis de muestras fecales. Los resultados demostraron que tanto la diversidad alfa como la beta habían disminuido en las dos semanas posteriores a la erradicación, pero volvieron a los niveles de referencia en la semana 8 y un año más tarde. Estos hallazgos indican que se produce sólo una perturbación a corto plazo del microbioma gastrointestinal y sugieren que el tratamiento de erradicación de H. pylori generalmente es seguro a largo plazo 7.
He et al. registraron alteraciones en el microbioma intestinal tras la erradicación de H. pylori, usando el análisis del gen ARN ribosomal 16S de muestras fecales y de la mucosa gástrica. Observaron que la diversidad alfa del microbioma gástrico había aumentado, y que la diversidad beta del microbioma intestinal se alejaba significativamente de los niveles previos al tratamiento, pero se parecía a la de pacientes control sanos 24 semanas después de la erradicación 8.
Guo et al. resumieron los hallazgos sobre los cambios en el microbioma gástrico después del tratamiento exitoso de H. pylori. Su revisión sistemática y metaanálisis incluyó a nueve estudios con 546 pacientes. Este metaanálisis es el primero que detalla los cambios en la diversidad alfa tras la erradicación de H. pylori. Los resultados indicaron que no había diferencias significativas en la diversidad de la microbiota entre los distintos tratamientos, ya fueran una terapia cuádruple o triple. Los autores observaron un aumento de la diversidad alfa a corto plazo, que se mantuvo en el seguimiento a largo plazo, con una disminución de los taxones relacionados con H. pylori y un enriquecimiento de los comensales gástricos comunes 9. Para evaluar el efecto de la erradicación de H. pylori en el microbioma intestinal, Yap et al. hicieron un estudio con 17 adultos jóvenes. Secuenciaron la región V3-V4 del gen ARN ribosomal 16S y analizaron el microbioma intestinal antes y 18 meses después de la erradicación de H. pylori utilizando claritromicina y metronidazol. No se observaron cambios significativos en la diversidad microbiana entre el momento inicial y 18 meses después de la erradicación 10.
Los IBP son importantes modificadores del microbioma intestinal
El consumo mundial de inhibidores de la bomba de protones (IBP) está aumentando, lo que los convierte en uno de los 10 medicamentos más utilizados en el mundo 11. Son un tratamiento de primera línea para afecciones como la enfermedad por reflujo gastroesofágico, la enfermedad ulcerosa péptica, la dispepsia y, cuando se combina con antibióticos, para el tratamiento frente a H. pylori 12. Los IBP a menudo se toman sin indicaciones basadas en la evidencia o durante períodos más largos que los prescritos, y su uso se ha asociado a un mayor riesgo de infecciones como Clostridium difficile, Salmonella spp., Shigella spp., Campylobacter spp. y otros patógenos intestinales 11.
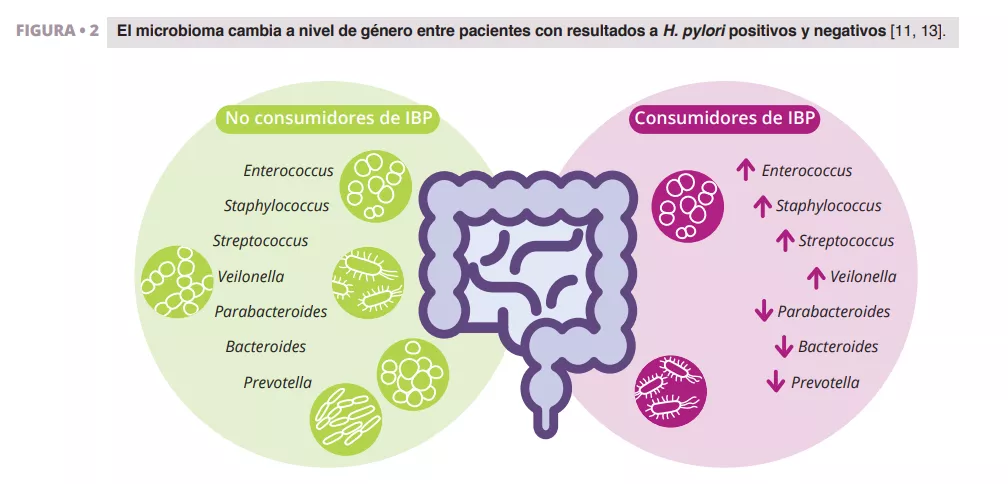
Imhann et al. analizaron el microbioma de 211 personas que consumían IBP mediante la secuenciación de la región V4 del gen 16S del ARN ribosomal. Observaron una importante disminución en la diversidad alfa entre consumidores de IBP y un aumento en la abundancia de bacterias de los géneros Enterococcus, Streptococcus, Staphylococcus, y Veillonella (figura 2). Los géneros Enterococcus y Veillonella se han relacionado con una mayor susceptibilidad a las infecciones de Clostridium difficile 11. Aunque los IBP se consideran generalmente seguros y con relativamente escasos efectos secundarios, la evidencia sugiere que repercuten negativamente en el microbioma intestinal.
Zhang et al. hicieron un metaanálisis sobre los efectos de los IBP en la microbiota intestinal humana, analizando datos de cuatro estudios con secuenciación de amplicones del gen 16S del ARN ribosomal. Sus resultados demostraron un impacto significativo del consumo de IBP en la diversidad microbiana, y se observó una menor diversidad alfa en los consumidores de IBP en comparación con los pacientes control. Observaron disminuciones en los géneros Parabacteroides, Veillonella, Bacteroides y Prevotella, así como en las familias Ruminococcaceae y Lachnospiraceae (figura 2) 13.
Weitsman et al. realizaron un estudio con 177 personas, emparejando consumidores de IBP 1:2 con testigos. Analizaron muestras de heces y, por primera vez, microbiomas duodenales. No se encontraron diferencias significativas en la diversidad alfa o beta entre consumidores de IBP y testigos. Sin embargo, a nivel de familia bacteriana, observaron una mayor abundancia relativa de Campylobacteraceae (tipo Proteobacteria) y una menor abundancia relativa de Clostridiaceae (tipo Firmicutes) en consumidores de IBP. El análisis de las heces reveló asimismo una reducción de Clostridiaceae y un aumento de Streptococcaceae 14.
En general, estos estudios indican que los IBP afectan a la microbiota humana. Se requieren más investigaciones para confirmar la relevancia clínica de estos resultados.

Conclusión
El estómago humano presenta un entorno hostil para los microorganismos vivos, y estudios recientes siguen explorando si la microbiota del estómago es persistente o si simplemente refleja microrganismos temporales. A pesar de su importancia clínica, H. pylori desempeña una función determinante en la conformación del microbioma del estómago. La erradicación de H. pylori parece tener solo un efecto temporal y reversible en la composición del microbioma intestinal y gástrico. Los inhibidores de la bomba de protones (IBP) son algunos de los medicamentos más consumidos. Estudios científicos indican que los IBP alteran la estructura del microbioma intestinal; sin embargo, la importancia clínica de estos cambios requiere más investigación.

