La bactérie Enterococcus faecium B6 cultivée à partir d’enfants obèses favorise les maladies hépatiques stéatosiques par la tyramine comme métabolite bioactif
ARTICLE COMMENTÉ - Rubrique enfant
Par le Pr. Emmanuel Mas
Gastro-entérologie et nutrition, Hôpital des Enfants, Toulouse, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Commentaire de l’article original de Wei et al. (Gut Microbes 2024) [1]
Cet article explore la relation entre le microbiote intestinal et la maladie du foie gras non alcoolique (NAFLD) chez les enfants obèses, dans le contexte de l’augmentation globale de l’obésité infantile et de cette maladie. La méthodologie repose sur une analyse multiomique et des études sur des cohortes d’enfants, associées à des expériences in vitro et in vivo. Les chercheurs ont découvert que Enterococcus faecium B6, isolé chez ces enfants, favorise la NAFLD via la production de tyramine, entraînant une accumulation de lipides, de l’inflammation et de la fibrose hépatique. Ces résultats valident le rôle causal de cette bactérie dans la progression de la NAFLD et ouvrent la voie à des approches thérapeutiques basées sur les microorganismes et/ou leurs métabolites.
Que sait-on déjà à ce sujet ?
En raison de la pandémie d’obésité, les maladies métaboliques de surcharge (NAFLD) sont devenues la principale atteinte hépatique, allant de la stéatose, à la NASH (stéatohépatite non-alcoolique) jusqu’à la cirrhose. Les NAFLD concernent de plus en plus d’enfants.
La physiopathologie des NAFLD est complexe mais le microbiote intestinal jouerait un rôle important. Les effets du microbiote intestinal pourraient être médiés par différents métabolites, notamment la tyramine.
Quels sont les principaux résultats apportés par cette étude ?
Dans une première partie, 156 enfants obèses âgés de 6 à 18 ans ont été inclus, dont 78 avec NAFLD et 78 avec une obésité isolée. Les deux groupes différaient pour les paramètres hépatiques et métaboliques. La diversité alpha microbienne était plus faible dans le groupe NAFLD ; l’abondance d’Enterococcus, Escherichia, Klebsiella, Dialister et Enterobacter était plus importante dans le groupe NAFLD alors que celle de Faecalibacterium, Eubacterium eligens group, Roseburia, Fusicatenibacter, Clostridium, Coprococcus et parasutterella était plus faible. Enterococcus était corrélé aux taux sériques d’ALAT, ASAT, triglycérides et cholestérol total.
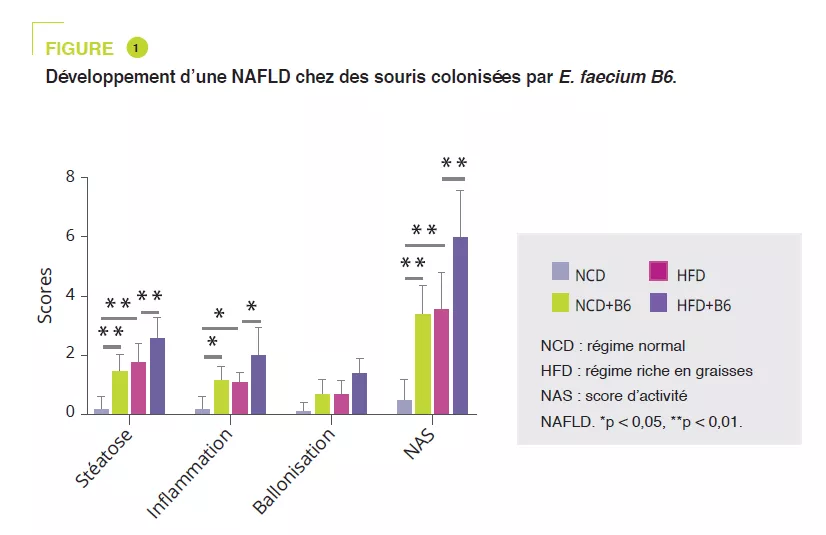
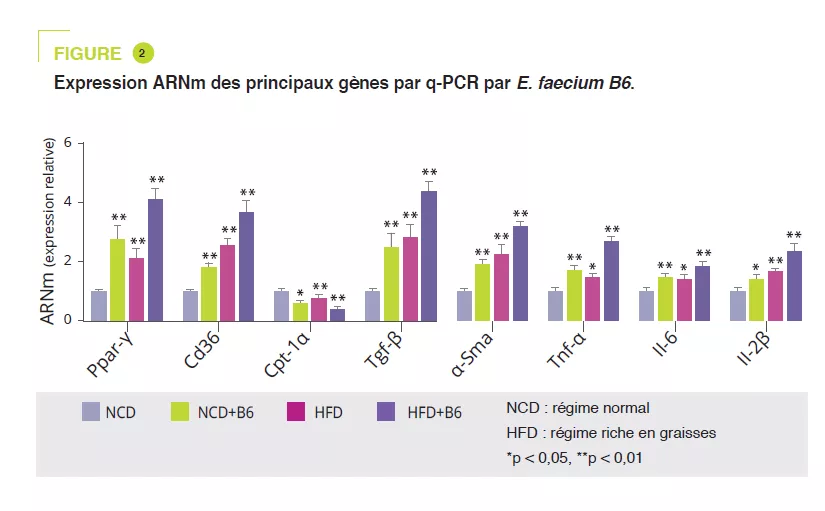
Après isolation de souches bactériennes à partir d’enfants obèses ayant une NAFLD, E. faecium B6 a montré, en culture cellulaire, une capacité à accumuler des lipides. Une étude murine a comparé une alimentation normale (NCD) ou enrichie en graisses (HFD), en présence ou non de B6 pendant 12 semaines. Si E. faecium B6 n’avait pas d’effet sur le poids corporel, il aggravait l’atteinte hépatique de surcharge au niveau biologique et histologique (figure 1). L’analyse transcriptomique a révélé qu’E. faecium B6 modifiait l’expression de gènes impliqués dans le métabolisme lipidique, l’inflammation et la fibrose, comme les voies de signalisation PPAR, de chimiokines, NF-kB, TGF-β, du métabolisme de l’acide linoléique. Concernant le métabolisme lipidique, l’expression ARNm et protéique de PPARg et CD36 étaient augmentées alors que celle de CPT-1α était diminuée. Les auteurs ont montré une expression augmentée de cytokines inflammatoires (TNF-α, IL-6, IL-1β) et de protéines impliquées dans la fibrose (TGF-β et α-SMA) (figure 2).
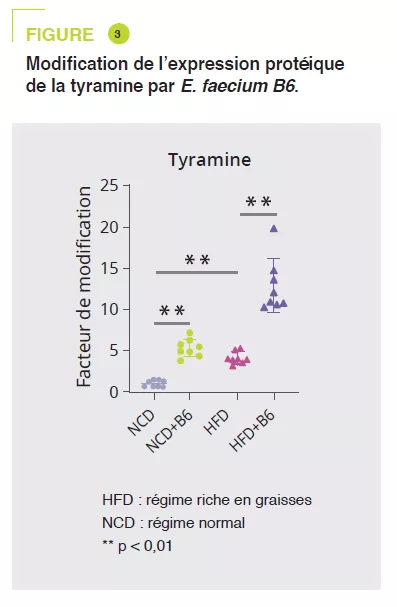
À partir de séra murins, une analyse large non ciblée par spectrométrie de masse en tandem a montré qu’E. faecium B6 augmentait ou diminuait des métabolites, sous régime NCD (30 et 85) ou HFD (18 et 45). La modification la plus marquée était l’augmentation de la tyramine (figure 3). Des analyses complémentaires suggèrent qu’E. faecium B6 a la capacité de produire la tyramine. En outre, le traitement par tyramine de souris so us régime NCD ou HFD reproduit le développement d’une NAFLD, sans effet sur le poids comme E. faecium B6, et modifie de manière similaire l’expression des gènes codant pour PPARγ, CD36, CPT-1α, TNF-a, IL-6, IL-1β, TGF-β et α-SMA.
Enfin, les auteurs ont confirmé ces résultats chez 123 enfants obèses ayant une NAFLD et 123 témoins. Les taux d’E. faecium B6, du gène codant pour la tyramine (mfnA) étaient plus élevés dans le groupe NAFLD. Ces taux étaient corrélés aux marqueurs biologiques de NAFLD (ASAT, ALAT, triglycérides, cholestérol total et LDL) et des cytokines inflammatoires (TNF-α, IL-6, IL-1β).
Quelles sont les conséquences en pratique ?
Cette étude confirme l’importance du microbiote intestinal dans le développement des NAFLD et ouvre des perspectives thérapeutiques. Outre Enterococcus faecium B6 et la tyramine, PPARγ pourrait jouer un rôle central en faisant le lien entre accumulation lipidique, inflammation et fibrose.
- E. faecium B6, bactérie isolée chez des enfants obèses ayant une NAFLD, exacerbe la maladie en produisant un métabolite bioactif, la tyramine
- E. faecium B6 et la tyramine reproduisent de manière similaire une NAFLD chez des souris, sous régime normal et riche en graisses
CONCLUSION
Cette étude a identifié Enterococcus faecium B6 comme souche favorisant le développement de NAFLD chez des enfants obèses. Cette bactérie produit un métabolite bioactif, la tyramine, qui médie ces effets en activant notamment la voie de signalisation PPARg.

