Diarrhée et rôle du microbiote dans la santé intestinale
Par la Dr. Sanda Maria Cretoiu
Département de sciences morphologiques, de biologie cellulaire et moléculaire et d’histologie, université de médecine et de pharmacie « Carol Davila » de Bucarest, Roumanie
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Les troubles intestinaux peuvent se manifester par des symptômes tels que des selles fréquentes et molles, connus sous le nom de diarrhée. Ce signal envoyé par le système digestif peut se produire pour de nombreuses raisons, notamment des infections, des réactions à certains aliments ou médicaments et des maladies préexistantes - résumées dans l’article cité en [1]. Le microbiote intestinal, à savoir l’ensemble des micro-organismes présents dans l’intestin, est essentiel à la préservation de la santé digestive et au fonctionnement de l’intestin. De récentes études illustrent le lien entre le microbiote et les diarrhées de diverses étiologies. Un microbiote équilibré et diversifié est vital pour le maintien de la santé digestive, l’absorption des nutriments et la régulation du système immunitaire. On assiste actuellement à l’introduction à grande échelle de différentes méthodes de reprogrammation de la communauté microbienne intestinale – prébiotiques, probiotiques et postbiotiques ou encore transplantation de matières fécales – afin de prévenir ou de traiter les diarrhées. La recherche sur la modulation du microbiote offrira bientôt des stratégies concrètes pour la prévention et le traitement des diarrhées. La synthèse qui suit couvre les principales maladies diarrhéiques liées à la dysbiose et certains aspects concernant la gestion du microbiote pour améliorer ces troubles gastro-intestinaux.
La relation entre le microbiote et la diarrhée
La diarrhée peut impliquer différents mécanismes (tableau 1), dont la majorité sont liés au rôle du microbiote :
- Protection de l’équilibre microbien. Cet état, appelé « eubiose », est fondamental pour la santé du corps humain parce qu’il prévient et ralentit l’expansion des agents pathogènes. Une perturbation de l’équilibre entre les principales souches microbiennes, appelée « dysbiose », peut augmenter la sensibilité aux infections et contribuer à la survenue d’un épisode de diarrhée. La littérature indique globalement que la diarrhée traduit une dysbiose majeure et que le degré de dysbiose est lié à l’étiologie et au stade de la diarrhée [6]. Après un épisode de diarrhée aiguë, la taxonomie du microbiote change énormément. Aux premiers stades de la diarrhée, les anaérobies facultatifs à croissance rapide tels que les Proteobacteria (essentiellement Enterobacteriaceae/ Escherichia coli) et les Streptococcus (principalement Streptococcus salivarius et Streptococcus gallolyticus) dominent et favorisent la disparition drastique des bactéries intestinales commensales anaérobies strictes (Blautia, Prevotella, Faecalibacterium, Lachnospiraceae, Ruminococcaceae, etc.) [2, 3]. La conséquence est que la quantité d’acides gras à chaîne courte (AGCC) diminue également et l’intégrité de la barrière intestinale commence à être menacée, faisant peser un risque de perméabilité intestinale. Au cours de la phase de guérison qui suit la diarrhée, un modèle proposé montre qu’en milieu de phase, on observe une abondance de Bacteroides (le 7e jour suivant l’apparition de la maladie). En revanche, en fin de phase, ce sont les Prevotella et les Firmicutes productrices d’AGCC qui dominent [4, 5]
- Protection contre les envahisseurs pathogènes. La communauté microbienne du microbiote intestinal est en compétition pour les ressources disponibles, produit des substances antimicrobiennes et agit comme une barrière contre les entéropathogènes. Les bactéries bénéfiques de l’intestin, telles que certaines souches de Bifidobacteria et Lactobacilli, ont montré des effets positifs sur la diarrhée infectieuse causée par les rotavirus chez le jeune enfant. Cette observation n’a cependant été démontrée dans aucun essai clinique [6].
- Régulation du système immunitaire. Le microbiote intestinal aide à éduquer et à moduler les réponses immunitaires, favorisant la tolérance aux substances inoffensives et assurant une défense contre les agents pathogènes. Un dérèglement de la réponse immunitaire dû à des déséquilibres du microbiote peut contribuer à la survenue d’une inflammation et d’une diarrhée. Après l’utilisation d’antibiotiques tels que la vancomycine pour une diarrhée induite par Clostridioides difficile, on observe une réduction de l’abondance relative des Bacteroidetes et Firmicutes parallèlement à une augmentation des Proteobacteria et Fusobacteria, conduisant à une diminution de l’AGCC propionate et créant les conditions de l’inflammation [7].
- Maintien de la fonction intestinale et du métabolisme. Les bactéries bénéfiques assurent la fermentation des fibres alimentaires pour produire des acides gras à chaîne courte (AGCC) tels qu’acétate, propionate et butyrate. Les AGCC contribuent à maintenir une muqueuse intestinale saine, favorisent l’absorption de l’eau et fournissent une source d’énergie pour les colonocytes. Les déséquilibres entre les souches bactériennes peuvent affecter ces fonctions, entraînant une diarrhée fonctionnelle par diminution de la production d’AGCC. L’augmentation de cette production permet d’améliorer l’absorption des liquides au niveau du côlon [8].
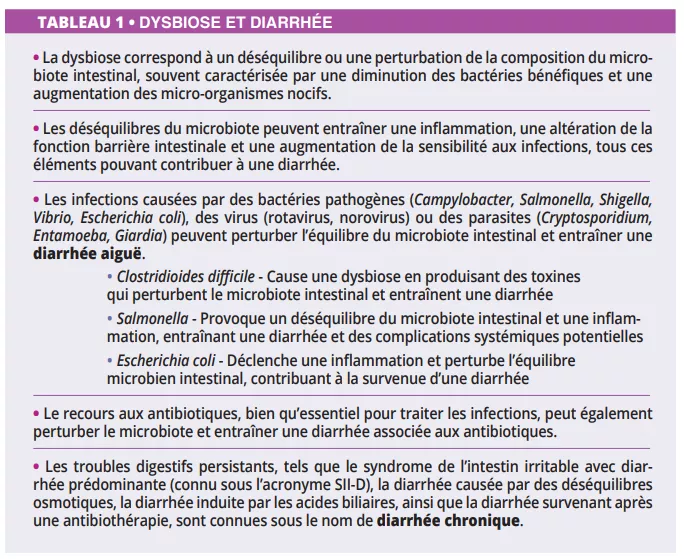
Principales causes de diarrhée en lien avec une dysbiose intestinale : altération du microbiote, infections pathogènes, traitements antibiotiques et troubles digestifs chroniques. Ce tableau met en évidence le rôle central du microbiote dans la prévention et le déclenchement de la diarrhée aiguë ou chronique.
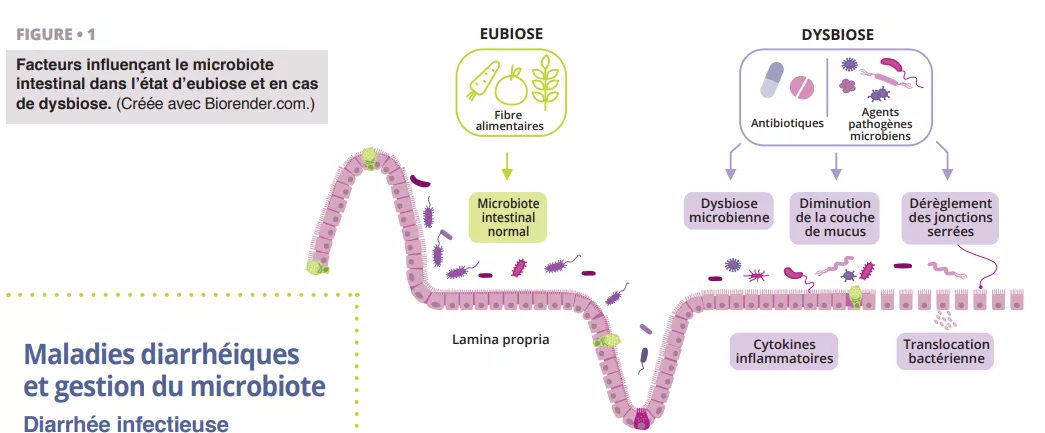
Facteurs impactant l’équilibre du microbiote intestinal : en état d’eubiose, les fibres alimentaires soutiennent un microbiote sain et une barrière intestinale fonctionnelle. En cas de dysbiose, les antibiotiques et agents pathogènes altèrent le mucus, les jonctions serrées et favorisent l’inflammation et la translocation bactérienne, pouvant conduire à des troubles digestifs comme la diarrhée.
Maladies diarrhéiques et gestion du microbiote
Diarrhée infectieuse
Les infections intestinales d’origine bactérienne, virale ou parasitaire provoquent une diarrhée aiguë et se transmettent souvent par de l’eau contaminée. Dans la plupart des cas, la diarrhée s’améliore en quelques jours, mais les formes sévères peuvent entraîner une déshydratation grave et devenir fatales [9].
Le rotavirus reste la première cause de mortalité associée à la diarrhée chez l’enfant [11], et la prise en charge de cette maladie virale repose généralement sur une hydratation orale ou intraveineuse, adaptée à la sévérité de la déshydratation [12]. Par ailleurs, sur la base des dernières conclusions de l’ESPGHAN (2023) [13], les professionnels de santé pourraient proposer certaines souches probiotiques en cas d’épisodes gastro-entériques aigus chez l’enfant, en reconnaissant leur potentiel (degré de certitude des preuves : faible ; grade de recommandation : faible) pour diminuer la durée de la diarrhée, et/ ou le séjour à l’hôpital, et/ou le volume des selles éliminées.. Néanmoins, un essai contrôlé et randomisé en double aveugle conduit chez des enfants boliviens atteints de diarrhée aiguë à rotavirus a démontré une diminution de la durée de la diarrhée avec l’utilisation d’une solution de réhydratation orale plus un mélange de probiotiques versus une solution de réhydratation simple [11].
Diarrhée du voyageur
Plus de 60 % des adultes des pays développés qui se rendent dans des pays en développement connaissent une diarrhée aiguë, également connue sous le nom de diarrhée du voyageur (DV). Les agents pathogènes les plus fréquemment identifiés dans les épisodes de diarrhée du voyageur sont Escherichia coli, Campylobacter jejuni, et les espèces des genres Salmonella et Shigella. Ainsi, les stratégies thérapeutiques recommandées reposent sur une antibiothérapie par azithromycine ou fluoroquinolones pour les cas modérés à sévères [14]. Cependant, les antibiotiques ne sont pas recommandés pour prévenir la DV en raison de preuves insuffisantes de leur efficacité prophylactique et en partie du fait du risque d’antibiorésistance [15].
Il existe des données contradictoires concernant l’efficacité des probiotiques dans la prévention de la diarrhée du voyageur [16]. Une revue systématique avec méta-analyse a comparé l’efficacité de la rifaximine et des probiotiques dans la prévention de la DV. [14].
Diarrhée associée aux antibiotiques
Les antibiotiques figurent parmi les médicaments les plus prescrits et représentent un traitement efficace pour différentes pathologies infectieuses [17]. L’une des complications associées à l’antibiothérapie est la diarrhée associée aux antibiotiques (DAA), qui survient chez 5 %-35 % des patients suivant ce type de traitement [18]. La DAA peut être définie par au moins trois selles liquides ou molles par jour pendant au moins deux jours consécutifs, strictement en lien avec l’administration d’antibiotiques et sans aucune autre cause [14]. Le risque plus élevé est attribué aux aminopénicillines, aux céphalosporines et à la clindamycine, qui ciblent principalement les anaérobies [19].
L’absence d’agent infectieux identifié dans la DAA peut s’expliquer par l’effet toxique direct des antibiotiques sur la muqueuse intestinale, pouvant causer une diarrhée. En raison de leurs propriétés bénéfiques, les probiotiques sont actuellement étudiés et utilisés dans le traitement et la prophylaxie de la DAA [16, 18].
Diarrhée associée à Clostridioides difficile
Les infections à Clostridioides difficile (CD) sont la cause la plus fréquente de diarrhée nosocomiale associée aux antibiotiques chez l’adulte. Les facteurs de risque sont un âge supérieur à 65 ans, un long séjour en soins intensifs et l’administration d’antibiotiques (fluoroquinolones, clindamycine, céphalosporines et bêta-lactamines en particulier) ou d’inhibiteurs de la pompe à protons.
Au cours d’une antibiothérapie, les anaérobies qui produisent des AGCC peuvent disparaître en raison des altérations induites par les antibiotiques au niveau du microbiote intestinal, qui peuvent également perturber le métabolisme des glucides et de la bile et causer un déséquilibre osmotique. Après la prise d’antibiotiques, les trois barrières intestinales sont touchées : les cellules intestinales épithéliales, la couche de mucus et de peptides antimicrobiens et la couche immunoprotectrice composée de différentes cellules immunitaires et biomolécules (figure 1). Cet événement peut interférer avec la production de mucine, de cytokines et de peptides antimicrobiens, déréglant la fonction intestinale et entraînant d’autres infections voire causant des épisodes d’infections à répétition. L’American Gastroenterological Association recommande sous condition des probiotiques spécifiques pour prévenir les infections à CD chez les personnes sous antibiotiques, en notant que la qualité des preuves est faible [20].
Nouvelles découvertes et avenir de la prise en charge de la diarrhée
Les récentes avancées réalisées dans la recherche sur le microbiote, notamment dans l’analyse métagénomique et la transplantation microbienne, révolutionnent notre approche du traitement de la diarrhée (figure 2).
Les options thérapeutiques dans la diarrhée doivent prendre en compte les mécanismes impliqués dans la genèse de la maladie, notamment les toxines infectieuses capables de perturber l’équilibre
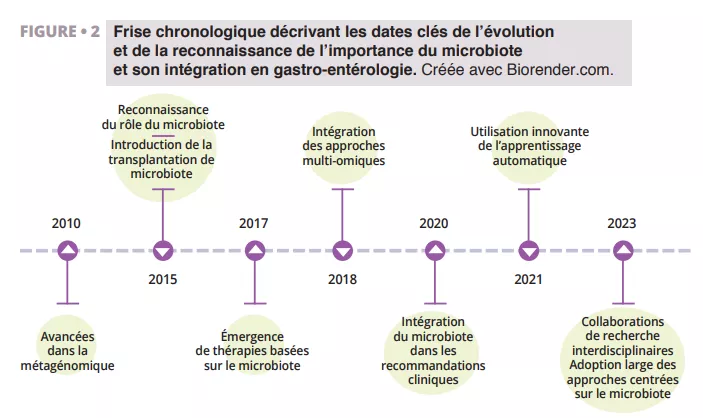
Évolution des connaissances et de l’intégration du microbiote intestinal en gastro-entérologie de 2010 à 2023 : de la métagénomique à l’intelligence artificielle, en passant par la transplantation fécale, les approches multi-omiques et les recommandations cliniques. Cette frise retrace les grandes avancées scientifiques et thérapeutiques autour du microbiote.
Il existe des données limitées concernant l’utilisation des prébiotiques et des fibres dans le traitement de la diarrhée (tableau 2). Apparemment, les prébiotiques sont davantage susceptibles de prévenir et de traiter la réapparition des diarrhées. Dans le même temps, les fibres, essentiellement les fibres visqueuses, sont davantage indiquées lors des épisodes aigus en raison de leur capacité à retenir l’eau. D’autres options thérapeutiques impliquent, dans certains cas, l’administration de probiotiques (tableau 3) et, dans les cas sévères, l’utilisation de la transplantation de microbiote fécal (TMF).
Les origines de l’histoire fascinante de la découverte de la TMF remontent à l’époque de la Chine ancienne, lorsque Ge Hong traitait les patients atteints de diarrhée sévère avec une « soupe jaune », constituée d’une suspension fécale. Plus tard, en 1958, le Dr Ben Eiseman a utilisé des lavements provenant de personnes saines pour traiter l’entérocolite pseudomembraneuse. Aujourd’hui, la TMF suscite un intérêt croissant dans le traitement des infections à Clostridioides difficile (ICD) récidivantes, ce qui montre son utilité [22]. Des recherches sont en cours pour évaluer son efficacité dans les maladies inflammatoires chroniques de l’intestin, le diabète, le cancer, la cirrhose hépatique et les atteintes cérébrales telles que la maladie de Parkinson [23]. L’utilisation de la TMF chez les patients souffrant de diarrhées repose sur l’idée que la flore microbienne saine introduite par cette méthode a la capacité de repousser les agents pathogènes et de restaurer la composition d’un microbiote intestinal sain (figure 3).

Définitions des fibres alimentaires et des prébiotiques, et leur rôle dans la gestion de la diarrhée. Les fibres sont des polymères glucidiques non digestibles, et les prébiotiques favorisent la croissance des bactéries bénéfiques du microbiote. Une alimentation riche en prébiotiques (fruits, légumes, céréales complètes) soutient la santé intestinale.

Effets des probiotiques sur la diarrhée et le microbiote intestinal : en soutenant la restauration de l’équilibre microbien, certains probiotiques comme Lactobacillus rhamnosus GG et Saccharomyces boulardii peuvent réduire la fréquence des diarrhées infectieuses ou induites par les antibiotiques. Des recommandations pédiatriques sont émises par l’ESPGHAN.
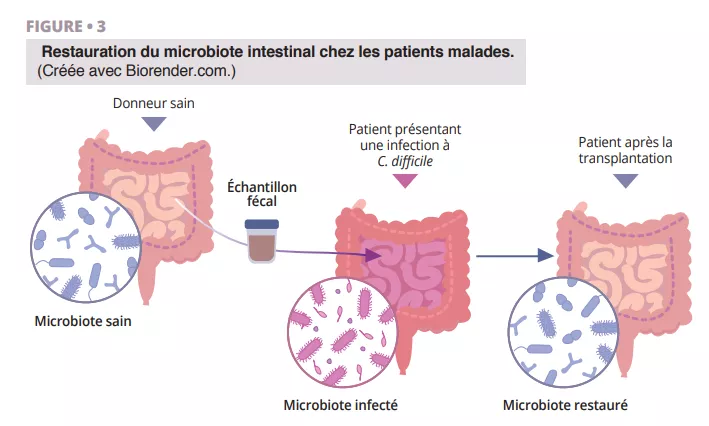
Processus de restauration du microbiote intestinal par transplantation fécale : un échantillon de microbiote sain provenant d’un donneur est administré à un patient souffrant d’une infection à C. difficile, permettant de rétablir la diversité microbienne et de restaurer la santé intestinale.
Conclusion
Les recherches montrent que la réduction de la diversité du microbiote intestinal est associée à une sensibilité accrue aux diarrhées, ouvrant la voie à des interventions diagnostiques et thérapeutiques potentielles. Le maintien d’un microbiote intestinal équilibré et diversifié prévient les diarrhées et favorise la santé digestive. Les déséquilibres du microbiote, connus sous le nom de « dysbiose », peuvent résulter d’une diarrhée infectieuse aiguë ou d’autres facteurs (utilisation fréquente d’antibiotiques, alimentation déséquilibrée, malabsorption) pouvant contribuer à une diarrhée chronique. La compréhension des interactions complexes entre la composition microbienne et les symptômes cliniques est cruciale pour une prise en charge personnalisée de la diarrhée. Des approches adaptées basées sur les profils microbiens spécifiques peuvent permettre de mettre au point des stratégies ou des interventions plus efficaces. L’introduction des probiotiques et d’une alimentation riche en prébiotiques, la transplantation de microbiote, l’intégration des approches multi-omiques, l’utilisation innovante de l’apprentissage automatique et le développement des collaborations de recherche interdisciplinaires pourraient aider à restaurer l’équilibre microbien et améliorer le bien-être gastro-intestinal. Peut-être sera-t-il possible à l’avenir de concevoir des thérapies basées sur le microbiote, comme l’a suggéré Peter J. Turnbaugh, jetant les bases de nouveaux principes thérapeutiques [25].
1. Iancu MA, Profir M, Roşu OA, et al. Revisiting the Intestinal Microbiome and Its Role in Diarrhea and Constipation. Microorganisms 2023; 11: 2177.
2. David L, Weil A, Ryan ET, et al. Gut microbial succession follows acute secretory diarrhea in humans. mBio 2015; 6: 1-14.
3. Sohail MU, Al Khatib HA, Al Thani AA, et al. Microbiome profiling of rotavirus infected children suffering from acute gastroenteritis. Gut Pathog 2021; 13: 21.
4. Becker-Dreps S, Allali I, Monteagudo A, et al. Gut Microbiome Composition in Young Nicaraguan Children During Diarrhea Episodes and Recovery. Am J Trop Med Hyg 2015; 93: 1187-93.
5. Cannon JL, Seabolt MH, Xu R, et al. Gut Microbiome Changes Occurring with Norovirus Infection and Recovery in Infants Enrolled in a Longitudinal Birth Cohort in Leon, Nicaragua. Viruses 2022; 14: 1395.
6. Azagra-Boronat I, Massot-Cladera M, Knipping K, et al. Strain-Specific Probiotic Properties of Bifidobacteria and Lactobacilli for the Prevention of Diarrhea Caused by Rotavirus in a Preclinical Model. Nutrients 2020; 12: 498.
7. Kim AH, Lee Y, Kim E, et al. Assessment of oral vancomycin-induced alterations in gut bacterial microbiota and metabolome of healthy men. Front Cell Infect Microbiol 2021; 11: 629438.
8. Binder HJ. Role of colonic short-chain fatty acid transport in diarrhea. Annu Rev Physiol 2010; 72: 297-313.
9. Collinson S, Deans A, Padua-Zamora A, et al. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev 2020; 12:CD003048.
10. Desselberger U. Viral gastroenteritis. Medicine 2017; 45: 690-4.
11. GBD 2016 Diarrheal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis 2018; 18: 1211-8.
12. Iturriza-Gómara M, Cunliffe NA. 34 - Viral Gastroenteritis. Ryan ET, Hill DR, Solomon T, Aronson NE, Endy TP. (eds) Hunter’s Tropical Medicine and Emerging Infectious Diseases (tenth edition). Elsevier, 2020, pp. 289-307.
13. Szajewska H, Berni Canani R, Domellöf M et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr 2023; 76: 232-47.
14. Kopacz K, Phadtare S. Probiotics for the Prevention of antibiotic-associated diarrhea. Healthcare 2022; 10: 1450.
15. Fan H, Gao L, Yin Z, et al. Probiotics and rifaximin for the prevention of travelers’ diarrhea: A systematic review and network meta-analysis. Medicine 2022; 101: e30921.
16. Girardin M, Seidman EG. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 2011; 29: 574-87.
17. Goodman C, Keating G, Georgousopoulou E, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ Open 2021; 11: e043054.
18. McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3: 563-78.
19. Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ 2002; 324: 1345-6.
20. Su GL, Ko CW, Bercik P, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology 2020; 159: 697-705.
21. Codex AC. Report of the 31th session of the codex committee on nutrition and foods for special dietary uses. Rome, Italy: FAO/WHO 2009.
22. Peery AF, Kelly CR, Kao D, et al.; AGA Clinical Guidelines Committee. AGA Clinical Practice Guideline on Fecal Microbiota-Based Therapies for Select Gastrointestinal Diseases. Gastroenterology 2024; 166: 409-34.
23. Tariq R, Disbrow MB, Dibaise JK, etal. Efficacy of Fecal Microbiota Transplantation for Recurrent C. Difficile Infection in Inflammatory Bowel Disease. Inflamm Bowel Dis 2020; 26: 1415-20.
24. Guarino A, Ashkenazi S, Gendrel D, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: update 2014. J Pediatr Gastroenterol Nutr 2014; 59: 132-52.
25. Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol 2023; 21: e3002087.


