Analyse longitudinale du microbiome intestinal d’adolescents ayant une anorexie mentale : facteurs liés au microbiome associés à l’évolution clinique
ARTICLE COMMENTÉ Rubrique enfant
Par le Pr. Emmanuel Mas
Gastro-entérologie et nutrition, Hôpital des Enfants, Toulouse, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Commentaire de l’article original de Andreani et al. [1]
Le rôle du microbiote intestinal dans l’anorexie mentale (AN) se confirme un peu plus au fil du temps. Des études ont rapporté que les patients souffrant d’anorexie mentale présentent une dysbiose en comparaison aux témoins sains. Cependant, les mécanismes sous-jacents ne sont pas clairs et les données sur les facteurs d’influence et l’évolution longitudinale des changements du microbiome sont rares. Les auteurs présentent, dans cet article, les données longitudinales de 57 adolescents hospitalisés ayant reçu un diagnostic d’anorexie à neuf moments différents (y compris un examen de suivi d’un an) et les comparent à six moments différents chez 34 témoins sains. Leur étude a permis de conclure que la caractérisation des taxons présentant un intérêt pour le pronostic pourrait être utile pour stratifier les patients à l’admission et pour identifier potentiellement des taxons candidats pour de futures études de supplémentation visant à améliorer le traitement de l’anorexie mentale.
Que sait-on déjà à ce sujet ?
L’anorexie mentale (AM) est une pathologie psychiatrique très fréquente à l’adolescence, avec une mortalité élevée. Elle est caractérisée par une dysmorphophobie, une diminution des apports caloriques et une dénutrition. Si la physiopathologie de l’AM est méconnue, le microbiome intestinal (MI) joue un rôle important. En effet, le MI est impliqué dans l’axe intestin-cerveau, dans la dénutrition mais aussi le surpoids, et il est modifié par l’alimentation.
L’objectif de ce travail était d’étudier les modifications du MI au cours du temps chez des patients souffrants d’AM. L’étude s’est déroulée sur un an, pendant l’hospitalisation des patients jusqu’à leur retour à domicile, avec une évaluation des paramètres cliniques associés au MI dans l’AM.
Quels sont les principaux résultats apportés par cette étude ?
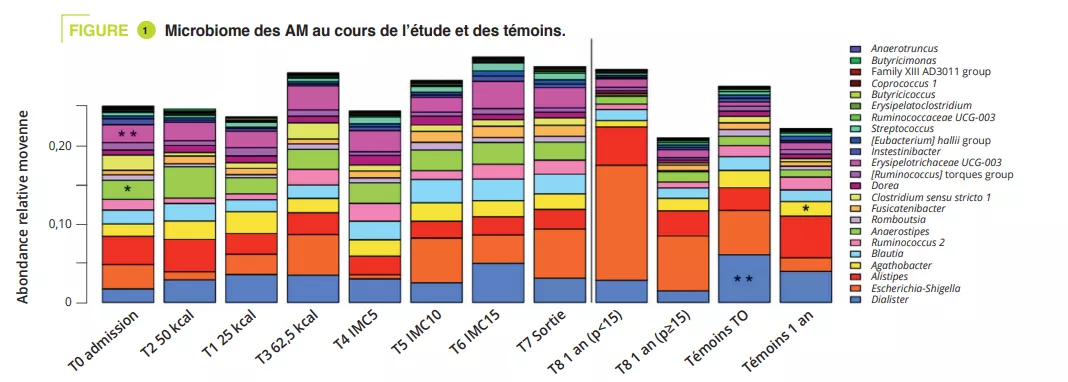
Il s’agit de la première étude longitudinale sur les modifications du microbiote intestinal chez des patients souffrants d’AM, menée sur une période aussi longue (un an). Ont été inclus 56 patients âgés de 12 à 20 ans avec AM et 34 témoins. Des selles ont été recueillies de l’admission à la sortie (T0-T7) puis un an après l’admission (T8). Huit patients ont été réhospitalisés au cours de l’étude ; les patients ont été séparés entre ceux qui étaient rétablis (IMC ≥ 15e p) et ceux qui avaient toujours un poids diminué (IMC < 15e p).
La composition du MI était significativement différente à l’admission lors de la phase aiguë de dénutrition, sans différence en termes d’alpha-diversité (figure 1). Des différences du MI des patients AM vs témoins, même minimes, persistaient tout au long de l’étude. Chez les adolescents ayant un IMC < 15e p à un an, l’alpha-diversité (index Chao1) était diminuée significativement pendant l’hospitalisation par rapport à l’admission, la sortie et le suivi à un an. Il existait une tendance similaire chez les AM ayant récupéré un IMC ≥ 15 par rapport aux témoins. À l’admission, l’analyse PERMANOVA montre une diminution significative des genres Legionella, Dialister, Ruminococcaceae UCG-003 et Limnobacter en comparaison aux témoins. Au cours du traitement en hospitalisation, les différences ont été réduites entre AM et témoins, ne persistant qu’au niveau des variants de séquences amplifiées (ASVs). À un an, il existe des différences significatives entre les AM ayant un IMC < 15e p et les témoins au niveau des phyla, classes et ordres (p = 0,001 à < 0,001), alors qu’elles sont plus faibles entre AM ayant IMC ≥ 15e p et témoins (p = 0,063 au niveau ASVs) (figure 2).
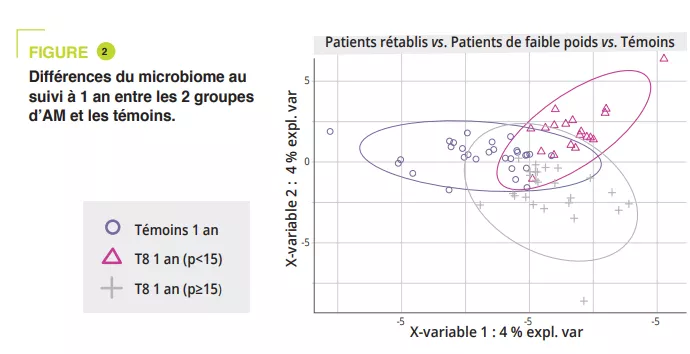
Entre l’admission et le suivi à un an, les AM ayant un IMC < 15e p ont une réduction significative de l’abondance relative des genres Anaerostipes, Clostridium sensu stricto 1 et Romboustia (p = 0,02) alors que de manière surprenante, le MI des AM ayant récupéré un IMC ≥ 15e p était plus similaire au cours du suivi. Il en était de même pour l’évolution du MI entre la sortie d’hospitalisation et le suivi à un an : abondance quatre fois supérieure du genre Escherichia-Shigella (p = 0,04) et deux fois supérieure d’Alistipes (p = 0,03) chez les AM ayant un IMC < 15e p.
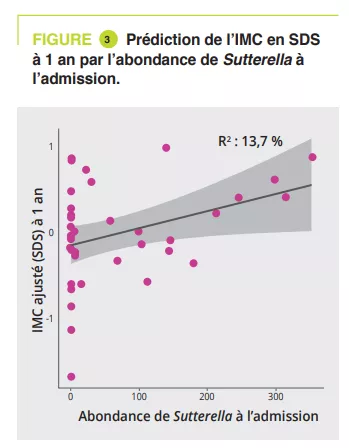
L’analyse du MI à l’admission a montré une association significative avec la durée de la maladie (niveau phylum à famille, p = 0,011 à 0,022) et de la quantité de perte de poids (niveau classe à genre, p = 0,030 à 0,047). L’analyse longitudinale PERMANOVA, avec correction pour l’utilisation de laxatifs, a montré une association significative entre le MI et la quantité de calories ingérées (p = 0,003, R2 = 0,009), l’IMC en SDS (p = 0,006, R2 = 0,008) et la leptine dosée à l’admission, à la sortie et à un an (p = 0,02, R2 = 0,02). Les genres Ruminiclostridium 5 (p = 0,006) et Intestinibacter (p = 0,03) étaient associés au risque de réhospitalisation. Un modèle d’analyse linéaire, corrigé pour l’utilisation de laxatifs, la durée de la maladie, la perte de poids et l’IMC en SDS à l’admission, a montré que 4 genres à l’admission étaient associés à l’IMC en SDS à 1 an de suivi : Sutterella, Parasutturella, Lachnospiraceae FCS020 group et Clostridium stricto sensu (p = 0,008 à 0,04) (figure 3).
Quelles sont les conséquences en pratique ?
Il existe une dysbiose en phase aiguë d’AM qui est améliorée en partie par la prise en charge. La composition du MI à l’admission peut aider à prédire le risque de rechute au cours de la première année et l’amélioration de l’IMC à un an. Ainsi, l’analyse du MI à l’admission pourrait identifier les genres et taxas Parasutturella, Lachnospiraceae FCS020 group, Clostridium stricto sensu et uncultured Alistipes comme étant des facteurs de mauvais pronostic. Une abondance plus élevée de Sutterella étant un indicateur d’évolution favorable, ce pourrait être une cible comme probiotique.
- L’analyse du MI est intéressante chez des adolescents ayant une AM
- Certains microbes seraient des facteurs de risque d’évolution défavorable alors que Sutterella pourrait être bénéfique et une cible en tant que probiotique
CONCLUSION
Cette étude a montré que la composition du MI est associée à la durée de l’AM et la perte de poids à l’admission, mais aussi que l’évolution du MI au cours de la prise en charge est influencée par les calories ingérées, la prise de poids et la leptine.

