Microbiota intestinal y Clostridioides difficile
Síntesis
Por el Pr. Gianluca Ianiro
Centro de Enfermedades Digestivas, Fondazione Policlinico “A. Gemelli” IRCCS, Roma, Italia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
En los últimos años, la infección por C. difficile (ICD) se ha convertido en una carga clínica y socioeconómica en todo el mundo, debido al aumento de su morbilidad, gravedad, mortalidad y del riesgo de reaparición. La microbiota intestinal tiene una implicación considerable en la ICD por varios motivos. En primer lugar, la mayoría de factores de riesgo asociados con el desarrollo de una ICD, especialmente el uso excesivo de antibióticos de amplio espectro, o de inhibidores de la bomba de protones, se relacionan con un desequilibrio de la microbiota intestinal. Es más, varios moduladores específicos de la microbiota influyen en la prevención (probióticos específicos) o tratamiento (trasplante de la microbiota fecal) de la ICD. En este artículo, revisaremos la epidemiología, los factores de riesgo y los tratamientos aprobados frente a la ICD, desde una perspectiva centrada en la microbiota.
Clostridioides difficile (C. difficile, antiguamente Clostridium difficile) es una bacteria anaerobia estricta, grampositiva y formadora de esporas. Las esporas permiten a C. difficile resistir en el entorno y propagarse desde personas infectadas. Ciertas circunstancias específicas (como la disbiosis causada por antibióticos) favorecen la germinación de las esporas en el intestino grueso, donde toman una forma vegetativa que conduce a una infección clínica (infección por Clostridium difficile [ICD]). En la fase de infección, C. difficile produce dos toxinas, la enterotoxina A y la citotoxina B, que dañan a los colonocitos y desencadenan la respuesta inflamatoria, desembocando en una variedad de cuadros clínicos, desde una colitis de intensidad leve a una colitis pseudomembranosa o un megacolon tóxico [1].
En los últimos años, la ICD se ha convertido en una carga sanitaria y económica considerable en la mayoría de países. Unos estudios realizados en Estados Unidos declaran una incidencia de casi 453 000 casos y de casi 29 000 fallecimientos relacionados por ICD en 2011, mientras que la incidencia en Europa es de 124 000 casos/año, con alrededor de 3 700 muertes/año. El aumento de la morbilidad, de la duración de la hospitalización y de la mortalidad, contribuye al considerable coste económico de la ICD, que representó casi 5000 millones de dólares en EE. UU. y unos 3700 millones en Europa en 2013 [2, 3]. Estas cifras demuestran que la incidencia de ICD ha crecido en todo el mundo, por varios motivos. En primer lugar, el consumo mayor de antibióticos, que son un conocido factor de riesgo en la aparición de la ICD. Es más, la propagación de ribotipos específicos (principalmente el ribotipo virulento 027, pero también el 017 en Asia, el 018 en Italia, el 17 621 en los países de Europa del Este y el 24 422 en Oceanía) ha permitido la aparición de casos agrupados de ICD. Además, se ha producido un aumento en el número de diagnósticos, debido al desarrollo de pruebas diagnósticas ultrasensibles (como la PCR), y a una mayor sensibilización entre los profesionales sanitarios. En términos generales, la principal causa del aumento global en la incidencia de ICD parece ser una mayor tasa de recidivas. Entre 2001 y 2012, la incidencia anual de recidivas de ICD aumentó casi un 189 %, mientras que el incremento en la incidencia global de ICD en el mismo periodo de tiempo fue casi del 43 % [2]. Dado que es menos probable curar una infección recurrente con antibióticos que un primer episodio, también se asocia a un aumento de la duración de hospitalización, de la morbilidad y de la mortalidad.
La ICD es la principal causa de diarrea infecciosa asociada a los cuidados, pero datos recientes sugieren que su difusión en ámbitos extrahospitalarios es cada vez mayor. Hasta la fecha, un 25-35 % de los casos de ICD se producen en el ámbito extrahospitalario, probablemente a través de diversas vías de transmisión fecal-oral (por ejemplo, zoonosis y comida).
A pesar del mayor número de diagnósticos de ICD, aún hay muchos diagnósticos incorrectos/infradiagnósticos, como se observó en el estudio EUCLID.
Este hallazgo sugiere que hay un número considerable de pacientes con ICD aún sin diagnosticar, con lo que aumenta el riesgo de difusión de la enfermedad.
Las ICD hospitalarias y extrahospitalarias parecen diferenciarse por varias características. En primer lugar, es más probable que los pacientes hospitalarios presenten un cuadro clínico grave, mientras que los pacientes extrahospitalarios pueden ser incluso portadores asintomáticos, lo que aumenta el riesgo de propagación de ICD. Además, se sabe que la ICD extrahospitalaria se propaga entre pacientes sin factores estándar de riesgo.
Factores de riesgo de una infection por C. difficile
Aunque aún no se han dilucidado los mecanismos patógenos exactos de las ICD, con el tiempo se han identificado varios factores de riesgo [4]. Conocerlos es importante, ya que el control de los factores de riesgo modificables es una medida de prevención contra las ICD. Los factores de riesgo más relevantes son la edad, el consumo de antibióticos o los inhibidores de la bomba de protones, entre otros (Figura 1).
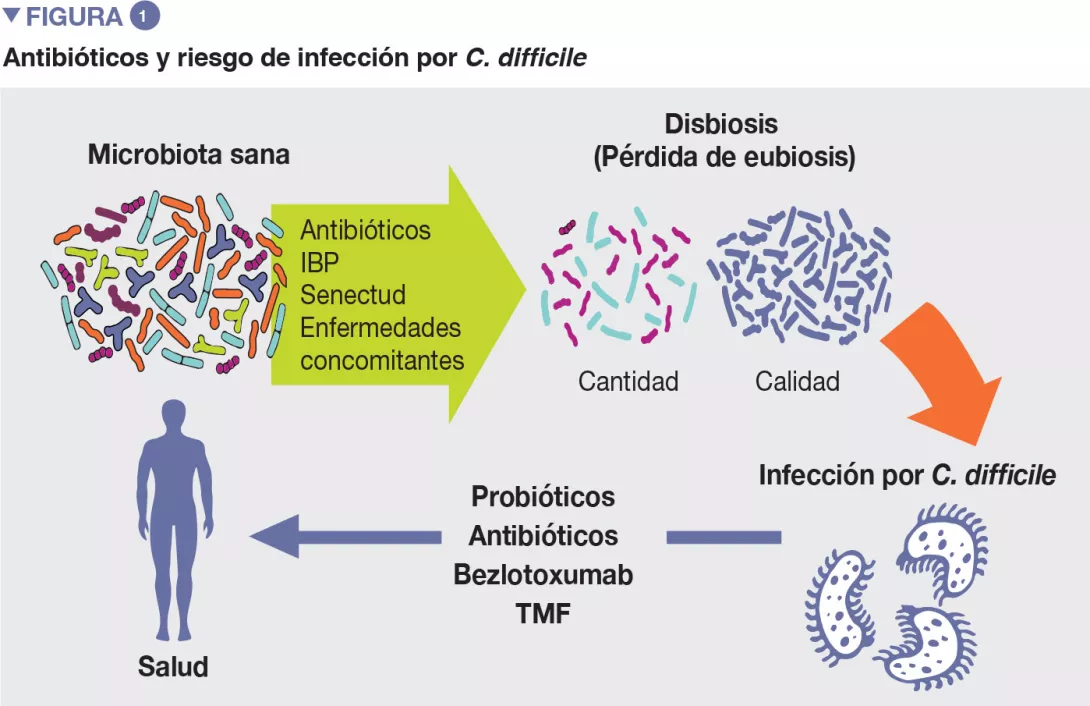
Aunque los antibióticos siguen siendo moléculas esenciales en el arsenal terapéutico, también hay que tener en cuenta sus efectos indeseables sobre la microbiota intestinal, ya que existe un considerable conjunto de datos que respalda la asociación entre su consumo y muchas enfermedades producidas por la disbiosis, como la ICD [5].
En primer lugar, los antibióticos destruyen las bacterias comensales que pueden tener una acción directa contra C. difficile (secretando un cierto número de bacteriocinas), además de competir con el patógeno por los nutrientes (por ejemplo, el ácido siálico y el succinato). No solo eso, sino que las bacterias comensales también desempeñan una función protectora indirecta mediante la regulación de los ácidos biliares.
Recientemente, se ha asociado Clostridium scindens a la resistencia a la colonización por C. difficile. Esta bacteria tiene un operón inducible por los ácidos biliares que también es capaz de codificar enzimas deshidroxilantes que convierten los ácidos biliares primarios en ácidos biliares secundarios. Los ácidos biliares primarios promueven la germinación de esporas de C. difficile, mientras que los ácidos biliares secundarios son capaces de inhibir este proceso [6].
El consumo de antibióticos sistémicos es el factor de riesgo modificable más relevante en relación a las ICD. La microbiota intestinal puede ser determinante en el éxito o fracaso de la colonización del intestino grueso por C. difficile, mediante vías de acceso directas e indirectas. En principio, el desequilibrio de la microbiota intestinal causado por antibióticos de amplio espectro puede acarrear varias consecuencias que desemboquen en una ICD.
En consecuencia, los pacientes con ICD recurrente tienen un perfil microbiano desequilibrado, con una mayor abundancia relativa de familias bacterianas nocivas como Enterobacteriaceae y Veillonellaceae y una menor abundancia relativa de familias favorables, como Ruminococcaceae, Bacteroidaceae y Lachnospiraceae.
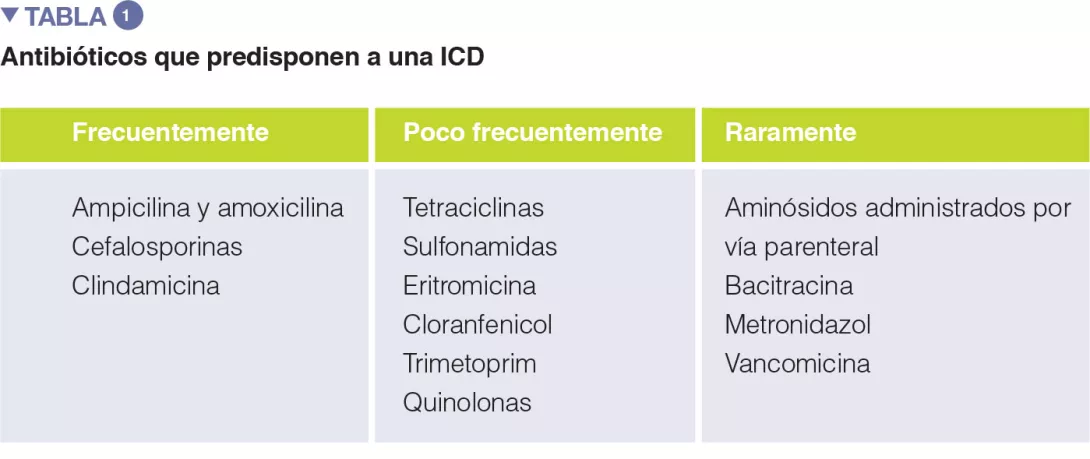
Un cierto número de revisiones sistemáticas, solas o con metaanálisis, han evaluado la relevancia de distintas clases de antibióticos en la aparición de ICD. En el primer metaanálisis (1998), el empleo de antibióticos se asociaba con una multiplicación por 6 del riesgo de contraer ICD, y el riesgo mayor era debido a fluoroquinolonas, clindamicina y cefalosporinas. Es más, se observó que el consumo de antibióticos era un factor predictivo independiente de la recurrencia de ICD (riesgo relativo, odds ratios (OR) 1,76). Uno de los factores clave para prevenir ICD es la promoción de un uso racional de los antibióticos, por lo que es de vital importancia conocer el riesgo de ICD asociado a distintas clases de antibióticos (Tabla 1).
El empleo de los siguientes antibióticos se asocia a un riesgo duplicado de ICD en pacientes hospitalizados: clindamicina, cefalosporinas, carbapenémicos, fluoroquinolonas, trimetoprim, sulfonamidas. En un entorno extrahospitalario, respectivamente, se observó que los antibióticos presentaban distintos niveles de riesgo de aparición o recaída de ICD, como: clindamicina (aumento del riesgo de 8 a 20 veces), cefalosporinas y fluoroquinolonas (aumento de 3 a 5 veces), macrólidos (aumento de 2 a 3 veces) [5].
-
Los inhibidores de la bomba de protones (IBP) se emplean en buena medida en todo el mundo para varios trastornos digestivos altos, como la enfermedad por reflujo gastroesofágico, la hernia de hiato, la gastritis, la infección por H. pylori (con un tratamiento de erradicación con antibióticos) o úlcera gastroduodenal.
-
En general, los IBP se consideran medicamentos seguros. Sin embargo, un numerosos datos demuestran que el empleo de IBP se asocia significativamente con la aparición de ICD.
-
En principio, los IBP pueden aumentar el riesgo de colonización por C. difficile a través de varias vías de acceso, como una reducción de la producción de ácido que puede conducir a una proliferación bacteriana en el intestino delgado y una disbiosis, así como un aumento de las sales biliares que puede favorecer la germinación de esporas de C. difficile. Por último, no hay pruebas claras de que el aumento del pH gástrico ofrezca un entorno más seguro para las esporas [6].
-
Las pruebas clínicas de una asociación significativa entre IBP e ICD provienen de varias revisiones sistemáticas y metaanálisis, con oportunidades relativas que van desde 1,26 hasta 2,34, según estos informes (y desde 3 hasta 67, en función de los metaanálisis).
-
La mayor parte de las pruebas son heterogéneas y provienen de cohortes observacionales, por lo que factores de confusión, como otros fármacos utilizados o enfermedades concomitantes, podrían alterar la calidad de estas observaciones. Sin embargo, la asociación entre IBP e ICD siguió siendo significativa incluso después de la estratificación según el empleo de antibióticos, tanto en estudios de cohortes como estudios caso-control.
-
Se observó que la función nociva de los IBP era más fuerte en caso de ICD extrahospitalarias, lo que sugiere que se produce una utilización excesiva crónica en ambientes extrahospitalarios, más que en hospitales.
-
En concreto, varias metaanálisis (de 3 a 16 estudios) han asociado los IBP no solo con las ICD en general, sino también con las ICD recurrentes, con oportunidades relativas que van desde 1,52 hasta 2,51, aunque las definiciones de recurrencia variaban significativamente entre los estudios.
-
La edad es uno de los factores de riesgo de primoinfección por C. difficile y de ICD recurrente más conocidos.
-
Hay pruebas que demuestran que las tasas de ICD son mucho más elevadas en adultos mayores de 65 años que en la población más joven. En un metaanálisis de 33 estudios, una edad superior a los 65 años se identificaba con un factor predictivo independiente de recidiva de ICD (riesgo relativo 1,63).
-
Sin embargo, la edad es un factor de confusión, puesto que el consumo de distintos medicamentos que favorecen las ICD, como los antibióticos o los IBP, es más habitual en las personas de mayor edad. Cada vez hay más pruebas que sugieren que la microbiota de los pacientes ancianos es menos sana (en términos de diversidad microbiana reducida y aumento de especies oportunistas) de lo normal, lo que respalda de nuevo la función de un desequilibrio de la microbiota en la ICD [7].
La asociación entre ICD y enfermedades concomitantes también se ha explorado de manera sistemática. En una revisión sistemática, se observó un riesgo de ICD significativamente mayor en las enfermedades inflamatorias crónicas del intestino (OR 3,72), la insuficiencia renal (OR 2,64), las neoplasias hemáticas (OR 1,75) y la diabetes (OR 1,15). Esto era especialmente así en las ICD extrahospitalarias [7].
Abordaje terapéutico de la ICD
Tratamiento convencional de la ICD
Tradicionalmente, el metronidazol y la vancomicina han sido las opciones terapéuticas más habituales para tratar la ICD, utilizados ambos como opciones de primera línea, mientras que para tratar las recaídas solo se recomendaba la vancomicina, con una pauta decreciente o intermitente [8].
Sin embargo, en los últimos años, la ICD se ha hecho más complicada de tratar. En concreto, se ha observado que el metronidazol obtenía menores tasas de curación que la vancomicina, de modo que se ha dado preferencia a la vancomicina frente al metronidazol también en caso de primoinfección. Sin embargo, la vancomicina también está perdiendo su eficacia, y las tasas de recurrencia de la enfermedad han aumentado. Es más, han aparecido cepas hipervirulentas de C. difficile, específicamente el ribotipo 027, que es menos sensible al tratamiento antibiótico estándar y se asocia con cuadros clínicos más graves [8].
En los últimos años, la fidaxomicina, un antibiótico de espectro reducido, ha resultado ser superior a la vancomicina para tratar las recurrencias de ICD. Sin embargo, su elevado coste y los pruebas recientes sobre su inferioridad en relación con el trasplante de microbiota fecal (TMF) para tratar la ICD recurrente, son limitaciones posibles para un uso a gran escala [9].
Los antibióticos representan un extraordinario descubrimiento científico y salvan millones de vida, pero su uso excesivo e inadecuado ahora suscita grandes inquietudes para la salud, especialmente debido a la aparición de resistencia a los antibióticos y disbiosis. Leamos la página dedicada a esta cuestión.
El papel ambivalente de los antibióticos
¿Qué es la Semana mundial de concienciación sobre la RAM?
Desde 2015, la OMS organiza cada año la Semana mundial de concienciación sobre la RAM (WAAW), cuyo objetivo es sensibilizar al público sobre la resistencia mundial a los antimicrobianos. Esta campaña, que tendrá lugar del 18 al 24 de noviembre, alienta al público general, a los profesionales sanitarios y a los responsables a hacer un uso razonable de los antimicrobianos para evitar el desarrollo de resistencia a los antimicrobianos.
Moduladores terapéuticas de la microbiota: probióticos y transplante de microbiota fecal
Generalmente, los probióticos se consideran como una opción fiable para restablecer una microbiota intestinal sana después de una disbiosis, provocada por ejemplo por un tratamiento antibiótico. En conjunto, se sabe que algunos probióticos son efectivos para tratar la diarrea posantibiótica (AAD), que es un efecto adverso frecuente en los tratamientos antibióticos [10-12]. En un metaanálisis de 21 ensayos aleatorizados, Saccharomyces boulardii disminuyó significativamente el riesgo de AAD (cociente de riesgos: 0,47) [11].
Como la ICD es básicamente un subgrupo de AAD, se investigó la eficacia de los probióticos para prevenir la ICD. Recientemente, una revisión Cochrane ha demostrado en un metaanálisis de 23 ensayos, que los probióticos son inocuos además de eficaces para prevenir la ICD [13]. Sin embargo, solo han demostrado ser eficaces para prevenir una primoinfección por C. difficile los probióticos específicos, como Saccharomyces boulardii, Lactobacillus casei, una mezcla de L. acidophilus y Bifidobacterium bifidum, y una mezcla de L. acidophilus, L. casei y L. rhamnosus, después de antibioticoterapias. En concreto, S. boulardii era eficaz para prevenir ICD en una cohorte de pacientes mayores hospitalizados, con el consiguiente ahorro económico. De hecho, un estudio canadiense demostró que el consumo de probióticos preventivos podía ahorrar 518 $ por paciente en comparación con la asistencia habitual, y reducir el riesgo de ICD [11]. Sin embargo, se necesitan estudios más amplios para confirmar la función de los probióticos específicos en la prevención de la ICD.
A partir de esta extraordinaria evidencia, las sociedades científicas han incluido el TMF como opción terapéutica para la ICD recurrente [14, 15]. El TMF es conocido por aumentar la supervivencia general y disminuir el tiempo de hospitalización en pacientes con ICD recurrente [16].
Aunque el TMF se ha ido estandarizando a lo largo de los años, aún está infrautilizado. Los futuros enfoques basados en la microbiota que garantizarán una amplia difusión del TMF incluyen un TMF en cápsulas y medicamentos a base de microbiota.
El TMF consiste en la introducción de heces de donantes sanos en el intestino de un paciente receptor para curar los trastornos relacionados con la disbiosis. Hasta la fecha, numerosas revisiones sistemáticas y metaanálisis han demostrado que el TMF es altamente eficaz para curar la ICD recurrente (hasta el 90% de tasas de curación).
Conclusión
La ICD es una enfermedad grave que aparece principalmente en pacientes con varios factores de riesgo, la mayoría asociados con un desequilibrio de la microbiota intestinal, como el abuso de antibióticos, los inhibidores de la bomba de protones y una edad avanzada. Además, desde una perspectiva microbiológica, el perfil microbiano de pacientes con ICD se caracteriza por un profundo desequilibrio de la microbiota intestinal. Los moduladores terapéuticos de la microbiota han demostrado ser eficaces para prevenir (probióticos específicos, algunas cepas de Lactobacillus y S. boulardii) o curar (TMF) las ICD recurrentes, allanando el camino a un enfoque basado en la microbiota para el abordaje de esta afección.








