Кишечная микробиота и Clostridioides difficile
ОБЗОРНАЯ СТАТЬЯ
Профессор Жанлука Яниро (Pr. Gianluca Ianiro)
Центр болезней органов пищеварения, Многопрофильная клиника «А. Gemelli» IRCCS, Рим, Италия
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Автор
Инфекция, вызванная C. difficile (CDI), в последние годы превратилась в клиническое и социально-экономическое бремя для стран всего мира из-за роста заболеваемости, степени тяжести, смертности и вероятности рецидива. Микробиота кишечника в значительной степени вовлечена в процесс развития CDI по многим причинам. Во-первых, большинство факторов риска, связанных с развитием CDI, включая чрезмерное использование антибиотиков широкого спектра действия или ингибиторов протонной помпы, нарушающих баланс микробиоты кишечника. Более того, специфические модуляторы микробиоты можно использовать в профилактике (специфические пробиотики) или лечении (трансплантация фекальной микробиоты) CDI. В этой статье мы рассмотрим эпидемиологию, факторы риска и одобренные методы лечения CDI с точки зрения микробиоты.
Clostridioides difficile (C. difficile, ранее известный как Clostridium difficile) представляет собой грамположительный спорообразующий облигатно анаэробный микроорганизм. Споры позволяют C. difficile сохраняться в окружающей среде и передаваться от одного инфицированного организма к другому. При определенных обстоятельствах, таких как дисбиоз, вызванный антибиотиками, споры прорастают в толстой кишке и превращаются в вегетативные формы, что приводит к клиническим проявлениям инфекции, вызванной Clostridium difficile (CDI). В фазе инфекции C. difficile продуцирует два токсина, энтеротоксин A и цитотоксин B, которые вызывают повреждение колоноцитов и запускают воспалительную реакцию, приводящую к разнообразным клиническим проявлениям, от легкого колита до псевдомембранозного колита и токсического мегаколона [1].
В последние годы CDI стал серьезной проблемой для здравоохранения и экономики большинства стран. Исследования, проведенные в США, показывают, что в 2011 г. заболеваемость CDI составила около 453 000 случаев, из которых 29 000 завершились летальным исходом. В Европе на заболеваемость и смертность приходится 124 000 и 3700 случаев соответственно. Рост заболеваемости, продолжительности госпитализации и смертности усугубляет значительное экономическое бремя CDI, на которое приходилось почти 5 миллиардов долларов в 2011 году в США и почти 3,7 миллиарда евро в 2013 году в Европе [2, 3]. Эти цифры показывают, что заболеваемость CDI выросла во всем мире. Причин несколько. Во-первых, более частое использование антибиотиков. Это известный фактор риска развития CDI. Далее, распространение определенных риботипов — в основном вирулентного риботипа 027, но также 017 в Азии, 018 в Италии, 17,621 в странах Восточной Европы, 24,422 в Океании — способствовало отдельным вспышкам CDI. Кроме того, увеличилось количество диагностированных случаев, что можно связать с разработкой высокочувствительных диагностических тестов, таких как ПЦР, и повышением осведомленности о CDI среди медицинских работников. В целом, основной причиной общего роста заболеваемости CDI является увеличение частоты рецидивов. С 2001 по 2012 год ежегодная частота рецидивов CDI увеличилась почти на 189%, в то время как увеличение общей заболеваемости CDI за тот же период составило почти 43% [2]. Поскольку эффективность антибиотикотерапии рецидивирующей инфекции менее вероятна, чем впервые возникшей, это также ведет к более длительной госпитализации, росту частоты осложнений и смертности.
Известно, что CDI является основной причиной внутрибольничной инфекционной диареи, но последние данные указывают на рост ее частоты за пределами больничных учреждений. На сегодняшний день от 25 до 35% случаев CDI возникают вне больниц. По всей вероятности, они обусловлены несколькими фекально-оральными путями передачи, такими как зоонозые и пищевые инфекции.
Несмотря на это увеличение числа диагностированных случаев, большое значение имеет неправильное установление диагноза и гиподиагностика CDI, как это было показано в исследовании EUCLID
Это предполагает, что значительное число случаев CDI останутся недиагностированными, что увеличит риск распространения болезни.
Нозокомиальная и внебольничная CDI по-видимому различаются по нескольким характеристикам. Во-первых, пациенты с нозокомиальным заболеванием с большей вероятностью будут иметь тяжелую клиническую картину, в то время как внебольничные пациенты могут переносить болезнь без симптомов, что увеличивает риск распространения CDI. Кроме того, известно, что внебольничная CDI распространяется и среди пациентов, не имеющих стандартных факторов риска.
ФАКТОРЫ РИСКА CDI
Хотя точные патогенетические механизмы развития CDI еще до конца не известны, выявлено несколько факторов риска [4], знание о которых крайне важно, поскольку управление модифицируемыми факторами риска является мерой профилактики CDI. К наиболее значимым факторам риска относятся пожилой возраст, использование антибиотиков, ингибиторов протонной помпы и некоторые другие. (рис. 1).
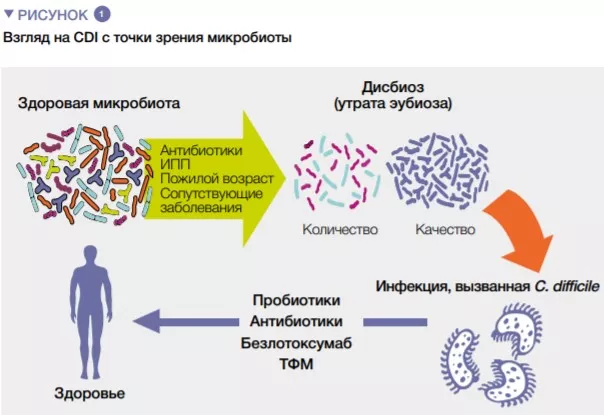
Хотя антибиотики по-прежнему остаются незаменимым инструментом в терапевтическом арсенале, важно принимать во внимание их нежелательное воздействие на микробиоту кишечника. Многочисленные данные подтверждают связь между их использованием и развитием заболеваний, связанных с дисбактериозом, включая CDI [5].
Во-первых, антибиотики часто убивают комменсальные бактерии, которые могут непосредственно подавлять рост C. difficile, секретируя ряд бактерицидных веществ, а также конкурируют с патогенами за питательные вещества, например, сиаловую кислоту и сукцинат. Более того, комменсальные бактерии играют косвенную защитную роль через регуляцию обмена желчных кислот
Недавно была установлена роль Clostridium scindens в препятствии колонизации C. difficile. Он имеет оперон, индуцируемый желчной кислотой, который способен кодировать дегидроксилирующие ферменты, превращающие первичные желчные кислоты во вторичные. Первичные желчные кислоты способствуют прорастанию спор C. difficile, а вторичные способны тормозить этот процесс [6].
Следствием этого является то, что пациенты с рецидивирующей CDI, как правило, имеют несбалансированный микробный профиль с более высоким относительным количеством патогенных семейств бактерий — например, Enterobacteriaceae и Veillonellaceae — и меньшим количеством полезных семейств, включая Ruminococcaceae, Bacteroidaceae и Lachnospiraceae.
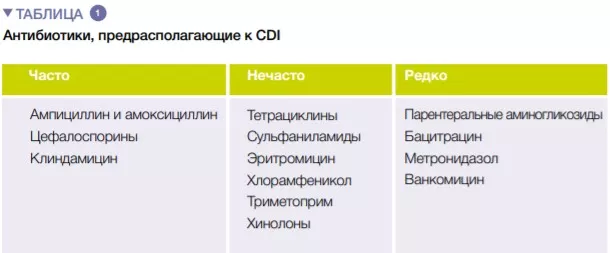
В ряде систематических обзоров (отдельно или с метаанализом), ученые оценивали значимость различных классов антибиотиков для развития CDI. По данным самого раннего метаанализа, проведенного в 1998 году, использование антибиотиков было связано с 6-кратным увеличением риска развития CDI, при этом самый высокий риск наблюдался при использовании фторхинолонов, клиндамицина и цефалоспоринов. Более того, было обнаружено, что использование антибиотиков является независимым предиктором рецидива CDI (относительный риск 1,76). Одним из ключевых факторов предотвращения CDI является подход к применению антибиотиков, поэтому знание о риске развития CDI при применении различных классов антибиотиков имеет первостепенное значение (Таблица 1).
Такие антибиотики как клиндамицин, цефалоспорины, карбапенемы, фторхинолоны, триметоприм, сульфаниламиды в 2 раза повышают риск развития CDI у стационарных пациентов. Во внебольничных условиях антибиотики по-разному влияют на риск развития или рецидива CDI, например, при использовании клиндамицина он увеличивается в 8-20 раз, цефалоспорина и фторхинолонов — в 3-5 раз, а макролидов — в 2-3 раза [5].
- Ингибиторы протонной помпы (ИПП) широко используются во всем мире при некоторых заболеваниях верхних отделов желудочно-кишечного тракта, включая гастроэзофагеальную рефлюксную болезнь, грыжу пищеводного отверстия диафрагмы, гастрит, хеликобактерную инфекцию (наряду с эрадикационной терапией антибиотиками), язвенную болезнь.
- В целом ИПП считаются безопасными препаратами. Однако немало данных указывает, что использование ИПП в значительной степени связано с развитием CDI.
- ИПП способны увеличивать риск колонизации C. difficile несколькими путями, включая снижение выработки соляной кислоты, что может привести к чрезмерному росту бактерий в тонком кишечнике и дисбиозу, а также повысить уровень солей желчных кислот, способствующих прорастанию спор C. difficile. Наконец, не существует четких доказательств того, является ли более кислый желудочный сок более безопасной средой для спор [6].
- Клинические доказательства значимой связи между ИПП и CDI основаны на ряде систематических обзоров и метаанализов, в которых сообщается об отношении шансов в диапазоне от 1,26 до 2,34 (от 3 до 67 согласно различным метаанализам).
- Большинство этих доказательств непоследовательны и получены в наблюдательных исследованиях, поэтому потенциальные вмешивающиеся факторы, включая применение других лекарственных препаратов и наличие сопутствующих заболеваний, могут снизить ценность этого открытия. Тем не менее связь между использованием ИПП и CDI оставалась значимой даже после стратификации по применению антибиотиков как в когортных исследованиях, так и в исследованиях «случай-контроль».
- Обнаружено, что пагубная роль ИПП сильнее по отношению к CDI, возникающих во внебольничных условиях, что в свою очередь свидетельствует о чрезмерном использовании ИПП за пределами лечебных учреждений.
- В частности, данные нескольких метаанализов, включающих от 3 до 16 исследований, указывают, что ИПП связаны не только с развитием CDI в целом, но также и с ее рецидивом (отношение шансов 1,52-2,51, хотя определения рецидива значительно различались в различных исследованиях).
- Пожилой возраст — один из наиболее известных факторов риска первичной и рецидивирующей CDI.
- Установлено, что CDI намного чаще возникает у взрослых старше 65 лет. В метаанализе 33 исследований возраст старше 65 лет был определен как независимый предиктор рецидива CDI (относительный риск 1,63).
- Однако возраст является важным вмешивающимся фактором, так как ряд препаратов, способствующих развитию CDI, таких как антибиотики или ИПП, чаще применяются в пожилом возрасте. Все больше данных свидетельствует о том, что микробиота пожилых пациентов отличается от нормы с точки зрения снижения микробного разнообразия и увеличения числа условно-патогенных видов, что еще раз подтверждает роль дисбаланса микробиоты в развитии CDI [7].
Проводились систематические исследования связи между развитием CDI и отдельными сопутствующими заболеваниями, при этом был обнаружен значимо более высокий риск развития CDI при воспалительных заболеваниях кишечника (ОШ 3,72), почечной недостаточности (ОШ 2,64), гематологических злокачественных новообразованиях (ОШ 1,75) и сахарном диабете (ОШ 1,15). Это особенно применимо к CDI, возникающей вне стационара [7].
ТЕРАПЕВТИЧЕСКИЕ ПОДХОДЫ К ЛЕЧЕНИЮ CDI
ТРАДИЦИОННОЕ ЛЕЧЕНИЕ CDI
Традиционно в качестве препаратов первого ряда для лечения CDI применяют метронидазол и ванкомицин, в то время как для лечения рецидивирующего заболевания рекомендован только ванкомицин, в режиме постепенного снижения дозы или пульсовой терапии [8].
В последние годы лечение CDI стало более сложным. В частности, было показано, что метронидазол обеспечивает более низкую частоту излечения, чем ванкомицин, поэтому последний предпочтительнее метронидазола также при первичной инфекции. Ванкомицин также со временем теряет свою эффективность, что приводит к увеличению частоты рецидивов заболевания. Кроме того, появились гипервирулентные штаммы C. difficile, особенно риботип 027, который менее чувствителен к стандартной антибактериальной терапии и ассоциируется с более тяжелым клиническим течением [8].
В последние годы было показано, что фидаксомицин, антибиотик узкого спектра действия, превосходит ванкомицин в лечении рецидивирующей CDI. Однако его высокая стоимость и недавно показанная меньшая эффективность по сравнению с трансплантацией фекальной микробиоты (ТФМ) в лечении рецидивирующей CDI являются потенциальным препятствием к его широкому использованию [9].
ПРОБИОТИКИ И ТРАНСПЛАНТАЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ
В целом пробиотики считаются надежным средством восстановления здоровой микробиоты кишечника после дисбиотического события, например, антибиотикотерапии. Известно, что некоторые пробиотики эффективны при антибиотикоассоциированной диарее (ААД), которая является частым нежелательным явлением при применении антибиотиков [10-12]. По данным метаанализа 21 рандомизированного исследования, Saccharomyces boulardii значимо снижал риск развития ААД (отношение рисков: 0,47) [11].
Так как CDI в основном является разновидностью ААД, было проведено исследование эффективности пробиотиков в предотвращении CDI. Недавно в Кокрановской базе данных систематических обзоров появились результаты метаанализа 23 исследований, сообщающие, что пробиотики являются безопасным и эффективным средством предотвращения CDI [13]. В то же время лишь некоторые пробиотики оказались эффективными в плане предотвращения первичной CDI после антибиотикотерапии. В их числе Saccharomyces boulardii, Lactobacillus casei, смесь L. acidophilus и Bifidobacterium bifidum и смесь L. acidophilus, L. casei и L. rhamnosus. В частности, S. boulardii эффективно предотвращал CDI в когорте госпитализированных пациентов пожилого возраста, в том числе позволяя снизить затраты на медицинское обслуживание этих пациентов. Действительно, результаты исследования, проводимого в Канаде, показали, что профилактическое использование пробиотиков позволило сэкономить 518 долларов на пациента по сравнению с обычным лечением и снизить риск развития CDI [11]. Однако необходимы дальнейшие более масштабные исследования, чтобы подтвердить роль конкретных пробиотиков в профилактике CDI.
Основываясь на этих впечатляющих результатах, научные сообщества включили ТФМ в число вариантов лечения рецидивирующей CDI [14, 15]. Также известно, что ТФМ увеличивает общую выживаемость и сокращает продолжительность госпитализации у пациентов с рецидивирующей CDI [16].
Хотя подходы к ТФМ со временем все больше стандартизируются, этот метод все еще недостаточно распространен. Будущие подходы на основе использования микробиоты, которые будут гарантировать широкое распространение ТФМ, включают использование инкапсулированных форм ФМ и препараты на основе микробиоты.
ТФМ — введение кала здоровых доноров в кишечник реципиента для лечения расстройств, в основе которых лежит дисбиоз. На сегодняшний день в ряде систематических обзоров и метаанализов показано, что ТФМ очень эффективна при лечении рецидивирующих форм CDI. Частота излечения составляет около 90%.
ВЫВОДЫ
CDI — обременительное заболевание, которое возникает в основном у пациентов с несколькими факторами риска, большинство из которых связано с дисбалансом кишечной микробиоты, включая чрезмерное использование антибиотиков, ингибиторов протонной помпы и пожилой возраст. С микробиологической точки зрения микробный профиль пациентов с CDI характеризуется глубоким нарушением баланса кишечной микробиоты. Показано, что терапевтические модуляторы микробиоты эффективны в предотвращении (некоторые пробиотики, например, штаммы Lactobacillus и S. boulardii) или лечении (ТФМ) рецидивирующей CDI, открывая путь к реализации терапевтического подхода к лечению этого состояния, основанного на изменении состава микробиоты.








