Microbiote intestinal et Clostridioides difficile
Synthèse
Par le Pr. Gianluca Ianiro
Centre des maladies digestives, Fondazione Policlinico « A. Gemelli » IRCCS, Rome, Italie
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Ces dernières années, l’infection à C. difficile (ICD) est devenue, au niveau international, un poids tout à la fois clinique et socioéconomique, du fait d’une augmentation de la morbidité, de la sévérité, de la mortalité et du risque de récidive de la maladie. Le microbiote intestinal joue un rôle considérable dans l’ICD, et ce pour de nombreuses raisons. Tout d’abord, la plupart des facteurs de risque de survenue d’une ICD, notamment le recours excessif aux antibiotiques à large spectre ou aux inhibiteurs de la pompe à protons, sont associés à un déséquilibre du microbiote intestinal. En outre, des modulateurs spécifiques du microbiote jouent un rôle dans la prévention (probiotiques spécifiques) ou le traitement (transplantation de microbiote fécal) de l’ICD. Dans cet article, nous allons examiner l’épidémiologie, les facteurs de risque et les traitements homologués de l’ICD, via une approche centrée sur le microbiote.
Clostridioides difficile (C. difficile, anciennement Clostridium difficile) est une bactérie anaérobie stricte à Gram positif sporulée. Les spores permettent à C. difficile de rester dans l’environnement et de se disséminer à partir des sujets infectés. Des conditions particulières (comme la dysbiose induite par les antibiotiques) favorisent la germination des spores dans le côlon, qui prennent alors une forme végétative dont le résultat est l’infection clinique (infection à Clostridium difficile [ICD]). Pendant la phase d’infection, C. difficile produit deux toxines : l’entérotoxine A et la cytotoxine B qui endommagent les colonocytes et déclenchent la réponse inflammatoire, ce qui conduit à différents tableaux cliniques allant d’une colite d’intensité légère à une colite pseudo-membraneuse et un mégacôlon toxique [1].
Ces dernières années, l’ICD est devenue un enjeu sanitaire et économique considérable dans la plupart des pays. Des études réalisées aux États-Unis rapportent une incidence de près de 453 000 cas et de près de 29 000 décès par ICD en 2011, et une incidence en Europe de 124 000 cas/an, avec près de 3 700 décès/ an. L’augmentation de la morbidité, de la durée d’hospitalisation et de la mortalité contribue à l’impact économique majeur de l’ICD, qui représentait près de 5 milliards de dollars aux États-Unis en 2011 et près de 3,7 milliards d’euros en Europe en 2013 [2, 3]. Ces chiffrent montrent que l’incidence des ICD a augmenté partout dans le monde, et ce pour différentes raisons. La première est le recours accru aux antibiotiques, qui sont un facteur de risque connu d’ICD. En outre, la diffusion de ribotypes spécifiques (principalement le ribotype virulent 027, mais également le 017 en Asie, le 018 en Italie, le 17 621 en Europe de l’Est et le 24 422 en Océanie) a permis le développement de cas groupés d’ICD. Le nombre de diagnostics a également augmenté du fait du développement de tests ultrasensibles (comme la PCR) et de la sensibilisation accrue auprès des professionnels de santé. La principale cause de l’augmentation globale de l’incidence des ICD semble être le taux accru de récidives. De 2001 à 2012, l’incidence annuelle des ICD récidivantes a augmenté de près de 189 %, alors que l’augmentation de l’incidence des ICD dans leur ensemble pendant la même période était de près de 43 % [2]. Dans la mesure où une infection récidivante a moins de chances d’être guérie par des antibiotiques qu’un premier épisode, elle est associée à une augmentation de la durée d’hospitalisation, de la morbidité et de la mortalité.
L’ICD est la première cause de diarrhée infectieuse associée aux soins de santé, mais des données récentes suggèrent une augmentation des cas communautaires. À ce jour, près de 25 à 35 % des cas d’ICD sont d’origine communautaire, probablement par le biais de différentes voies de transmission féco-orale (zoonose et alimentation par exemple).
Malgré cette augmentation des diagnostics d’ICD, un nombre considérable de patients atteints n’est toujours pas diagnostiqué, comme le montre l’étude EUCLID, ce qui augmente le risque de diffusion de la maladie.
Les ICD nosocomiales et communautaires semblent différer à plusieurs égards.
Tout d’abord, les patients atteints d’une infection nosocomiale ont davantage de risques de présenter un tableau clinique sévère, alors que ceux atteints d’une infection communautaire peuvent être des porteurs asymptomatiques, ce qui augmente le risque de diffusion de l’ICD.
D’autre part, on sait que l’ICD communautaire se diffuse également chez les patients sans facteur de risque standard.
Facteurs de risque de survenue d'une infection a c.difficile
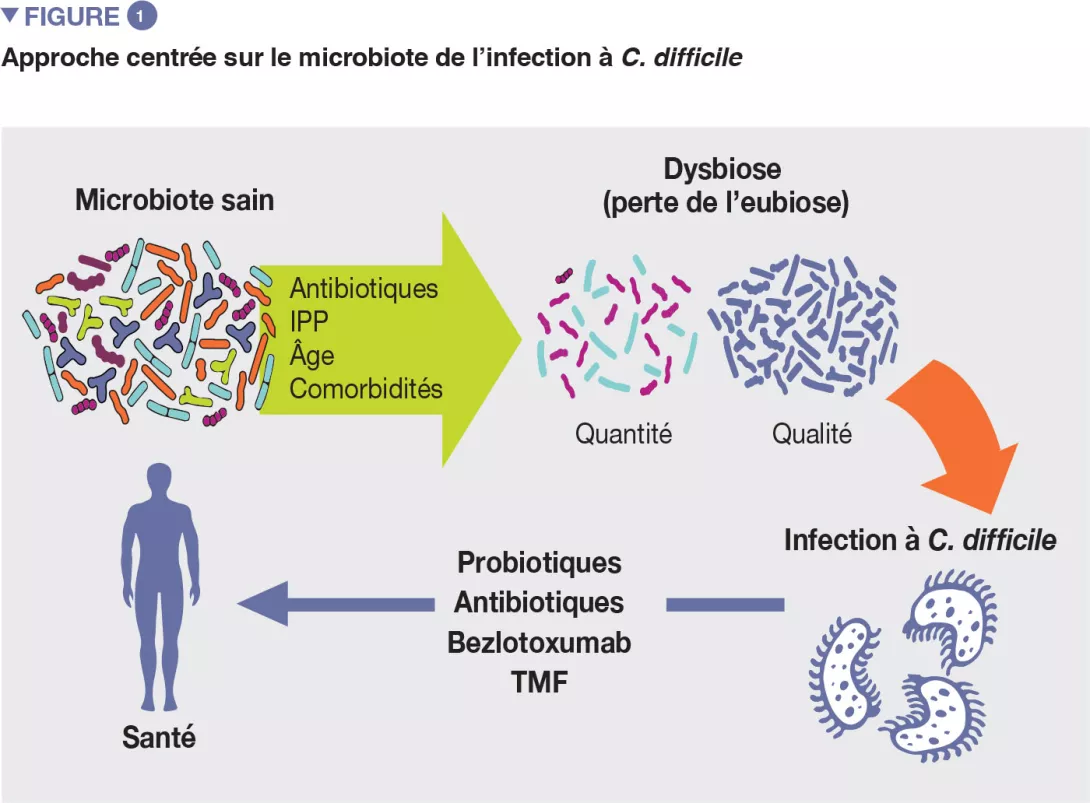
Bien que les mécanismes pathogènes exacts de l’ICD ne soient pas encore clairement établis, plusieurs facteurs de risque ont été identifiés [4]. Il est important de les connaître car le contrôle des facteurs de risque modifiables constitue une mesure de prévention contre les ICD. Les principaux facteurs de risque sont notamment l’âge, le recours aux antibiotiques et les inhibiteurs de la pompe à protons (Figure 1).
Si les antibiotiques restent aujourd’hui des molécules indispensables à l’arsenal thérapeutique, il convient également de prendre en compte leurs effets indésirables sur le microbiote intestinal ; un nombre important de données montre en effet une association entre leur utilisation et de nombreuses maladies associées à la dysbiose, notamment l’ICD [5].
Tout d’abord, les antibiotiques peuvent détruire les bactéries commensales capables d’exercer une action directe contre C. difficile (grâce à la sécrétion d’un certain nombre de bactériocines) et également entrer en compétition avec le pathogène pour les nutriments (comme l’acide sialique et le succinate). Les bactéries commensales jouent également un rôle protecteur indirect par la régulation des acides biliaires.
Clostridium scindens a récemment été associée à une résistance à la colonisation par C. difficile. Cette bactérie possède un opéron inductible par les acides biliaires qui est capable de coder pour des enzymes déshydroxylantes qui transforment les acides biliaires primaires en acides biliaires secondaires. Les acides biliaires primaires favorisent la germination des spores de C. difficile, alors que les acides biliaires secondaires ont la capacité d’inhiber ce processus [6].
Le recours aux antibiotiques systémiques est le facteur de risque modifiable le plus important des ICD. Le microbiote intestinal peut être un élément déterminant dans la réussite ou l’échec de la colonisation du côlon par C. difficile, via des voies directes et indirectes. En principe, le déséquilibre du microbiote intestinal induit par les antibiotiques à large spectre peut avoir plusieurs conséquences conduisant à une ICD.
En corollaire, les patients souffrant d’ICD récidivante ont un profil microbien déséquilibré, caractérisée par une abondance relative plus importante de familles bactériennes nocives telles que Enterobacteriaceae et Veillonellaceae, et une abondance relative plus faible de familles bénéfiques, notamment Ruminococcaceae, Bacteroidaceae et Lachnospiraceae.
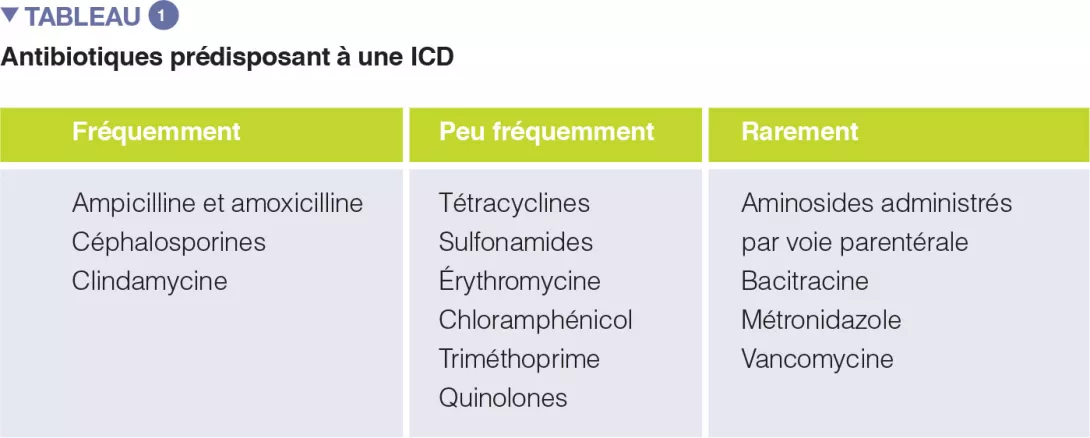
Un certain nombre de revues systématiques, seules ou avec méta-analyse, ont évalué le rôle de différentes classes d’antibiotiques dans la survenue d’ICD. Dans la première méta-analyse (1998), le recours aux antibiotiques a été associé à une multiplication par 6 du risque de survenue d’une ICD, avec un risque maximal pour les fluoroquinolones, la clindamycine et les céphalosporines. De plus, le recours aux antibiotiques s’est avéré être un facteur prédictif indépendant de la récidive de l’ICD (risque relatif 1,76). L’un des facteurs-clés de la prévention des ICD est la promotion du bon usage des antibiotiques, et il est donc essentiel de connaître le risque d’ICD associé aux différentes classes d’antibiotiques (Tableau 1).
L’utilisation des antibiotiques suivants est associée à un doublement du risque d’ICD chez les patients hospitalisés : clindamycine, céphalosporines, carbapénèmes, fluoroquinolones, triméthoprime et sulfonamides. Dans la communauté, les antibiotiques sont associés à différents niveaux de risque de survenue ou de récidive de l’ICD, à savoir : clindamycine (risque multiplié par 8 à 20), céphalosporines et fluoroquinolones (multiplication par 3 à 5), macrolides (multiplication par 2 à 3) [5].
-
Les inhibiteurs de la pompe à protons (IPP) sont largement utilisés dans le monde entier pour le traitement de différents troubles gastro-intestinaux, notamment le reflux gastro-oesophagien, la hernie hiatale, la gastrite, l’infection à H. pylori (avec une antibiothérapie d’éradication) et l’ulcère gastroduodénal.
-
Dans l’ensemble, les IPP sont considérés comme des médicaments sûrs. Cependant, de nombreuses données montrent que le recours aux IPP est associé de façon significative à la survenue d’ICD.
-
En principe, les IPP peuvent majorer le risque de colonisation par C. difficile selon différents mécanismes, notamment la réduction de la production d’acide pouvant conduire à une pullulation bactérienne de l’intestin grêle et à une dysbiose et l’augmentation des sels biliaires, qui peut favoriser la germination des spores de C. difficile. Enfin, le fait qu’un pH gastrique plus élevé constitue un environnement plus sûr pour les spores n’est pas clairement établi [6].
-
Les preuves cliniques d’une association significative entre les IPP et l’ICD proviennent de plusieurs revues systématiques et méta- analyses, avec des odds ratios allant de 1,26 à 2,34, selon les études (de 3 à 67, en fonction des méta-analyses).
-
La plupart des données sont hétérogènes et proviennent de cohortes observationnelles, donc des facteurs de confusion tels que les autres médicaments utilisés, et les comorbidités pourraient altérer la qualité de cette observation. Cependant, l’association entre les IPP et l’ICD est restée significative même après stratification selon le recours aux antibiotiques, à la fois dans les études de cohorte et les études cas-témoins.
-
Le rôle délétère des IPP s’est avéré plus prononcé dans les ICD communautaires, ce qui suggère une utilisation excessive chronique dans la communauté plutôt qu’à l’hôpital.
-
Plus spécifiquement, les IPP ont été associés non seulement aux ICD dans leur ensemble, mais également aux ICD récidivantes, d’après plusieurs méta-analyses (comprenant de 3 à 16 études), avec des odds ratios allant de 1,52 à 2,51, même si les définitions de la récidive variaient significativement entre les études.
-
L’âge est l’un des facteurs de risque les plus connus de l’ICD primaire et récidivante.
-
Des preuves établies montrent que les taux d’ICD sont beaucoup plus élevés chez les adultes de plus de 65 ans que dans la population plus jeune. Dans une méta-analyse de 33 études, un âge supérieur à 65 ans a été identifié comme facteur prédictif indépendant de la récidive de l’ICD (risque relatif 1,63).
-
Toutefois, l’âge est un facteur de confusion important dans la mesure où l’utilisation de différents médicaments favorisant les ICD (antibiotiques, IPP) est plus fréquente chez les personnes âgées. De plus en plus d’éléments suggèrent que le microbiote des patients âgés est moins sain (du fait d’une réduction de la diversité microbienne et d’une augmentation des espèces opportunistes), ce qui confirme par ailleurs le rôle du déséquilibre du microbiote dans l’ICD [7].
L’association entre l’ICD et certaines comorbidités a été étudiée de manière systématique. Dans une revue systématique, un risque d’ICD significativement plus élevé a été observé pour les maladies inflammatoires chroniques de l’intestin (OR 3,72), l'insuffisance rénale (OR 2,64), les cancers hématologiques (OR 1,75) et le diabète (OR 1,15). Cette observation était particulièrement vraie pour les ICD communautaires [7].
Prise en charge thérapeutique de l'ICD
Traitement classique de l'ICD
Traditionnellement, le métronidazole et la vancomycine sont les options thérapeutiques les plus courantes dans l’ICD, les deux étant utilisées en première ligne ; mais seule la vancomycine a été recommandée selon un schéma à doses dégressives et intermittentes pour traiter les récidives [8].
Cependant ces dernières années, l’ICD est devenue plus difficile à traiter. Notamment, le métronidazole a montré des taux de guérison plus faibles que la vancomycine, de sorte que la vancomycine a été préférée au métronidazole pour les primo-infections également. Dans l’ensemble, la vancomycine perd également de son efficacité, et les taux de récidives augmentent. On assiste en outre à l’émergence de souches hypervirulentes de C. difficile, notamment le ribotype 027, qui répond moins bien aux antibiotiques standard et qui est associé à des tableaux cliniques plus sévères [8].
Ces dernières années, la fidaxomicine (un antibiotique à spectre étroit) s’est montrée supérieure à la vancomycine dans le traitement des récidives d’ICD. Cependant, son coût élevé et les récentes preuves de sa moindre efficacité par rapport à la transplantation de microbiote fécal (TMF) dans le traitement de l’ICD récidivante constituent des obstacles potentiels à son utilisation à grande échelle [9].
Les antibiotiques constituent une découverte scientifique extraordinaire qui permet de sauver des millions de vies, mais leur utilisation excessive et injustifiée suscite désormais de grandes inquiétudes pour la santé, notamment en raison de l'apparition de résistance aux antibiotiques et de dysbioses. Lisons la page consacrée à cette question.
Le rôle ambivalent des antibiotiques
Qu'est-ce que la Semaine mondiale de sensibilisation à la résistance aux antimicrobiens ?
Depuis 2015, l'OMS organise chaque année la Semaine mondiale de sensibilisation à la résistance aux antimicrobiens (WAAW) dont l'objectif est de sensibiliser sur le phénomène mondial de la résistance aux antimicrobiens. Cette campagne, qui se tiendra du 18 au 24 novembre, encourage le grand public, les professionnels de santé et les décideurs à faire un bon usage des antimicrobiens afin d'éviter l'apparition de résistance.
Modulateurs thérapeutiques du microbiote : les probiotiques et la transplantation de microbiote fécal
Les probiotiques sont généralement considérés comme une option fiable pour rétablir un microbiote intestinal sain après une dysbiose, induite par exemple par une antibiothérapie. Dans l’ensemble, certains probiotiques se sont révélés efficaces contre la diarrhée associée aux antibiotiques (DAA), qui est un effet indésirable fréquent de l’antibiothérapie [10-12]. Dans une méta-analyse de 21 essais randomisés, Saccharomyces boulardii a significativement réduit le risque de DAA (rapport de risques : 0,47) [11].
Dans la mesure où l’ICD peut être considérée comme un sous-groupe de DAA, l’efficacité des probiotiques dans la prévention des ICD a été évaluée. Une revue Cochrane a récemment montré, dans une méta-analyse de 23 essais, que les probiotiques sont à la fois sûrs et efficaces pour prévenir les ICD [13]. Cependant, seuls des probiotiques spécifiques, notamment Saccharomyces boulardii, Lactobacillus casei, un mélange de L. acidophilus et de Bifidobacterium bifidum, et un mélange de L. acidophilus, L. casei et L. rhamnosus, se sont révélés efficaces pour prévenir les ICD primaires après une antibiothérapie. En particulier, S. boulardii a montré son efficacité dans la prévention des ICD dans une cohorte de patients âgés hospitalisés, avec des économies potentielles à la clé. En effet, une étude canadienne a montré que l’utilisation de probiotiques préventifs avait permis d’économiser 518 $/patient par rapport à la prise en charge habituelle et de réduire le risque d’ICD [11]. Cependant, d’autres études à plus grande échelle sont nécessaires pour confirmer le rôle de probiotiques spécifiques dans la prévention des ICD.
Sur la base de ces résultats exceptionnels, les sociétés scientifiques ont inclus la TMF dans les options thérapeutiques pour les ICD récidivantes [14, 15]. On sait également que la TMF augmente la survie globale et réduit la durée d’hospitalisation chez les patients souffrant d’ICD récidivantes [16].
Bien que la TMF soit de plus en plus standardisée, elle reste encore sous-utilisée. Les approches qui garantiront à l’avenir une large diffusion de la TMF sont notamment la TMF par gélules et les médicaments à base de micro-organismes intestinaux.
La TMF consiste en l’introduction des selles d’un donneur sain dans le tube digestif d’un patient receveur afin de guérir les troubles liés à la dysbiose. À ce jour, plusieurs revues systématiques et méta-analyses ont montré que la TMF est extrêmement efficace pour guérir les ICD récidivantes (avec des taux de guérison pouvant atteindre 90 %).
Conclusion
L’ICD est une maladie lourde qui touche principalement les patients présentant plusieurs facteurs de risque, dont la plupart sont associés à un déséquilibre du microbiote intestinal, notamment le recours excessif aux antibiotiques, aux inhibiteurs de la pompe à protons et l’âge. Du point de vue microbiologique, le profil microbien des patients atteints d’ICD est caractérisé par une importante dysbiose du microbiote intestinal. Des modulateurs thérapeutiques du microbiote se sont révélés efficaces pour prévenir (probiotiques spécifiques, certaines souches de Lactobacillus et S. boulardii) ou guérir (TMF) les ICD récidivantes, ouvrant la voie à une approche basée sur le microbiote pour la prise en charge de cette maladie.








