Microbiota bucal y enfermedades crónicas
Por el Dr. Jay Patel
Instituto Usher de Ciencias de la Salud de Poblaciones e Informática, Universidad de Edimburgo, Reino Unido
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Aunque la medicina moderna reconoce cada vez más la función coevolutiva del microbioma humano como factor determinante de la salud humana, el microbioma bucal sigue siendo un factor aislado en gran medida que contribuye a la salud general y al bienestar. Cuando hay buena salud, el microbioma bucal mantiene un cuidadoso equilibrio simbiótico con el anfitrión, en el que las bacterias dañinas se encuentran en niveles clínicamente intrascendentes. Sin embargo, las presiones ambientales externas vuelven fácilmente disbiótico el microbioma oral, donde una proporción y diversidad inadecuadas de microbios colonizan la boca. Estas presiones ambientales suelen ser factores de riesgo muy modificables. Un conjunto de datos cada vez mayor sugiere que la relevancia d e esta alteración no se limita simplemente a la actividad local de la enfermedad, sino que tiene un perfil de riesgo diseminado para otras enfermedades crónicas importantes del organismo, con una elevada carga de morbimortalidad mundial, como la diabetes, la enfermedad cardiovascular ateroesclerótica y la artritis reumatoide.
Cuando hay buena salud, el microbioma oral representa una comunidad equilibrada y diversa, que protege a la boca de las enfermedades. Los estilos de vida modernos pueden alterar fácilmente este equilibrio, haciendo que la comunidad sea menos protectora y cada vez más perjudicial.
Mecanismo patogénico
La morfología, el calor y la humedad de la boca ofrecen a la microbiota bucal un hábitat muy diverso para la colonización y el crecimiento. Desde el nacimiento, los niños adquieren un microbioma bucal sencillo, y con la edad, la salida de los dientes y el papel añadido de factores externos, esta comunidad se hace cada vez más compleja. Tanto los factores derivados del anfitrión como los derivados de los microbios mantienen el equilibrio homeostático del microbioma bucal necesario para la salud.
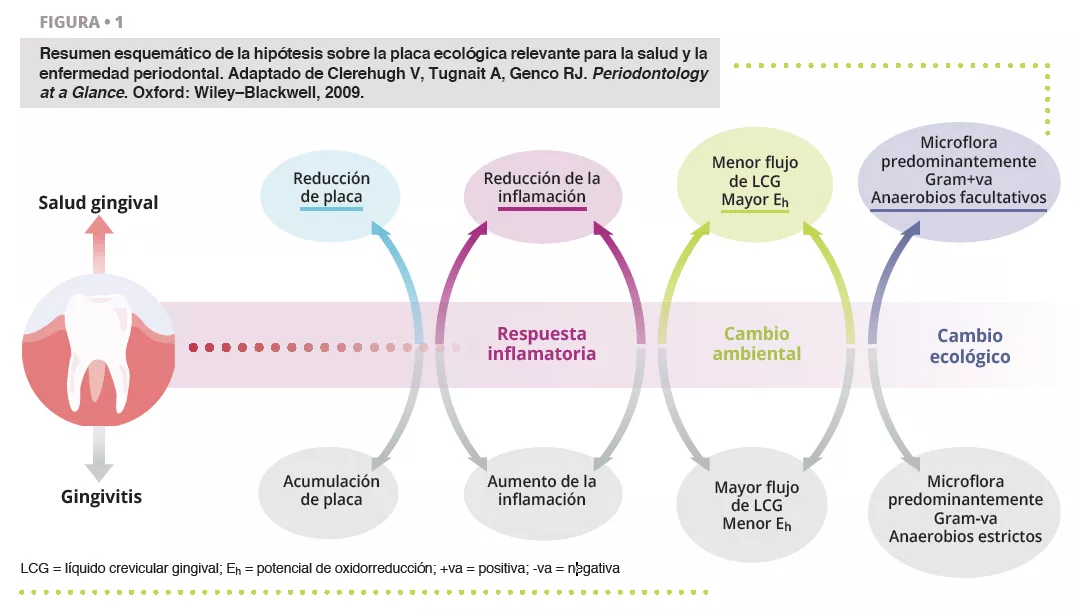
Una higiene bucal deficiente puede ejercer una gran presión ecológica que lleve a las comunidades microbianas complejas de la boca a la disbiosis [1].
Los cambios ecológicos en un ecosistema disbiótico favorecen la colonización y proliferación de bacterias patógenas bucales (figura 1). Cuando aumenta la cantidad de estas especies, también aumenta el riesgo de enfermedad bucal. La enfermedad periodontal es un proceso inflamatorio crónico que no se resuelve y que conduce a la degradación de los tejidos del aparato de soporte del diente, y puede provocar la pérdida del diente, si no se trata. Actividades corrientes como masticar, usar hilo dental y cepillarse los dientes pueden provocar bacteriemia, lo que facilita la diseminación hematógena de bacterias bucales y de mediadores inflamatorios, lo que causa una inflamación generalizada en algunos pacientes [2]. Los pacientes con enfermedad periodontal —la sexta enfermedad más prevalente que afecta a la humanidad en todo el mundo [3]— presentan epitelio del surco microulcerado y tejidos periodontales dañados, por lo que parecen ser más susceptibles a la bacteriemia. Por lo tanto, el estado inflamatorio de la enfermedad periodontal metastatiza en otras partes del cuerpo, lo que puede ocurrir a niveles clínicamente relevantes. Así pues, una buena higiene bucal es fundamental para controlar la carga bacteriana total de la boca, mantener o restablecer el equilibrio simbiótico bucal y evitar la diseminación de bacterias bucales a otros sitios del cuerpo.
Las características del microbioma bucal no solo se limitan a cambios patológicos bucales, sino que pueden influir en la salud general y, en ciertos casos, esta influencia se puede medir tanto en sentido positivo como negativo.
Diabetes
Las pruebas más sólidas que corroboran un papel bidireccional entre la salud bucal y la general se refieren a la relación dosisdependiente entre la gravedad de la periodontitis y las complicaciones derivadas de la diabetes.
La diabetes de tipo 2 es un trastorno metabólico caracterizado por una producción insuficiente de insulina y la consiguiente incapacidad del organismo para metabolizar la glucosa, lo que provoca altos niveles de glucemia (hiperglucemia crónica). La periodontitis grave tiene una gran influencia en los niveles de glucohemoglobina (HbA1c) y de glucemia en ayunas en personas con y sin diabetes [4]. Así pues, la periodontitis está reconocida como la sexta complicación más importante de la diabetes, ya que el riesgo de periodontitis aumenta entre 2 y 3 veces en personas que la padecen [5].
19–33% En comparación con personas con buena salud periodontal, los pacientes con periodontitis grave tienen un alto riesgo del 19-33% de padecer diabetes [6].
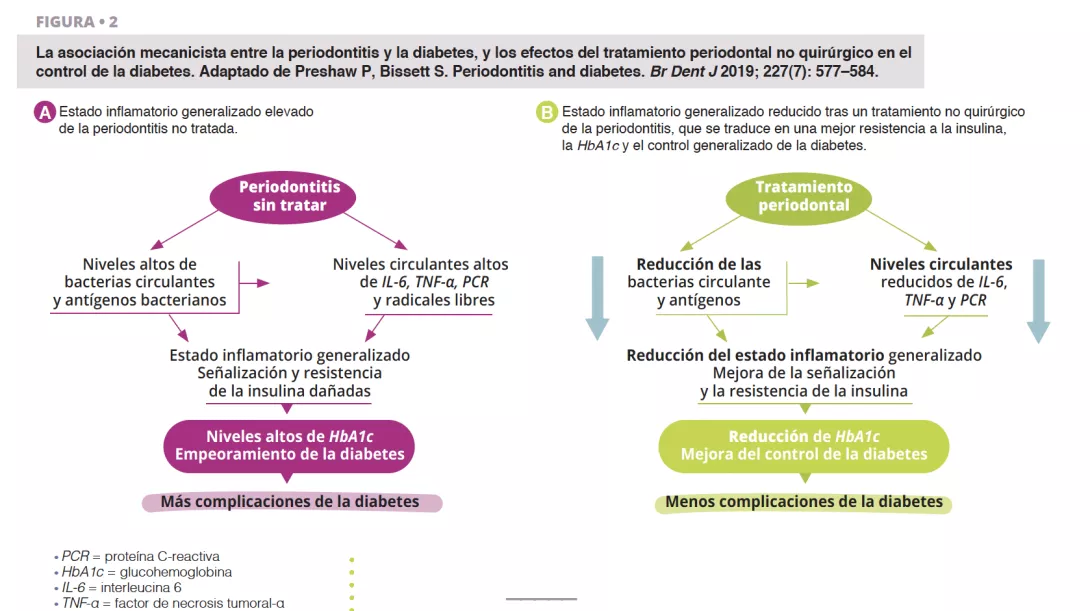
La periodontitis grave sin tratar se asocia a un aumento de los niveles circulantes de bacterias y de antígenos bacterianos, de mediadores proinflamatorios y de citocinas, así como a un aumento de los niveles de interleucina 6, factor de necrosis tumoral alfa, proteína C-reactiva y radicales libres de oxígeno. Este efecto combinado favorece las condiciones de una inflamación generalizada, lo que perjudica a la señalización y la resistencia de la insulina [6]. Clínicamente, esto se reconoce a través del aumento de la HbA1c y de la progresión de la diabetes, con un mayor riesgo de complicaciones diabéticas. El tratamiento periodontal reduce la carga bacteriana bucal y, por lo tanto, disminuye los niveles circulantes de mediadores inflamatorios, lo que reduce a su vez el grado de estado inflamatorio generalizado (figura 2). Por lo tanto, el abordaje dental de la periodontitis puede conducir a una mejoría clínicamente relevante del control glucémico, en el que pacientes con diabetes presentarán una reducción de la HbA1c de entre el 0,3 y el 0,4 % hasta cuatro meses después del tratamiento.
Enfermedad cardiovascular ateroesclerótica
La aterosclerosis describe la acumulación de grasas, colesterol y glóbulos sanguíneos que forman depósitos de placa endurecida en las paredes arteriales, que ocluyen el flujo sanguino a través de los vasos y, a su vez, aumentan el riesgo de complicaciones cardiovasculares.
Las bacterias orales son agentes infecciosos que contribuyen a la patogénesis de la aterosclerosis, a través de la invasión de las células cardiovasculares del anfitrión, concretamente las células endoteliales [7].
La enfermedad periodontal crónica puede provocar una disfunción endotelial, a través de un estado inflamatorio generalizado lo que se puede demostrar mediante el aumento de los niveles de IL-6, de fibrinógenos y de productos bacterianos periodontopáticos, como vesículas de membrana externa y gingipainas [8]. Parece que gran parte de la patología aterosclerótica se puede atribuir a Porphyromonas gingivalis. Sin embargo, se han estudiado Aggregatibacter actinomycetemcomitans, Prevotella intermedia, Tannerella forsythia y Fusobacterium nucleatum en relación con esta asociación. Las principales implicaciones microbianas son una disfunción endotelial y provocar aterosclerosis en células cardiovasculares. P. gingivalis tiene la capacidad de adherirse a células endoteliales diana, y factores externos permiten su entrada celular, donde provoca efectos procoagulantes. Los resultados de un ensayo controlado, aleatorizado, con simple ciego y con grupos paralelos revelaron que, aunque el tratamiento periodontal intensivo provocaba una inflamación generalizada y una disfunción endotelial a corto plazo, 6 meses después del tratamiento se observaron mejoras clínicas y bioquímicas en la función endotelial [9]. El estudio refuerza la teoría de que el control periodontal puede modular los procesos cardiovasculares ateroscleróticos..
Artritis reumatoide
La artritis reumatoide es una enfermedad inflamatoria autoinmune crónica que afecta al líquido sinovial de las articulaciones de forma simétrica y, si no se trata, a otros órganos. Porphyromonas gingivalis está implicada en la fisiopatología de la artritis reumatoide, donde las bacterias producen encimas que tienen la capacidad de citrulinar proteínas, lo que aumenta la probabilidad de reducciones en la tolerancia inmunitaria del anfitrión y promueve la liberación de anticuerpos característicos de la enfermedad [10]. característicos de la enfermedad [10]. Varios estudios han demostrado que una periodontitis causada por biopelículas bucales disbióticas puede desencadenar una artritis reumatoide con inflamación generalizada y mayor erosión ósea. Se ha planteado una relación bidireccional entre las enfermedades inflamatorias, pero se necesitan más pruebas para confirmar este punto [11].
82% Los datos de estudios transversales de Estados Unidos han mostrado un aumento del 82 % de la artritis reumatoide asociada a una periodontitis e identificada por un aumento de la pérdida de inserción periodontal [12].
Los médicos implicados en el abordaje reumatológico de pacientes con artritis deben ser conscientes del papel de la periodontitis como factor modulador de la eficacia de los tratamientos biológicos antirreumáticos que modifican la enfermedad, ya que el mantenimiento de una inflamación generalizada podría afectar a la respuesta al tratamiento.
Parece que el tratamiento periodontal no quirúrgico mejora la expresión bioquímica de la artritis reumatoide, pero aún no se conoce del todo su función en la mejora de los resultados clínicos.
En pacientes con biofilms bucales disbióticos, en los que las proporciones de bacterias periodontopáticas capaces de citrulinar proteínas son superiores a las de personas sanas, sería prudente incluir un tratamiento preventivo y curativo para estabilizar el microbioma bucal y la inflamación periodontal como elemento central del plan de abordaje reumatológico.
Prevención
Los avances científicos en la comprensión del microbioma bucal demuestran su contribución tanto a la salud bucodental como a la salud y el bienestar general. Actualmente, la hipótesis de la placa ecológica es una teoría aceptada que plantea cambios microbiológicos en la boca, donde cambios en la ecología del microbioma bucal provocan una desarmonía que favorece el aumento del número de patógenos más dañinos [13]. La diseminación de bacterias bucales por vía sistémica a sitios del cuerpo se reduce sustancialmente mejorando el control de la carga microbiana bucal. La eliminación mecánica diaria de la placa, mediante una técnica sistemática y exhaustiva de cepillado y limpieza interdental, reduce el volumen de esta carga y evita la colonización de especies patógenas. Un buen control de la placa también previene el riesgo de padecer enfermedades periodontales, caracterizadas por la microulceración de la arquitectura gingival, que crea canales para la filtración de bacterias y mediadores inflamatorios.
Si se complementan con intervenciones profesionales por parte de los dentistas (por lo general, instrucciones de higiene oral, control de factores de riesgo y eliminación mecánica de la placa), los procesos de enfermedad periodontal pueden estabilizarse y, si son leves, detenerse.
Cuando el equilibrio microbiano se ha visto alterado por una enfermedad, el equilibrio simbiótico del microbioma bucal puede restablecerse y estabilizarse mediante intervenciones personales y profesionales relativamente sencillas.
Conclusión
La investigación que estudia la asociación entre los cambios en el microbioma bucal y las enfermedades crónicas generalizadas sigue ampliándose. Existen numerosas razones probables para justificar la bidireccionalidad de estas presuntas conexiones. En la disbiosis del microbioma bucal, el principal factor de aparición y progresión de enfermedades locales y generales es mediado por factores de riesgo altamente modificables, lo que refuerza el valor de la prevención y la necesidad de que los sistemas sanitarios reorienten su modo de prestación asistencial para dar cabida a la prestación de atención sanitaria oral preventiva.
1. Kilian M, Chapple IL, Hannig M, et al.. The oral microbiome - an update for oral healthcare professionals. Br Dent J 2016; 221: 657–66.
2. Patel J, Sampson V. The role of oral bacteria in COVID-19. Lancet Microbe 2020; 1: e105.
3. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 2020; 396: 1204–22.
4. Preshaw PM, Alba AL, Herrera D, et al. Periodontitis and diabetes: a two-way relationship. Diabetologia 2012; 55: 21–31.
5. Teeuw WJ, Kosho MX, Poland DC, Gerdes VE, Loos BG. Periodontitis as a possible early sign of diabetes mellitus. BMJ Open Diabetes Res Care 2017; 5: e000326.
6. Preshaw P, Bissett S. Periodontitis and diabetes. Br Dent J 2019; 227: 577–84.
7. Tonetti MS, Van Dyke TE; working group 1 of the joint EFP/AAP workshop. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Periodontol 2013; 84(Suppl 4): S24–S29.
8. Reyes L, Herrera D, Kozarov E, Roldán S, Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J Clin Periodontol 2013; 40 (Suppl 14): S30-S50.
9. Tonetti MS, D’Aiuto F, Nibali L, et al. Treatment of periodontitis and endothelial function. N Engl J Med 2007; 356: 911–20.
10. Quirke AM, Lugli EB, Wegner N, et al. Heightened immune response to autocitrullinated Porphyromonas gingivalis peptidylarginine deiminase: a potential mechanism for breaching immunologic tolerance in rheumatoid arthritis. Ann Rheum Dis 2014; 73: 263–9.
11. González-Febles J, Sanz M. Periodontitis and rheumatoid arthritis: What have we learned about their connection and their treatment? Periodontol 2000 2021; 87: 181–203.
12. de Pablo P, Dietrich T, McAlindon TE. Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population. J Rheumatol 2008; 35: 70–6.
13. Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res 1994; 8: 263–71.

