Microbiota oral e doenças crónicas
Pelo Dr. Jay Patel
Usher Institute of Population Health Sciences and Informatics, University of Edinburgh, United Kingdom
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
Embora o papel co-evolutivo do microbiota humano na saúde seja cada vez mais reconhecido na medicina moderna, a contribuição da microbiota oral para a saúde e o bem-estar é ainda largamente ignorada. Em condições normais, a microbiota oral mantém um delicado equilíbrio simbiótico com o hospedeiro, com as bactérias nocivas a permanecerem em níveis clinicamente negligenciáveis. No entanto, as pressões ambientais externas conduzem facilmente à disbiose, que é a colonização da boca por microrganismos de diversidade e proporções anormais. Estas pressões ambientais são frequentemente fatores de risco totalmente modificáveis. Cada vez mais provas sugerem que não se trata apenas de uma atividade patológica local, mas sim de um perfil de risco que se estende a outras doenças crónicas importantes, num contexto de elevada prevalência global de doenças como a diabetes, a doença cardiovascular aterosclerótic e a artrite reumatoide.
Em condições normais, a microbiota oral forma uma comunidade diversificada e equilibrada que protege a boca contra as doenças. Mas os estilos de vida modernos podem facilmente perturbar este equilíbrio, tornando esta comunidade menos protetora e cada vez mais prejudicial.
Mecanismo
O calor e a humidade da boca e a sua morfologia proporcionam um habitat favorável à colonização e ao crescimento de uma grande variedade de bactérias. Ao nascer, as crianças adquirem uma microbiota oral simples e, com a idade, a dentição e a ajuda de fatores externos, esta comunidade torna-se cada vez mais complexa. Fatores ligados ao hospedeiro e aos microrganismos mantêm o equilíbrio homeostático da microbiota oral necessário para uma boa saúde.
Uma má higiene oral pode constituir uma pressão ecológica significativa que conduz à disbiose das complexas comunidades microbianas da boca [1].
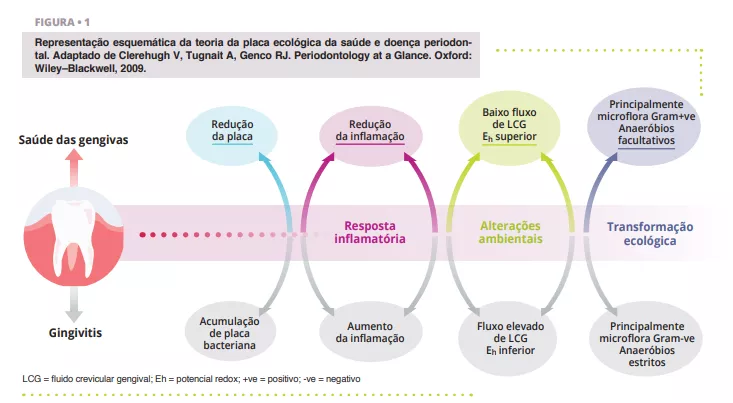
As transformações ecológicas que ocorrem num ecossistema disbiótico favorecem a colonização e a proliferação de bactérias orais patogénicas (Figura 1). Quando o número destas espécies aumenta, o risco de doença oral aumenta significativamente. A doença periodontal é um processo inflamatório crónico, não resolvido, que leva à destruição dos tecidos de suporte dos dentes, podendo resultar na perda dos mesmos se não for tratada. As atividades de rotina, como a mastigação, o uso do fio dental e a escovagem dos dentes, podem induzir bacteriemia, o que facilita a disseminação hematogénica de bactérias orais e mediadores inflamatórios, levando à inflamação sistémica em alguns doentes [2]. Os doentes com doença periodontal - a 6.ª doença mais comum nos seres humanos [3] - apresentam micro-ulcerações no epitélio sulcular e danos nos tecidos periodontais, e parecem ser mais suscetíveis à bacteriemia. Como resultado, o estado inflamatório induzido pela doença periodontal metastatiza para outras partes do corpo, em níveis que podem ser clinicamente significativos. Uma boa higiene oral é, portanto, essencial para controlar a carga bacteriana total na boca, manter ou restabelecer o equilíbrio simbiótico oral e prevenir a propagação de bactérias orais para outras partes do corpo.
As características da microbiota oral não se limitam a alterações patológicas na boca, mas podem influenciar o estado geral de saúde e, por vezes, esta influência pode ser medida tanto em termos positivos como negativos.
Diabetes
Des preuves robustes montrent un rôle bidirectionnel entre la santé buccale et la santé systémique, avec une relation « dose-dépendante » entre la sévérité de la parodontite et les complications du diabète.
A diabetes tipo II é uma doença metabólica caracterizada por uma produção insuficiente de insulina e a consequente incapacidade do organismo para metabolizar a glicose, resultando em níveis elevados de glicose no sangue (hiperglicemia crónica). A periodontite grave tem uma forte influência na hemoglobina glicosilada (HbA1c) e nos níveis de glucose no sangue em jejum, tanto em diabéticos como em não diabéticos [4]. A periodontite é, por conseguinte, reconhecida como a 6e complicação da diabetes, sendo o risco de periodontite multiplicado por 2 a 3 em pessoas com diabetes [5]. Em comparação com pessoas sem doença periodontal, os pacientes com periodontite grave têm um risco 19-33% maior de desenvolver diabetes [6].
19–33% Em comparação com pessoas sem doença periodontal, os pacientes com periodontite grave têm um risco maior de desenvolver diabetes [6].
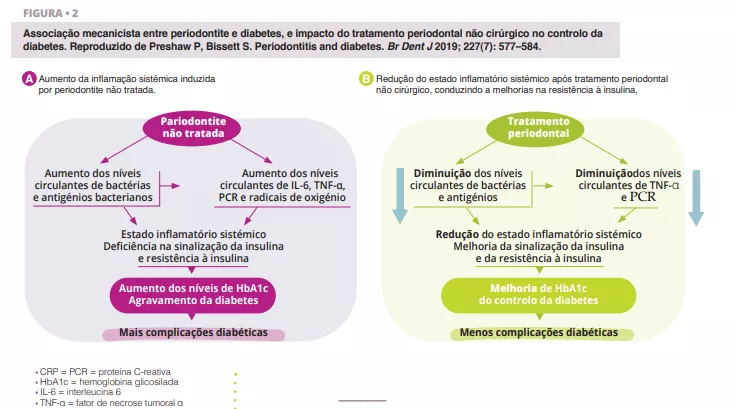
A periodontite grave não tratada está associada a níveis circulantes aumentados de bactérias e antigénios bacterianos, mediadores pró-inflamatórios e citocinas, e níveis aumentados de interleucina 6, fator de necrose tumoral alfa, proteína C-reativa e radicais livres de oxigénio. Este efeito combinado cria as condições para a inflamação sistémica, alterando a sinalização da insulina e a resistência à insulina [6]. Clinicamente, este fenómeno é reconhecido pelo aumento da HbA1c e pela progressão da diabetes, com um risco acrescido de complicações diabéticas. O tratamento periodontal reduz a carga bacteriana oral e, por conseguinte, diminui os níveis circulantes de mediadores inflamatórios, reduzindo assim o grau de inflamação sistémica (Figura 2). Como resultado, o tratamento dentário da periodontite pode alcançar melhorias clinicamente significativas no controlo glicémico, com os doentes diabéticos a registarem reduções na HbA1c de 0,3-0,4% até 4 meses após o tratamento.
Doenças cardiovasculares ateroscleróticas
A aterosclerose descreve uma acumulação de lípidos, colesterol e células sanguíneas que formam depósitos de placas endurecidas no interior das paredes arteriais, obstruindo o fluxo sanguíneo nos vasos e aumentando o risco de complicações cardiovasculares.
As bactérias orais são agentes infeciosos que contribuem para a patogénese da aterosclerose ao invadirem as células cardiovasculares do hospedeiro, nomeadamente as células endoteliais [7].
A doença periodontal crónica pode levar à disfunção endotelial através de um estado inflamatório sistémico elevado, que pode ser evidenciado por níveis aumentados de IL-6, fibrinogénio e produtos bacterianos periodontopáticos, tais como vesículas da membrana externa e gingipainas [8]. A patologia aterosclerótica parece ser largamente atribuída à Porphyromonas gingivalis. No entanto, Aggregatibacter actinomycetemcomitans, Prevotella intermedia, Tannerella forsythia e Fusobacterium nucleatum foram todas estudadas no âmbito desta associação. As principais implicações microbianas são a disfunção endotelial e a promoção da aterosclerose nas células cardiovasculares. A P. gingivalis tem a capacidade de se ligar às células endoteliais alvo, e fatores externos permitem-lhe entrar nas células, onde induz efeitos pró-coagulantes. Um estudo randomizado, controlado, ocultação simples e de grupos paralelos mostrou que, embora o tratamento periodontal intensivo tenha inicialmente levado a inflamação sistémica e disfunção endotelial, 6 meses após o tratamento houve melhorias na função endotelial, tanto clínica como bioquimicamente [9]. Este estudo apoia a teoria de que o controlo periodontal pode modular os processos cardiovasculares ateroscleróticos.
Artrite reumatoide
A artrite reumatoide é uma doença inflamatória crónica autoimune que afeta simetricamente o líquido sinovial das articulações e que, se não for tratada, pode alastrar a outros órgãos. A Porphyromonas gingivalis está implicada na fisiopatologia da artrite reumatoide, em que a bactéria produz enzimas com a capacidade de citrulinar proteínas, aumentando a probabilidade de redução da tolerância imunitária do hospedeiro e promovendo a libertação de autoanticorpos característicos desta doença [10]. Vários estudos têm demonstrado que a periodontite causada por biofilmes orais disbióticos pode desencadear artrite reumatoide com inflamação sistémica e aumento da erosão óssea. Foi sugerida uma relação bidirecional entre as duas doenças inflamatórias, mas são necessárias mais provas para testar esta hipótese [11]. Os clínicos envolvidos no tratamento reumatológico de doentes com artrite devem estar conscientes do papel da periodontite na eficácia das terapias biológicas modificadoras da doença, uma vez que a manutenção da inflamação sistémica pode afetar a resposta ao tratamento.
82% Dados transversais dos EUA mostraram um aumento de 82% na artrite reumatoide associada à periodontite, identificada por um aumento na perda de inserção periodontal [12]
Em doentes com biofilmes orais disbióticos, em que as proporções de bactérias periodontais capazes de citrulinar proteínas são superiores ao normal, seria prudente incluir no plano de gestão reumatológica um tratamento preventivo e curativo destinado a estabilizar a microbiota oral e a inflamação periodontal.
O tratamento periodontal não cirúrgico parece melhorar a expressão bioquímica da artrite reumatoide, mas o seu papel na melhoria dos resultados clínicos continua por esclarecer.
Prevenção
Os avanços científicos na compreensão da microbiota oral demonstram que este contribui para a saúde e bem-estar oral e geral. A teoria da placa ecológica é a hipótese atualmente aceite que envolve alterações microbiológicas dentro da boca, onde as transformações na ecologia da microbiota oral levam à desarmonia, resultando num aumento do número dos principais agentes patogénicos nocivos [13]. A disseminação das bactérias orais pelo corpo é significativamente reduzida através de um melhor controlo da carga microbiana oral. A remoção mecânica diária da placa bacteriana, utilizando uma técnica de escovagem e limpeza interdentária sistemática e completa, reduz o volume desta carga e impede a colonização de espécies patogénicas. Um bom controlo da placa bacteriana ajuda também a prevenir o risco de doença periodontal, caracterizada pela micro-ulceração da arquitetura gengival, produzindo canais para a fuga de bactérias e mediadores inflamatórios.
Com a intervenção profissional dos médicos dentistas (instruções de higiene oral, controlo dos fatores de risco e remoção mecânica da placa bacteriana), os processos de doença periodontal podem ser estabilizados ou mesmo revertidos se forem ligeiros.
Quando o equilíbrio microbiano foi perturbado por uma doença, o equilíbrio simbiótico da microbiota oral pode ser restaurado e estabilizado através de intervenções pessoais e profissionais relativamente simples.
Conclusão
As investigações sobre as associações entre alterações no microbiota oral e doenças crónicas sistémicas está em curso. Existem muitas razões plausíveis para a bidirecionalidade destas supostas ligações. A disbiose da microbiota oral, principal fator que contribui para o aparecimento e progressão de doenças locais e sistémicas, é mediada por fatores de risco totalmente modificáveis, o que reforça a importância da prevenção e a necessidade de os sistemas de saúde reorientarem a forma como prestam os cuidados de saúde, dando maior destaque aos cuidados orais preventivos.
1. Kilian M, Chapple IL, Hannig M, et al.. The oral microbiome - an update for oral healthcare professionals. Br Dent J 2016; 221: 657–66.
2. Patel J, Sampson V. The role of oral bacteria in COVID-19. Lancet Microbe 2020; 1: e105.
3. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 2020; 396: 1204–22.
4. Preshaw PM, Alba AL, Herrera D, et al. Periodontitis and diabetes: a two-way relationship. Diabetologia 2012; 55: 21–31.
5. Teeuw WJ, Kosho MX, Poland DC, Gerdes VE, Loos BG. Periodontitis as a possible early sign of diabetes mellitus. BMJ Open Diabetes Res Care 2017; 5: e000326.
6. Preshaw P, Bissett S. Periodontitis and diabetes. Br Dent J 2019; 227: 577–84.
7. Tonetti MS, Van Dyke TE; working group 1 of the joint EFP/AAP workshop. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Periodontol 2013; 84(Suppl 4): S24–S29.
8. Reyes L, Herrera D, Kozarov E, Roldán S, Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J Clin Periodontol 2013; 40 (Suppl 14): S30-S50.
9. Tonetti MS, D’Aiuto F, Nibali L, et al. Treatment of periodontitis and endothelial function. N Engl J Med 2007; 356: 911–20.
10. Quirke AM, Lugli EB, Wegner N, et al. Heightened immune response to autocitrullinated Porphyromonas gingivalis peptidylarginine deiminase: a potential mechanism for breaching immunologic tolerance in rheumatoid arthritis. Ann Rheum Dis 2014; 73: 263–9.
11. González-Febles J, Sanz M. Periodontitis and rheumatoid arthritis: What have we learned about their connection and their treatment? Periodontol 2000 2021; 87: 181–203.
12. de Pablo P, Dietrich T, McAlindon TE. Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population. J Rheumatol 2008; 35: 70–6.
13. Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res 1994; 8: 263–71.

