Microbioma intestinal y procesos neurodegenerativ
Síntesis
Por el Pr. John F. Cryan
Departamento de anatomía y Neurociencias, University College Cork, en Cork, Irlanda
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Autor
Durante los últimos diez años, la investigación acerca del rol de la microbiota intestinal en la modulación del estado de salud y de las enfermedades cerebrales ha tenido una gran expansión. Si bien la mayoría de los trabajos se han referido a los trastornos asociados al estrés, tales como la ansiedad, la depresión y el síndrome del intestino irritable, cada vez más estudios, en su mayoría preclínicos, también incorporan a la microbiota como moderadora en las enfermedades neurodegenerativas como, por ejemplo, las enfermedades de Alzheimer y Parkinson. En paralelo, las investigaciones han demostrado que el microbioma desempeña un rol esencial en los principales procesos cerebrales implicados en el desarrollo neurológico, la neuroinflamación y el envejecimiento. En la actualidad, las investigaciones se orientan claramente hacia una mejor comprensión de los mecanismos exactos que permiten que el intestino se comunique con el cerebro y de ocasionar un aumento de la susceptibilidad a los trastornos neurológicos.
En medicina, la neurología y la microbiología han evolucionado ampliamente siguiendo trayectorias paralelas distintas, que se han cruzado únicamente en situaciones patológicas, como por ejemplo en infecciones directas del sistema nervioso central. Sin embargo, durante la última década, el descubrimiento de que la microbiota intestinal (los trillones de bacterias presentes en el intestino) cumple un rol clave en el mantenimiento de la homeostasis y en la programación de los principales sistemas corporales, incluyendo al cerebro, ha representado una revolución en biomedicina.
Cada vez más investigaciones se concentran en la comprensión de las vías de comunicación bidireccional entre las bacterias intestinales y el sistema nervioso central, el eje microbiota-intestino-cerebro; no obstante, este ámbito de investigación está apenas en desarrollo [1]. Las modificaciones del microbioma, de sus metabolitos y de su interacción con el eje intestino- cerebro están asociadas a un amplio abanico de enfermedades, que incluyen trastornos neurológicos. El estudio del microbioma requiere una estrecha colaboración entre clínicos, investigadores fundamentales y bioinformáticos, y funciona mejor cuando se levantan las barreras que hay entre disciplinas tradicionales como son la neurología, la gastroenterología y la microbiología.
En la investigación preclínica, una cierta cantidad de modelos experimentales han demostrado ser esenciales para evaluar el efecto del microbioma en el cerebro y el comportamiento, y estos modelos incluyen el uso de prebi ticos y probióticos, la administración de antibióticos, el trasplante fecal y el uso de animales desprovistos de gérmenes y gnotobióticos [1]. En la investigación clínica, la mayoría de los datos, en particular en el ámbito de la neurología, se basan en estudios transversales del microbioma de pacientes, en comparación con individuos sanos de la misma edad.
El eje microbiota intestino- cerebro: mecanismos de comunicación
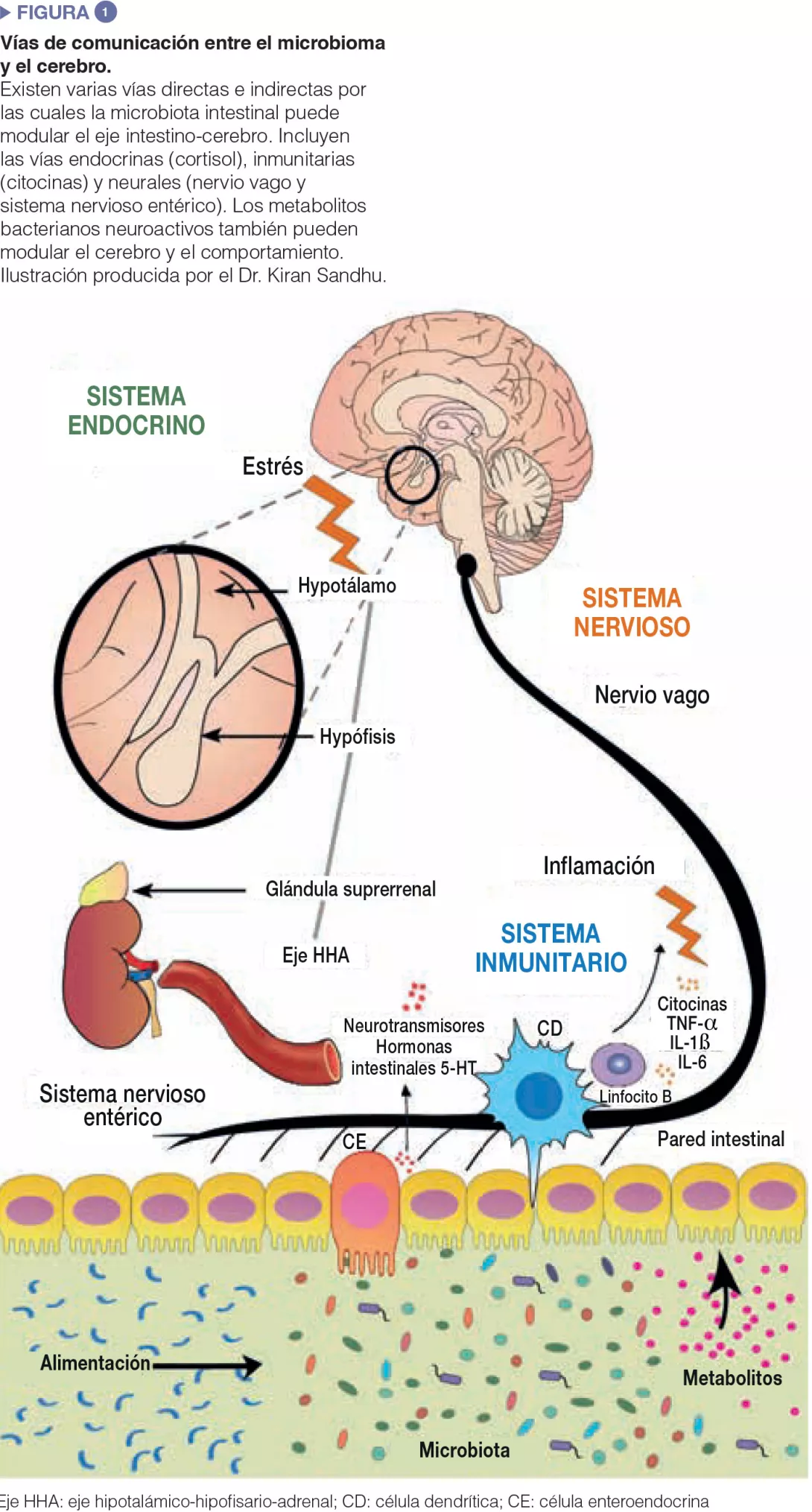
Se han invertido importantes esfuerzos experimentales para intentar comprender en detalle las vías de comunicación entre el intestino y el cerebro. Las bacterias intestinales influyen en los procesos centrales a través de diversos mecanismos (Figura 1). En primer lugar, la capacidad de la microbiota para sintetizar neurotransmisores (el ácido γ-aminobutírico [GABA], la noradrenalina y la dopamina) es una vía de comunicación importante. En segundo lugar, los microbios tienen una importancia trascendental en la activación del sistema inmunitario que puede desempeñar un rol fundamental en el envejecimiento, los trastornos neurológicos y los procesos neurodegenerativos. Finalmente, los microbios producen metabolitos, en especial, ácidos grasos de cadena corta (AGCC), que son esenciales para el intestino, el sistema inmunitario y, potencialmente, para el estado de salud del cerebro. Además, la microbiota intestinal y el cerebro están vinculados por el nervio vago y por la modulación de los principales aminoácidos alimentarios, tales como el triptófano.
Dada la estrecha asociación entre la microbiota intestinal y el cerebro, no es llamativo que las bacterias intestinales tengan un rol esencial en las enfermedades neurológicas y psiquiátricas. Los datos más concluyentes que confirman un rol del microbioma en la función cerebral provienen de ratones desprovistos de gérmenes. Los estudios dirigidos por un cierto número de grupos de investigación en Canadá, Suecia e Irlanda han demostrado que, en los animales desprovistos de gérmenes, el cerebro no se desarrolla normalmente ante la ausencia de microbioma intestinal [2]. Además, también se ha demostrado que procesos cerebrales fundamentales, tales como la mielinización, la neurogénesis en el adulto y la activación de las células de microglía, dependen fuertemente de la composición de la microbiota.
Microbiota y envejecimiento
La relación entre el microbioma y el envejecimiento del cerebro también suscita mucha atención, lo cual presenta un interés particular en el ámbito de la neurología, dado que numerosos trastornos neurológicos y neurodegenerativos se presentan a una edad avanzada. Una vez más, la idea de vincular el microbioma al envejecimiento saludable no es una novedad; la sostuvo hace más de 100 años un inmunólogo que recibió un premio Nobel: Elie Metchnikoff. Este último observó que los habitantes de una región de Bulgaria tenían una vida excepcionalmente larga, hecho que atribuyó a la presencia de bacterias que producían ácido láctico en su alimentación. Recientemente hemos analizado otra vez el estudio inicial desarrollado por Metchnikoff [3] y hemos visto que los trastornos del comportamiento en animales ancianos coincidían con modificaciones del microbioma. Además, el estudio ELDERMET ha mostrado que la composición de las bacterias intestinales en las personas de edad avanzada estaba correlacionada con su estado de salud general, su fragilidad y su sistema inmunitario [4]. Un microbioma rico es signo de una mejor salud. Estos investigadores fueron más allá para estudiar lo que llevaba a tener un microbioma de estas características y demostraron que se trataba de una alimentación variada. Cuando la gente come alimentos insípidos procesados (lo que suele suceder en residencias para personas mayores), la diversidad de sus microbiomas se reduce, mientras que los que tienen una alimentación rica en frutas y verduras tienen mejores resultados [4].
Una disminución de la diversidad microbiana se asocia con un aumento concomitante de la activación de la microglía que se correlaciona con diferencias de masa cerebral en el ratón. Esto contribuye a una respuesta inflamatoria asociada a la edad denominada “inflammaging”, que a su vez fue asociada a enfermedades neurodegenerativas tales como la enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP). Por otra parte, se ha demostrado que el microbioma regula la activación de la microglía; pero también que cerebros de ratones desprovistos de gérmenes presentaban una microglía defectuosa, que se restableció parcialmente tras el restablecimiento de la comunidad microbiana a niveles de control [5].
Enfermedad de parkinson (EP)
On est en train de se rendre compte que la MP pourrait en fait provenir de l’intestin [6]. En effet, l’α-synucléine, l’agrégat de protéines caractéristique de la MP dans le cerveau, a également été identifiée dans les fibres nerveuses de la sous-muqueuse et de la muqueuse et dans les ganglions de patients parkinsoniens. Des données précliniques suggèrent même que l’α-synucléine présente dans l’intestin peut être transportée au cerveau par le nerf vague. En outre, des symptômes intestinaux fonctionnels tels que la constipation sont souvent des symptômes prodromiques se produisant des années avant l’apparition des symptômes moteurs.
Estamos en proceso de darnos cuenta de que en realidad la EP podría provenir del intestino [6]. En efecto, la α-sinucleína, el agregado de proteínas característico de la EP en el cerebro, también ha sido identificado en las fibras nerviosas de la submucosa y de la mucosa y en los ganglios de los pacientes con Parkinson. Datos preclínicos incluso sugieren que la α-sinucleína presente en el intestino puede ser transportada al cerebro por el nervio vago. Además, síntomas intestinales funcionales tales como la constipación a menudo son síntomas prodrómicos que se producen años antes de la aparición de los síntomas motores.
Desde que Scheperjans et al. demostraron por primera vez que existían alteraciones específicas en la composición del microbioma en la EP [7], muchos otros estudios se llevaron a cabo [8]. Sin embargo, a la fecha, no hay consenso acerca de la existencia de una firma microbiana específica. Cuando se colonizaron ratones con microbiota de pacientes afectados por EP vía trasplante de microbiota fecal, desarrollaron deficiencias motoras y una neuroinflamación, dos síntomas característicos de la EP [9]. Además, los síntomas mejoraron cuando los ratones fueron tratados con antibióticos. Estos estudios implicaron ácidos grasos de cadena corta para activar los procesos neuroinflamatorios en la EP [9].
El nervio vago está particularmente bien ubicado para conducir señales provenientes del intestino hacia el cerebro, ya sean de origen bacteriano, o vía traslocación, similar a la del prion, de la α-sinucleína. En efecto, estudios epidemiológicos basados en registros de pacientes daneses y suecos, han demostrado que una vagotomía troncular protege de la EP. A pesar de unas grandes expectativas en este ámbito, se debe ser prudente al analizar los datos disponibles, dado que provienen en gran medida de grupos pequeños y no tienen perspectiva longitudinal. Aun se necesitan muchos otros estudios mecanísticos para comprender cómo las modificaciones de la microbiota pueden moderar los síntomas motores y no motores de la EP y de sus comorbilidades [10].
Enfermedad de alzheimer (EA)
El concepto según el cual los microbios pueden desempeñar un rol en la fisiopatología de la EA no es novedoso y la idea de que la amiloide, cuya agregación es una de las principales características de la EA, podría actuar como un péptido antimicrobiano en el cerebro es un concepto fascinante [11]. Sin embargo, según el postulado de Koch, es difícil de probar éticamente si existe una causa infecciosa de neuroinflamación y de neurodegeneración. Al igual que en la EP, la relación entre las proteínas intestinales y el estado de salud del cerebro es objeto de atención particular. Se ha descubierto que proteínas de tipo amiloide, producidas por bacterias, podrían aumentar las enfermedades asociadas a la α-sinucleína [12]. Otros trabajos son necesarios para validar estas estrategias en el hombre.
Recientemente, estudios transversales han identificado que los taxones bacterianos de Escherichia/Shigella, que están asociados a la mediación de la inflamación, habían aumentado en las muestras de heces de pacientes con EA en comparación con los individuos de control. Además, las modificaciones de la microbiota estaban correlacionadas con los niveles de citocinas proinflamatorias en sangre [13]. Estos resultados sugieren una relación causal entre la disbiosis de la microbiota intestinal y la inflamación sistémica, que puede iniciar o exacerbar el proceso neurodegenerativo cerebral en la EA. No obstante, estos estudios todavía son relativamente modestos y se necesitan muchas otras investigaciones en poblaciones de gran tamaño para evaluar la relación causal entre el microbioma intestinal y la EA.
En paralelo, se ha demostrado que un cierto número de modelos de EA en ratones transgénicos presentaba un microbioma alterado [14]. Estudios pioneros realizados en ratones desprovistos de gérmenes han evidenciado una ausencia pronunciada de acumulación de placas amiloides y de neuroinflamación [14]. Igualmente, el tratamiento crónico de los ratones transgénicos APP/PS1 con un cóctel de antibióticos reducía la acumulación de microglía y de astrocitos que rodean las placas amiloides en el hipocampo y provocaba una disminución de las placas amiloides insolubles [15]. Todos estos estudios muestran claramente que el microbioma regula los componentes moleculares clave de EA.
Perspectivas de futuro
Está claro que el microbioma es de crucial importancia para el desarrollo y el mantenimiento apropiados de la función cerebral. Por otra parte, como se indica más arriba, numerosos datos derivados de estudios preclínicos y clínicos implican al microbioma en un espectro de enfermedades neurológicas y neurodegenerativas. Teniendo en cuenta los efectos pronunciados de la microbiota en la regulación de la función cerebral, es plausible que su composición afecte la progresión, la susceptibilidad y el tratamiento de casi todos los trastornos neurológicos. No obstante, nuestros conocimientos acerca del rol del microbioma en otras enfermedades neurodegenerativas tales como la esclerosis lateral amiotrófica o la enfermedad de Huntington presentan lagunas importantes, y se debe ser prudente para no sobreinterpretar estos estudios. El ámbito de investigación debe alejarse de los estudios correlativos para adoptar enfoques causales mecanísticos. Además, se necesitan más estudios de intervención que utilicen ratones probióticos y prebióticos; los trasplantes de microbiota fecal incluso podrían ser importantes en este ámbito. Es posible que enfoques similares puedan dirigirse a trastornos diferentes; por ejemplo, la modulación de la señalización de los linfocitos T en el cerebro puede ser útil para atenuar el estado neuroinflamatorio en los pacientes luego de un accidente cerebrovascular, así como en los pacientes con EA y durante el envejecimiento.
En lo que respecta a la neurología clínica, muchos pacientes son polimedicados y la relación entre el microbioma y la acción de los medicamentos se comprende cada vez mejor. En consecuencia, todos los estudios deberían apuntar a marcar la diferencia entre el impacto de los medicamentos y el de la enfermedad sobre el microbioma. Además, será importante realizar estudios temporales en individuos presintomáticos para determinar el rol potencial del microbioma como biomarcador de la enfermedad.
Conclusión
Es posible que la alimentación sea uno de los factores más importantes con influencia en el microbioma. Como numerosos trastornos neurológicos afectan el apetito, la deglución y la alimentación en general, es esencial tener datos nutricionales de buena calidad para todos los estudios que se desarrollen en el hombre a futuro. Además, esto permitirá comprender mejor la relación entre la alimentación, el microbioma y el cerebro, que es esencial desde el inicio de la vida y a medida que envejecemos.






