Microbiome intestinal et neurodégénérescence
Synthèse
Par le Pr. John F. Cryan
Département d’anatomie et de Neurosciences, University College Cork, Cork, Irlande
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Auteur
Au cours des dix dernières années, la recherche portant sur le rôle du microbiote intestinal dans la modulation de l’état de santé et des maladies du cerveau a connu un grand engouement. Bien que la plupart des travaux aient porté sur les troubles liés au stress tels que l’anxiété, la dépression et le syndrome de l’intestin irritable, de plus en plus d’études, en grande partie précliniques, impliquent également le microbiote en tant que modérateur dans les maladies neurodégénératives telles que la maladie d’Alzheimer et la maladie de Parkinson. En parallèle, les recherches ont montré que le microbiome joue un rôle essentiel dans les principaux processus cérébraux impliqués dans le développement neurologique, la neuro-inflammation et le vieillissement. Actuellement, elles sont fortement orientées vers une meilleure compréhension des mécanismes précis qui permettent à l’intestin de communiquer avec le cerveau et d’entraîner une augmentation de la susceptibilité aux troubles neurologiques.
En médecine, la neurologie et la microbiologie ont largement évolué en suivant des trajectoires parallèles distinctes, ne se croisant que dans des situations pathologiques, lors d’infections directes du système nerveux central. Cependant, au cours de la dernière décennie, la découverte du fait que le microbiote intestinal (les trillions de bactéries présentes dans l’intestin) joue un rôle clé dans le maintien de l’homéostasie et dans la programmation des principaux systèmes corporels, y compris le cerveau, a constitué une révolution en biomédecine.
De plus en plus de recherches se concentrent sur la compréhension des voies de communication bidirectionnelle entre les bactéries intestinales et le système nerveux central, l’axe microbiote-intestin-cerveau ; cependant, ce domaine n’en est qu’à ses balbutiements [1]. Des modifications du microbiome, de ses métabolites et de son interaction avec l’axe intestin-cerveau sont associées à un large éventail de maladies, y compris à des troubles neurologiques. L’étude du microbiome nécessite des efforts de collaboration étroite entre cliniciens, chercheurs fondamentaux et bio-informaticiens et fonctionne mieux lorsque les barrières des disciplines traditionnelles entre la neurologie, la gastro-entérologie et la microbiologie sont levées.
Dans la recherche préclinique, un certain nombre de modèles expérimentaux se sont révélés essentiels pour évaluer l’effet du microbiome sur le cerveau et le comportement, et ces modèles incluaient l’usage de prébiotiques et probiotiques, l’administration d’antibiotiques, la transplantation fécale et l’utilisation d’animaux dépourvus de germes et gnotobiotiques [1]. Dans la recherche clinique, la plupart des données, en particulier dans le domaine de la neurologie, reposent sur des études transversales du microbiome chez des patients par rapport à des individus sains du même âge.
L’axe microbiote intestin- cerveau : mécanismes de communication
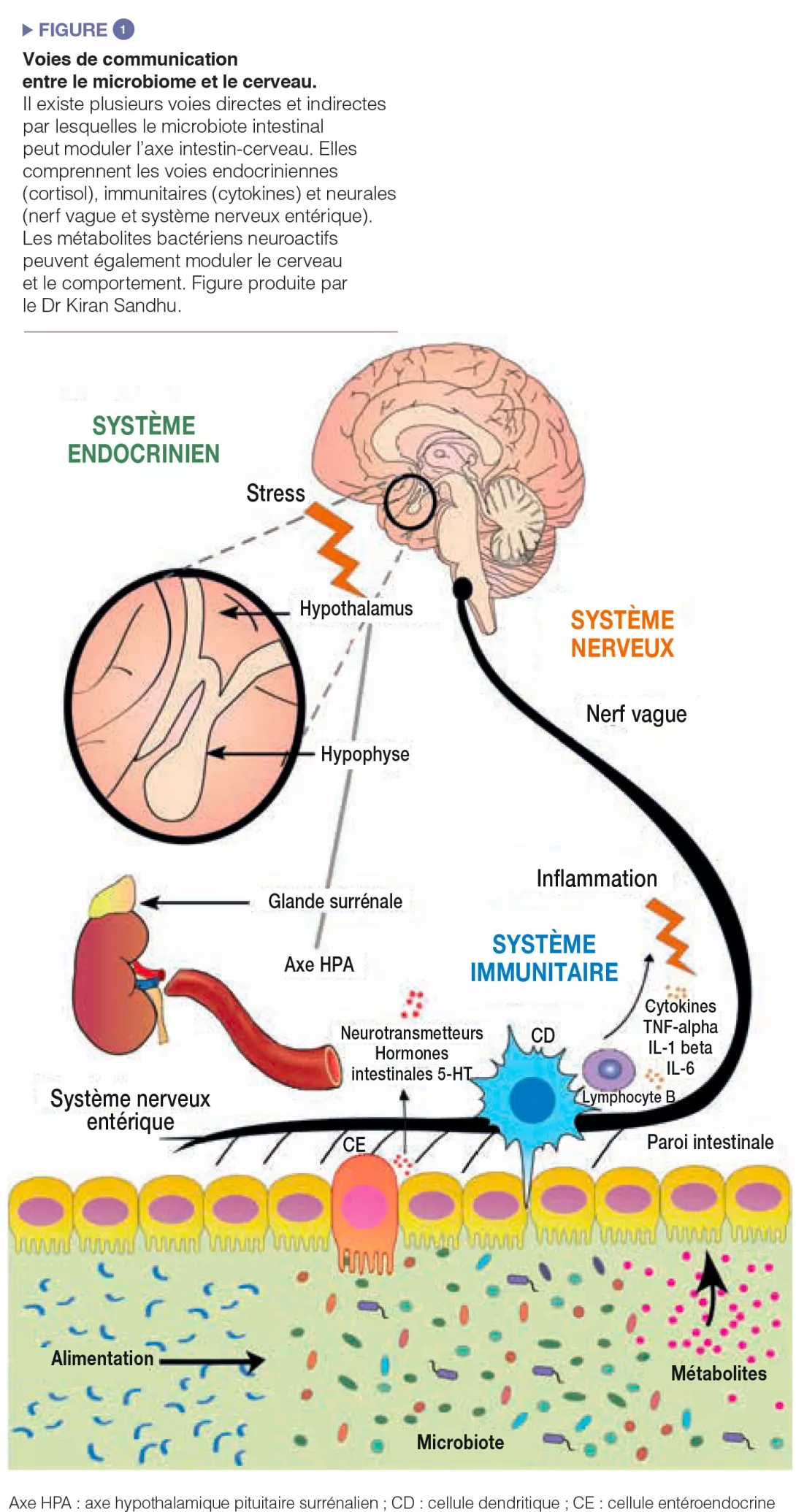
D’importants efforts expérimentaux sont déployés pour essayer de comprendre finement les voies de communication entre l’intestin et le cerveau. Les bactéries intestinales influencent les processus centraux via divers mécanismes (Figure 1). Premièrement, la capacité du microbiote à synthétiser des neurotransmetteurs (i.e.l’acide γ-aminobutyrique [GABA], la noradrénaline et la dopamine) est une voie de communication importante. Deuxièmement, les microbes ont une importance capitale dans l’activation du système immunitaire qui peut jouer un rôle fondamental dans le vieillissement, les troubles neurologiques et la neurodégénérescence. Enfin, les microbes produisent des métabolites, notamment des acides gras à chaîne courte (AGCC), qui sont essentiels à l’intestin, au système immunitaire et, potentiellement, à l’état de santé du cerveau. De plus, le microbiote intestinal et le cerveau sont liés par le nerf vague et par la modulation des principaux acides aminés alimentaires tels que le tryptophane.
Étant donné l’étroite association entre le microbiote intestinal et le cerveau, il n’est pas étonnant que les bactéries intestinales aient un rôle essentiel dans les maladies neurologiques et psychiatriques. Les données les plus probantes confirmant un rôle du microbiome dans la fonction cérébrale proviennent de souris dépourvues de germes. Les études menées par un certain nombre de groupes de recherche au Canada, en Suède et en Irlande ont montré que, chez les animaux dépourvus de germes, le cerveau ne se développe pas normalement en l’absence de microbiome intestinal [2]. En outre, il a également été montré que des processus cérébraux fondamentaux tels que la myélinisation, la neurogenèse chez l’adulte et l’activation de la microglie dépendent fortement de la composition du microbiote.
Microbiote et vieillissement
La relation entre le microbiome et le vieillissement du cerveau suscite également beaucoup d’attention, ce qui présente un intérêt particulier dans le domaine de la neurologie car de nombreux troubles neurologiques et neurodégénératifs surviennent à un âge avancé. Une fois de plus, l’idée de relier le microbiome au vieillissement sain n’est pas nouvelle ; elle a été soutenue il y a plus de 100 ans par un immunologiste ayant reçu un prix Nobel, Elie Metchnikoff. Celui-ci a observé que les villageois vivant dans une région de la Bulgarie avaient une vie exceptionnellement longue, un fait qu’il a attribué à la présence de bactéries produisant de l’acide lactique dans leur alimentation. Nous avons récemment revisité l’étude initiale menée par Metchnikoff [3] et montré que les déficits comportementaux chez les animaux âgés coïncident avec des modifications du microbiome. De plus, l’étude ELDERMET a montré que la composition des bactéries intestinales chez les personnes âgées était corrélée avec leur état de santé général, leur fragilité et avec leur système immunitaire [4]. Un microbiome riche est le signe d’une meilleure santé. Ces investigateurs sont allés encore plus loin pour étudier ce qui induit un tel microbiome et ils ont montré qu’il s’agissait d’une alimentation variée. Lorsque les gens mangent des aliments fades transformés (souvent dans des maisons de retraite), la diversité de leurs microbiomes est réduite, tandis que ceux ayant une alimentation riche en fruits et en légumes ont de meilleurs résultats [4].
Une diminution de la diversité microbienne est associée à une augmentation concomitante de l’activation microgliale qui est corrélée avec des différences de masse cérébrale chez la souris. Cela contribue à une réponse inflammatoire associée à l’âge appelée “inflammaging”, qui à son tour a été associée à des maladies neurodégénératives telles que la maladie d’Alzheimer (MA) et la maladie de Parkinson (MP). Par ailleurs, il a été montré que le microbiome régule l’activation de la microglie ; mais également que des cerveaux de souris dépourvues de germes exprimaient une microglie défectueuse, partiellement rétablie après restauration de la communauté microbienne à des taux contrôles [5].
Maladie de parkinson (MP)
On est en train de se rendre compte que la MP pourrait en fait provenir de l’intestin [6]. En effet, l’α-synucléine, l’agrégat de protéines caractéristique de la MP dans le cerveau, a également été identifiée dans les fibres nerveuses de la sous-muqueuse et de la muqueuse et dans les ganglions de patients parkinsoniens. Des données précliniques suggèrent même que l’α-synucléine présente dans l’intestin peut être transportée au cerveau par le nerf vague. En outre, des symptômes intestinaux fonctionnels tels que la constipation sont souvent des symptômes prodromiques se produisant des années avant l’apparition des symptômes moteurs.
Depuis que Scheperjans et al. ont montré pour la première fois qu’il existait des altérations spécifiques de la composition du microbiome dans la MP [7], bien d’autres études ont été menées [8]. Cependant, à ce jour, il n’y a pas de consensus concernant l’existence d’une signature microbienne spécifique. Lorsque des souris ont été colonisées par le microbiote de patients atteints de la MP via une transplantation de microbiote fécal, elles ont développé des déficits moteurs et une neuro-inflammation, deux symptômes caractéristiques de la MP [9]. De plus, les symptômes se sont améliorés lorsque les souris ont été traitées par des antibiotiques. Ces études ont impliqué des acides gras à chaîne courte pour activer les processus neuro-inflammatoires dans la MP [9].
Le nerf vague est particulièrement bien placé pour conduire des signaux provenant de l’intestin vers le cerveau, soit d’origine bactérienne, soit via une translocation, similaire à celle du prion, de l’α-synucléine. En effet, des études épidémiologiques basées sur des registres de patients danois et suédois ont montré qu’une vagotomie tronculaire protège de la MP. Malgré un fort enthousiasme dans ce domaine, la prudence reste de mise lors de l’examen des données disponibles car elles sont en grande partie issues de petites cohortes et elles n’ont pas de perspective longitudinale. De nombreuses autres études mécanistiques sont nécessaires pour comprendre comment les modifications du microbiote peuvent modérer les symptômes moteurs et non moteurs de la MP et de ses comorbidités [10].
Maladie d’alzheimer (MA)
Le concept selon lequel les microbes peuvent jouer un rôle dans la physiopathologie de la MA n’est pas nouveau et l’idée que l’amyloïde, dont l’agrégation est une des principales caractéristiques de la MA, pourrait agir comme peptide antimicrobien dans le cerveau est un concept fascinant [11]. Cependant, selon le postulat de Koch, il est éthiquement difficile de prouver s’il existe une cause infectieuse de neuro-inflammation et de neurodégénérescence. Comme dans la MP, la relation entre les protéines intestinales et l’état de santé du cerveau fait l’objet d’une attention particulière. Il a été découvert que des protéines de type amyloïde produites par des bactéries pourraient augmenter les maladies associées à l’α-synucléine [12]. D’autres travaux sont nécessaires pour valider ces stratégies chez l’homme.
Récemment, des études transversales ont identifié que les taxons bactériens d’Escherichia/Shigella, qui sont associés à la médiation de l’inflammation, étaient augmentés dans les échantillons de selles de patients atteints de la MA par rapport aux sujets contrôles. En outre, les modifications du microbiote étaient corrélées avec les taux de cytokines pro-inflammatoires dans le sang [13]. Ces résultats suggèrent une relation causale entre la dysbiose du microbiote intestinal et l’inflammation systémique, qui peut initier ou exacerber la neurodégénérescence cérébrale dans la MA. Cependant, ces études sont encore relativement modestes et beaucoup d’autres recherches sont nécessaires sur de grandes cohortes pour évaluer la relation causale entre le microbiome intestinal et la MA.
En parallèle, il a été montré qu’un certain nombre de modèles de MA chez des souris transgéniques présentaient un microbiome altéré [14]. Des études pionnières menées chez des souris dépourvues de germes ont mis en évidence une absence marquée d’accumulation de plaques amyloïdes et de neuro-inflammation [14]. De même, le traitement chronique des souris transgéniques APP/PS1 par un cocktail d’antibiotiques réduisait l’accumulation de microglie et d’astrocytes entourant les plaques amyloïdes dans l’hippocampe et entraînait une diminution des plaques amyloïdes insolubles [15]. Toutes ces études montrent clairement que le microbiome régule les composants moléculaires clés de la MA.
Perspectives d’avenir
Il est clair que le microbiome est d’une importance cruciale pour le développement et le maintien appropriés de la fonction cérébrale. Par ailleurs, comme indiqué ci-dessus, de nombreuses données issues d’études précliniques et cliniques impliquent le microbiome dans un spectre de maladies neurologiques et neurodégénératives. Compte tenu des effets marqués du microbiote dans la régulation de la fonction cérébrale, il est plausible que sa composition affecte la progression, la susceptibilité et le traitement de presque tous les troubles neurologiques. Néanmoins, nos connaissances concernant le rôle du microbiome dans d’autres maladies neurodégénératives telles que la sclérose latérale amyotrophique ou la maladie de Huntington présentent des lacunes importantes, et il faut rester prudent afin de ne pas surinterpréter ces études. Le domaine doit s’éloigner des études corrélatives pour adopter des approches causales mécanistiques. De plus, davantage d’études interventionnelles utilisant des souches probiotiques et des prébiotiques sont nécessaires ; les transplantations de microbiote fécal pourraient même être importantes dans ce domaine. Il est possible que des approches similaires puissent cibler des troubles différents ; par exemple, la modulation de la signalisation des lymphocytes T dans le cerveau peut être utile pour atténuer l’état neuro- inflammatoire chez les patients après un accident vasculaire cérébral, de même que chez les patients atteints de la MA et au cours du vieillissement.
En ce qui concerne la neurologie clinique, de nombreux patients sont polymédicamentés et la relation entre le microbiome et l’action des médicaments est de mieux en mieux comprise. Ainsi, toutes les études devraient viser à faire la différence entre l’impact des médicaments et celui de la maladie sur le microbiome. En outre, des études temporelles menées chez des individus présymptomatiques seront importantes pour déterminer le rôle potentiel du microbiome en tant que biomarqueur de la maladie.
Conclusion
L’alimentation est peut-être l’un des plus importants facteurs influençant le microbiome. Comme de nombreux troubles neurologiques affectent l’appétit, la déglutition et l’alimentation en général, il est essentiel d’avoir des données nutritionnelles de bonne qualité pour toutes les études menées chez l’homme à l’avenir. Par ailleurs, cela permettra de mieux comprendre la relation entre l’alimentation, le microbiome et le cerveau, qui est essentielle dès le début de la vie et à mesure que nous vieillissons.






