Le tréhalose alimentaire augmente la virulence du Clostridium difficile épidémique
Article commenté - rubrique adulte
Par le Pr. Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Commentaire de l’article original de Collins et al. (Nature 2018)
L’incidence de l’infection à Clostridium difficile a récemment augmenté. Cette bactérie est devenue un pathogène nosocomial dominant en Amérique du Nord et en Europe, bien que l’on sache peu de choses sur ce qui a conduit à cette émergence. Ici, les auteurs montrent que deux ribotypes épidémiques (RT027 et RT078) ont acquis des mécanismes uniques pour métaboliser de faibles concentrations du disaccharide tréhalose qui est utilisé comme additif alimentaire. Le ribotype 027 (RT027) contient une seule mutation ponctuelle dans le répresseur transcriptionnel* du tréhalose qui augmente sa sensibilité à la substance de plus de 500 fois. En outre, le tréhalose alimentaire augmente la virulence des souches RT027 dans un modèle murin d’infection à Clostridium difficile. Le ribotype 078 (RT078) a acquis un groupe de 4 gènes impliqués dans le métabolisme du tréhalose. Parmi eux, une perméase de type PTS (phosphotransférase) est à la fois nécessaire et suffisante pour la croissance des souches, même à de faibles concentrations de tréhalose. Les auteurs proposent que la mise en oeuvre du tréhalose comme additif alimentaire dans l’alimentation humaine, peu de temps avant l’émergence de ces deux ribotypes épidémiques, a participé à leur émergence et contribue à leur hypervirulence [1].
Que sait-on déjà à ce sujet ?
L’analyse par séquençage du génome entier de souches de C. difficile ribotype 027 (RT027) a démontré que deux lignées indépendantes ont émergé en Amérique du Nord entre 2000 et 2003 [2]. La comparaison avec des souches RT027 historiques pré-épidémiques a montré que les lignées épidémiques ont acquis une mutation dans le gène gyrA, qui a conduit à une résistance accrue aux antibiotiques du groupe des fluoroquinolones. Alors que le développement de cette résistance a certainement joué un rôle dans la propagation des souches RT027, elle a également été observée dans des ribotypes de C. difficile non épidémiques et identifiées dans des souches datant du milieu des années 1980. Ainsi, d’autres facteurs ont probablement contribué à l’émergence de souches épidémiques RT027. La prévalence d’un deuxième ribotype de C. difficile, RT078, a été décuplée dans les hôpitaux et les cliniques entre 1995 et 2007 et a été associée à une sévérité accrue [3]. Cependant, les mécanismes impliqués dans l’augmentation de la virulence restent inconnus. Les lignées RT027 et RT078 étant phylogénétiquement éloignées l’une de l’autre, il est possible que les changements qui ont conduit de manière simultanée à une augmentation de la prévalence et de la gravité de l’infection puissent provenir de mécanismes indépendants.
Quels sont les principaux résultats apportés par cette étude ?
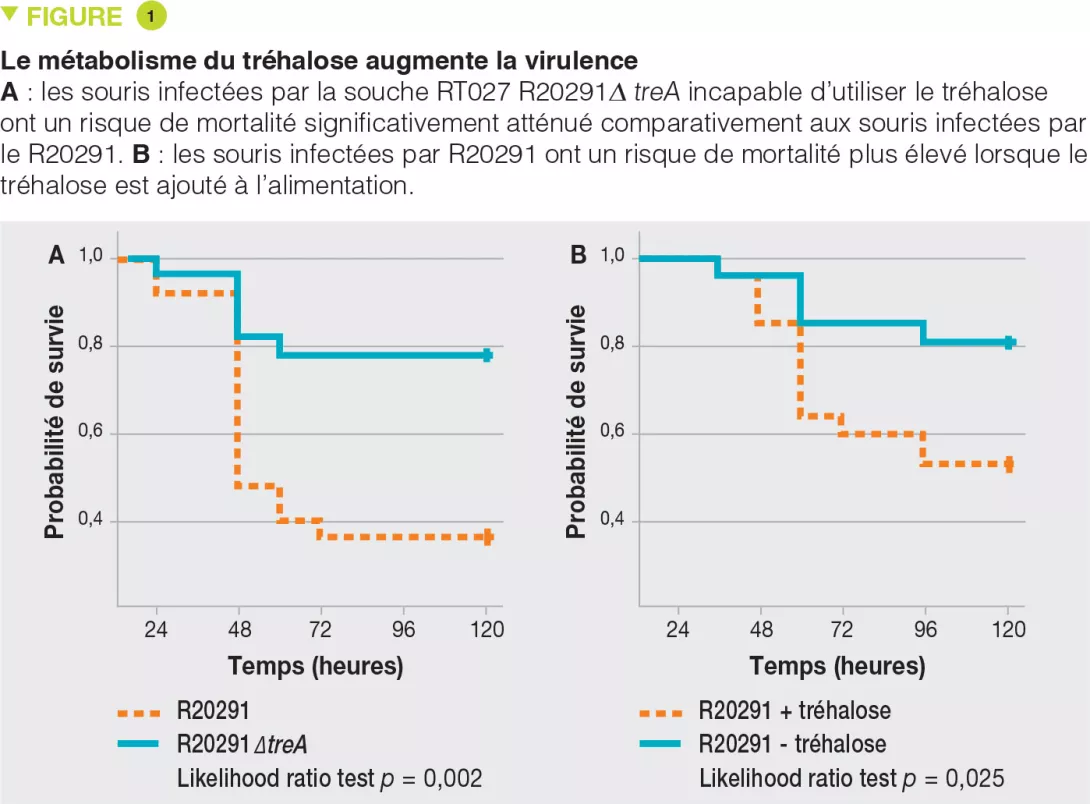
Il a été montré que les souches du ribotype RT027 ont un avantage compétitif comparé aux autres souches in vitro et dans des modèles murins d’infection à C. difficile. Pour investiguer les mécanismes impliqués, les auteurs ont examiné l’utilisation de différentes sources de carbones par les différentes souches et ont mis en évidence une capacité accrue à utiliser le disaccharide tréhalose par les souches du ribotype RT027. En comparant les génomes de nombreuses souches de C. difficile, les auteurs ont identifié une potentielle enzyme phosphotrehalase (TreA) qui métabolise le trehalose-6-phosphate en glucose et glucose-6-phosphate. Les auteurs ont ensuite observé que les souches du ribotype RT027 activaient ce gène à une concentration 500 fois plus faible de tréhalose que les autres souches de C. difficile. Des analyses plus fines ont permis d’identifier un polymorphisme dans le répresseur transcriptionnel (TreR) de TreA dans toutes les souches du ribotype RT027 et dans d’autres souches proches à l’origine d’épidémies en Europe et en Australie. Pour évaluer si la capacité de métaboliser le tréhalose avait un impact sur la virulence, les auteurs en ont administré oralement à des souris transplantées avec un microbiote humain et infectées soit par une souche du ribotype RT027 (R20291), soit par la même souche mais délétée pour le gène TreA (R20291Δ TreA), donc incapable de métaboliser le tréhalose. La mortalité était bien moindre avec cette dernière souche R20291Δ TreA (Figure 1).
Point clés
-
Les foyers d’infection à C. difficile par des souches épidémiques hypervirulentes (ribotypes RT027 et RT078) sont apparus au début des années 2000.
-
Le tréhalose est un disaccharide très résistant utilisé dans l’industrie agroalimentaire depuis 2000.
-
Les souches RT027 et RT078 ont acquis un avantage compétitif leur permettant d’utiliser le tréhalose, même à de faibles concentrations, ce qui augmente leur virulence.
Dans une seconde expérience, les auteurs ont infecté des souris ayant un microbiote humain avec la souche du ribotype RT027 (R20291) en présence ou en absence de tréhalose dans l’eau de boisson (donné à une dose équivalente à celle reçue dans un repas humain). La mortalité était bien supérieure en présence de tréhalose. Les deux expériences cumulées confirment l’hypothèse selon laquelle le tréhalose alimentaire contribue à la sévérité des souches du ribotype RT027. L’analyse génétique des souches du ribotype RT078 a montré l’insertion de 4 gènes encodant une 2e copie de la phosphotrehalase (TreA2) et de son répresseur (TreR2) et 2 autres gènes reliés. Une approche par mutation et surexpression a permis de confirmer que cette insertion était responsable de la capacité des souches du ribotype RT078 à pousser en présence de tréhalose.
Quelles sont les conséquences en pratique ?
Le tréhalose est un sucre extrêmement stable, résistant à la fois aux hautes températures et à l’hydrolyse. Considéré comme idéal pour une utilisation dans l’industrie agro-alimentaire, son usage ne s’est repandu qu’à partir de 2000, date à laquelle un nouveau procédé de production à bas coût a été découvert [3]. Son utilisation a été autorisée dans l’alimentation par la Food and Drug Administration (FDA) américaine en 2000 et par les institutions européennes en 2001. L’adoption large du tréhalose coïncide avec l’émergence des foyers d’infections par les souches RT027 et RT078. L’ensemble de ces résultats suggère un rôle causal du tréhalose alimentaire dans l’émergence de ces souches épidémiques hypervirulentes de C. difficile.
Conclusion
L’adoption large du tréhalose dans l’industrie agro-alimentaire coïncide avec l’émergence des foyers d’infections par les souches RT027 et RT078 de C. difficile. Ces souches ont acquis la capacité d’utiliser le tréhalose à faible concentration, leur donnant un avantage sélectif par rapport aux autres souches dans un écosystème dans lequel le tréhalose a été introduit. Cette capacité à métaboliser le tréhalose augmente leur virulence. L’ensemble de ces résultats suggère un rôle causal du tréhalose alimentaire dans l’émergence de ces souches épidémiques hypervirulentes de C. difficile.






