De la diarrea a las enfermedades crónicas : las consecuencias bien documentadas de la disbiosis de la microbiota intestinal relacionada con los antibióticos.
El tratamiento con antibióticos puede tener lugar a veces sin ningún efecto secundario evidente a corto plazo. No obstante, la disbiosis provoca diarrea hasta en un 35 % de los pacientes; a largo plazo, las alteraciones de la microbiota producidas por los antibióticos pueden representar un factor de riesgo de enfermedades alérgicas, autoinmunitarias o metabólicas.
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Los antibióticos son una herramienta poderosa en la lucha contra las infecciones bacterianas. Sin embargo, las investigaciones también han documentado efectos perjudiciales en las billones de bacterias comensales que viven en el tracto intestinal. Esta disbiosis resultante hace que la microbiota intestinal sea menos capaz de cumplir sus funciones protectoras. A corto plazo, la disbiosis deja la puerta abierta a los microorganismos patógenos oportunistas y a la selección de bacterias multirresistentes. A largo plazo, la microbiota intestinal, a pesar de tener cierto grado de resiliencia, a veces puede no restablecerse por completo1,2; y se entiende que esto puede abrir el camino a una serie de enfermedades. En investigaciones recientes se ha demostrado que los antibióticos pueden alterar la diversidad bacteriana y la abundancia del microbioma normal y que este efecto puede prolongarse (normalmente de 8 a 12 semanas después de que se haya suspendido el tratamiento con antibióticos)3,4.
35%
La diarrea afecta hasta al 35% de los pacientes que reciben antibióticos.
La diarrea, el efecto adverso más común de los antibióticos
Como principal consecuencia a corto plazo, algunos pacientes tratados con antibióticos experimentan un cambio en su tránsito intestinal, que en la mayoría de los casos produce diarrea. La incidencia de la diarrea asociada a antibióticos (DAA) depende de diversos factores (edad, entorno, tipo de antibiótico, etc.) y puede variar entre el 5 % y el 35 % de los pacientes que toman antibióticos3,5,6.

Opinión de la especialista
Los antibióticos alteran la microbiota intestinal protectora, lo que puede tener consecuencias imprevistas, como la diarrea asociada a los antibióticos (en hasta el 35 % de los pacientes) y el desarrollo de cepas de microorganismos patógenos resistentes a los antibióticos, que son motivo de preocupación mundial en lo que respecta al aumento de los costos de la atención sanitaria y la mortalidad.
Entre los niños, este porcentaje puede llegar hasta el 80 %3. La mayoría de las veces, la diarrea es puramente funcional, causada por la disbiosis producida por los antibióticos. Suele ser de intensidad leve y autolimitada, y dura de 1 a 5 días. Los antibióticos que muestran un espectro más amplio de actividad antimicrobiana, como la clindamicina, las cefalosporinas y la ampicilina/amoxicilina, se asocian a mayores tasas de diarrea6.
Los antibióticos representan un extraordinario descubrimiento científico y salvan millones de vida, pero su uso excesivo e inadecuado ahora suscita grandes inquietudes para la salud, especialmente debido a la aparición de resistencia a los antibióticos y disbiosis. Leamos la página dedicada a esta cuestión.
El papel ambivalente de los antibióticos
El caso particular de la diarrea por C. difficile
En el 10 % al 20 % de los casos, la diarrea resulta de la infección por Clostridioides difficile (conocida formalmente como Clostridium difficile) que coloniza la microbiota6. Esta bacteria, que se mantiene en el medio ambiente a través de las esporas, es un anaerobio estricto gram- positivo que forma esporas. La infección se produce por la ingestión de esporas. En circunstancias específicas (por ejemplo, la disbiosis producida por antibióticos), las esporas pueden germinar, y las células bacterianas vegetativas de este microorganismo patógeno oportunista pueden colonizar los intestinos. En la fase infecciosa, C. difficile produce 2 toxinas que dañan los colonocitos y desencadenan una respuesta inflamatoria con una variedad de pronósticos clínicos, que van desde la diarrea moderada hasta la colitis pseudomembranosa, el megacolon tóxico o la muerte.
1/3
Cerca de 1/3 de los casos de DAA son producidos por C. difficile.
Los factores de riesgo comunes más reconocidos de la infección por C. difficile (ICD) son la edad superior a 65 años, el uso de inhibidores de la bomba de protones, las enfermedades concomitantes y, por supuesto, el uso de antibióticos. El último es el factor de riesgo modificable más relevante para la ICD. La asociación de los antibióticos con la ICD se ha confirmado en los hospitales y, más recientemente, en los entornos comunitarios7, donde el riesgo de infección varía entre intermedio para las personas expuestas a las penicilinas, alto para las que están expuestas a las fluoroquinolonas y más alto para las que reciben clindamicina. En cuanto a las tetraciclinas, estas no provocan un aumento del riesgo8. En un entorno hospitalario, el mayor riesgo de padecer ICD se observó con las cefalosporinas (de la 2.ª a la 4.ª generación), la clindamicina, los carbapenémicos, el trimetoprim - las sulfamidas, las fluoroquinolonas y las combinaciones de penicilina9.
Cuando la microbiota intestinal se convierte en un reservorio de resistencia a los antibióticos
Cuando se exponen a los antibióticos, las comunidades microbianas responden a corto plazo no solo cambiando su composición, sino también evolucionando, optimizando y diseminando los genes resistentes a los antibióticos. La microbiota del intestino humano expuesta excesivamente a los antibióticos se considera ahora un importante reservorio de genes de resistencia, tanto en adultos como en niños2. Al contribuir a la creciente dificultad de combatir las infecciones bacterianas, la resistencia a los antibióticos se ha convertido en una importante preocupación de salud pública.
Una puerta abierta a enfermedades no transmisibles
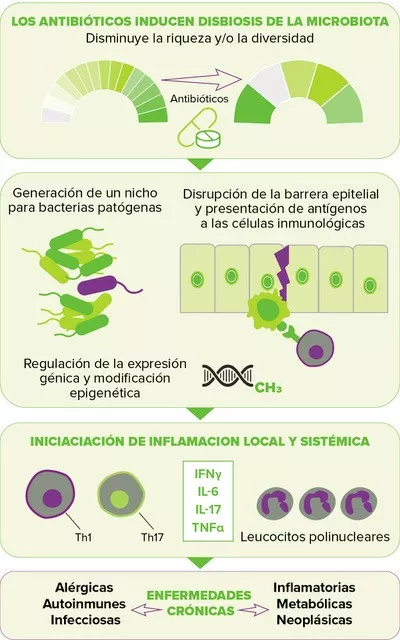
También se sospecha que la alteración de la microbiota intestinal producida por la exposición a antibióticos aumenta el riesgo de varias enfermedades crónicas al elevar las respuestas inflamatorias a nivel local y sistémico, lo que conduce a un metabolismo desregulado y a una homeostasis inmunológica comprometida10 (Figura 2, página 4). Se ha demostrado que el periodo perinatal, caracterizado por el desarrollo del sistema inmunológico junto con la maduración de la microbiota intestinal, es un periodo particularmente sensible, durante el cual la disbiosis producida por los antibióticos se traduce en efectos crónicos para la salud, es decir, en un mayor riesgo de enfermedades más adelante en la vida, incluidas las enfermedades inflamatorias del intestino (por ejemplo, la enfermedad de Crohn), las enfermedades atópicas (por ejemplo, el asma) y los trastornos metabólicos (por ejemplo, la diabetes de tipo 2 o la obesidad).
Caso clínico
del Lynne V. McFarland, PhD
-
Mujer de 53 años que consultó a su médico con antecedentes de tres días de síntomas en las vías respiratorias (tos, dolor de garganta y secreción nasal) con fiebre y cansancio. No se observaron enfermedades asociadas y, por lo demás, estaba sana. Su médico le tomó una muestra de esputo y le recetó dos dosis diarias de cefaclor de 500 mg durante 10 días. Los cultivos de esputo dieron negativo en cuanto a los microorganismos patógenos.
-
Ingresó en el hospital el tercer día del tratamiento con antibióticos porque presentó una diarrea aguda (con seis deposiciones líquidas al día y cólicos) y síntomas respiratorios no resueltos. Los cultivos de laboratorio (esputo y heces) dieron negativo en cuanto a los microorganismos patógenos. Dejó de tomar sus antibióticos, pero la diarrea continuó durante los dos días siguientes.
-
Su médico le recetó eritromicina de 500 mg tres veces al día y un probiótico durante una semana. Sus síntomas respiratorios y la diarrea desaparecieron en cuatro días y fue dada de alta un día después sin complicaciones.
Desde 2015, la OMS organiza cada año la Semana mundial de concienciación sobre la RAM (WAAW), cuyo objetivo es sensibilizar al público sobre la resistencia mundial a los antimicrobianos. Esta campaña, que tendrá lugar del 18 al 24 de noviembre, alienta al público general, a los profesionales sanitarios y a los responsables a hacer un uso razonable de los antimicrobianos para evitar el desarrollo de resistencia a los antimicrobianos.